長鏈非編碼RNA 在胰腺癌吉西他濱耐藥研究中的作用
郭晨博毛玉寧張延英汪永鋒?師長宏?
(1.甘肅中醫藥大學,蘭州 730030;2.空軍軍醫大學實驗動物中心,西安 710032;3.延安大學醫學院,陜西 延安 716000)
胰腺癌(pancreatic cancer,PC)是全球危害最嚴重的惡性腫瘤之一,其發病率和死亡率分別位于惡性腫瘤的第七位和第六位。 手術切除仍是PC 患者唯一可能治愈的手段,但由于PC 早期缺乏臨床癥狀和體征,直到晚期才被發現,導致手術效果不佳[1]。 雖然近幾年免疫療法在PC 治療方面取得了一定的進展,但化療仍然是PC 治療的主要手段[2]。吉西他濱(gemcitabine,GEM)是治療PC 的一線化療藥物,由于長期使用GEM 容易產生耐藥性,導致其治療效果不佳[3]。 因此深入研究GEM 產生耐藥的原因和機制對PC 的治療具有重要的意義。
文獻報道胰腺癌吉西他濱耐藥與細胞自噬、腫瘤細胞干性、 上皮- 間充質轉化(epithelialmesenchymal transition,EMT) 等多種腫瘤表型密切相關[4]。 胰腺癌吉西他濱耐藥具體的調控機制并不明確,明確其機制有助于改善吉西他濱的治療效果。 長 鏈 非 編 碼 RNA (long non-coding RNA,lncRNA)具有調控細胞自噬、腫瘤細胞干性、上皮-間充質轉化( epithelial-mesenchymal transition,EMT)、細胞凋亡等多種生物學途徑,研究表明lncRNA 可通過以上途徑調控腫瘤細胞耐藥[5]。 本文對lncRNAs 在胰腺癌耐藥中的作用進行歸納總結,以期為臨床提高GEM 敏感性提供理論基礎,為探索新的干預靶點提供思路。
1 lncRNA
長鏈非編碼RNA (long non-coding RNA,lncRNA)是一種大小超過200 bp 的非編碼RNA,異常表達的lncRNA 與腫瘤的發生、發展密切相關,lncRNA 可以通過與DNA、RNA 以及蛋白質相互作用,調節蛋白質/RNA 穩定性[6]。 lncRNA 調節細胞生物學活動取決于其在細胞中的定位:在細胞核中lncRNA 通過染色質相互作用和重塑來調節轉錄程序,并通過支架建立核室的空間組織。 例如:lncRNA 作為誘餌調控蛋白與DNA 或其他蛋白的結合[7]。 lncRNA-生長停滯特異性轉錄物5(growth arrest-specific transcript 5, GAS5)充當誘餌,使效應蛋白與受體蛋白結合,從而使腫瘤轉移和耐藥[8];lncRNA 漿 細 胞 瘤 多 樣 異 位 基 因(plasmacytomavariant translocation 1, PVT1)中含有幾個基因內增強子,能通過調節MYC 癌基因啟動子的轉錄,抑制MYC 癌基因的表達,從而調控腫瘤的發展與耐藥[8]。 在細胞質中,lncRNA 的功能是介導信號轉導途徑、翻譯程序和基因表達的轉錄后調控。 例 如: lncRNA-HOX 轉錄 反 義 RNA (HOX transcription antisense intergenic RNA,HOTAIR) 可以海綿化miRNA,消除lncRNA HOTAIR 對癌基因的促進作用,使腫瘤耐藥[9];lncRNA ANRIL 通過染色質修飾復合物調節順式和反式基因,以及影響microRNA 信號網絡調控腫瘤的發展[10];lncRNA 作為競爭性內源RNA(ceRNAs), 可以隔離miRNA,從而阻止其靶向mRNA 的抑制,lncRNA SNHG14 被發現作為miRNA 的競爭性內源RNA,調節癌癥中癌基因的表達從而調控腫瘤的發展[11];長基因間非蛋白編碼RNA (reprogramming regulator, linc-ROR)首次在誘導多能干細胞(iPSCs) 中被發現,受到腫瘤多能因子的影響,從而促進腫瘤的發展[12]。 Linc-DYNC2H1-4 主要位于胞漿中,可以海綿化靶向miRNA,以恢復EMT 和CSC 相關基因的表達[13]。lncRNA 通過多種方式在表觀遺傳、轉錄、轉錄后、翻譯和翻譯后水平發揮調控作用,影響耐藥性的產生,可能成為多種癌癥診斷的新標記物和治療的重要靶點。
2 lncRNA 通過調節細胞自噬調控胰腺癌吉西他濱耐藥
自噬是細胞質成分在細胞內降解的一種機制,在應激條件下維持細胞內穩態。 在腫瘤中,自噬具有抑制腫瘤和支持腫瘤進展的雙重作用,它參與耐藥的發展,使腫瘤細胞不受化療藥物的影響,也可殺死不活躍的腫瘤細胞,因此自噬在腫瘤耐藥中起到了關鍵作用[14]。 研究表明,胰腺癌吉西他濱耐藥和自噬有著非常密切的關系,而lncRNA 在自噬調控中至關重要,通過調節自噬相關lncRNA 可恢復胰腺癌吉西他濱的敏感性[15]。 lncRNA 調節自噬的具體機制可以分為3 類:(1)lncRNA 充當競爭性內源RNA(competitive endogenous RNA,ceRNA)結合miRNA 以調節miRNA 表達,從而影響自噬進程;(2)lncRNA 通過影響自噬相關基因的表達;(3)lncRNA 通過Wnt/β-catenin 途徑抑制自噬介導的細胞凋亡[16]。 構建胰腺癌吉西他濱耐藥細胞株,是研究lncRNA 在胰腺癌吉西他濱耐藥中作用的基礎。Wang 等[17]探究lncRNA ANRIL 在胰腺癌吉西他濱耐藥中的機制發現lncRNA ANRIL 通過靶向miR-181a,激活HMGB1 誘導的細胞自噬,從而增強胰腺癌細胞對吉西他濱的耐藥。 Zhang 等[18]通過體外實驗發現lncRNA SNHG14 通過分泌miR-101 激活胰腺癌細胞自噬增強吉西他濱耐藥性。 Zhou 等[19]通過體外實驗發現lncRNA PVT1 通過激活Wnt/βcatenin 和調節miR-6195p/Pygo2 以及miR-619-5p/ATG14 軸的自噬途徑,從而促進胰腺癌對吉西他濱的耐藥性;在體內CDX 模型中驗證了lncRNA PVT1在胰腺癌吉西他濱耐藥中的作用。 Li 等[20]在體外實驗中發現linc-ROR 通過miR-124/PTBP1/PKM2軸誘導自噬使胰腺癌細胞對吉西他濱產生耐藥;再利用PDX 模型驗證了linc-ROR 在胰腺癌吉西他濱耐藥中的作用。
腫瘤耐藥細胞通過調節自噬增加對化療的抵抗力,自噬在胰腺癌吉西他濱耐藥中發揮著重要的作用,但目前自噬調控的機制并不明確,這給臨床通過抑制自噬增加胰腺癌吉西他濱敏感性的研究帶來了困擾。 已有報道稱lncRNA PVT1 是一種致癌基因,作為ceRNA 或分子海綿負調控miRNA 調節自噬促進了腫瘤的發展和化療藥物耐藥,lncRNA PVT1 可能通過誘導自噬調節胰腺癌吉西他濱耐藥[21]。 在未來研究中lncRNA PVT1 可能成為治療胰腺癌吉西他濱耐藥的新靶點[22]。
3 lncRNA 通過調節腫瘤細胞干性調控胰腺癌吉西他濱耐藥
腫瘤干細胞(cancer stem cells,CSCs) 是腫瘤細胞的一個亞群,可以驅動腫瘤的發生與復發,CSCs是腫瘤發生的來源,也是腫瘤化療耐藥的原因之一。 CSCs 對化療和放療均有抵抗作用,放化療后殘留的CSCs 能夠促進腫瘤復發和對放化療產生抵抗[23]。 研究發現,PC 在經過吉西他濱治療后,胰腺癌細胞內CSCs 的含量顯著增加。 lncRNAs 是CSCs的關鍵調控因子,能夠促進腫瘤耐藥[24]。 在膀胱癌中lncRNAs 通過增加CSCs 在腫瘤中的比例使化療藥物產生耐藥[25]。 綜上所述lncRNA、CSCs 和耐藥這3 者可能有著密切的關系。 Liu 等[26]采用胰腺癌細胞株PANC-1、ASPC-1、CAPAN-2、SW19990,通過實驗發現lncRNA GAS5 能逆轉CSCs 介導的吉西他濱耐藥。 Wang 等[27]構建胰腺癌PANC-1 吉西他濱耐藥細胞株,通過實驗發現吉西他濱通過誘導lncRNA HOTAIR 表達進而誘導胰腺癌干細胞耐藥。Gao 等[28]分別建立了人胰腺癌BxPC-3-Gem 耐藥細胞和PDX 模型,體內外實驗發現linc-DYNC2H1-4通過分泌miR-145 促進CSCs 使胰腺癌吉西他濱耐藥。 LncRNA 不止是可以通過促進腫瘤細胞干性促進腫瘤細胞產生耐藥,部分lncRNA 也可通過調節腫瘤細胞干性逆轉耐藥。 Yoshida 等[29]建立BxPC3耐藥株CDX 模型,通過實驗發現lncRNA PVT1 通過調控胰腺癌細胞中CSCs 的含量逆轉胰腺癌細胞對吉西他濱的耐藥性。
綜上所述,CSCs 與胰腺癌吉西他濱耐藥有著密切的聯系,研究CSCs 與吉西他濱耐藥的關系,可為臨床上治療胰腺癌吉西他濱耐藥提供新的思路和方法。 目前,在乳腺癌耐藥中,通過調控CSCs 信號通路的藥物已進入臨床試驗階段[30]。 已有研究證明lncRNA PVT1 可在體外和體內增強肝CSC 能力,主要通過穩定核仁蛋白NOP2 介導肝細胞獲得干細胞樣特性,研究發現lncRNA PVT1 具有調節腫瘤細胞干性的作用[31],lncRNA PVT1 通過調節腫瘤細胞干性調控胰腺癌吉西他濱耐藥,可能為以后臨床上腫瘤干性程度高的胰腺癌治療提供了潛在的靶點。
4 lncRNA 通過調節EMT 調控胰腺癌吉西他濱耐藥
上皮細胞-間充質細胞轉變(EMT)是一種使細胞和細胞粘附復合物松散并增強細胞的轉移和侵襲特性的胚胎程序。 腫瘤細胞需要經歷這個轉變過程而實現轉移,同時使腫瘤細胞獲得更強的侵襲性以及對細胞凋亡的抵抗性[32]。 研究發現吉西他濱耐藥細胞表現出更強的侵襲性,這有可能和腫瘤耐藥之后發生EMT 相 關[33]。 lncRNA 可 通 過 內 源 性 競 爭miRNA,調控與EMT 相關的一些轉錄因子的表達,進而影響EMT 進程[34]。 如在膽囊癌中,lncRNA 通過調控EMT,促進膽管腫瘤細胞吉西他濱耐藥[35]。 在胰腺癌中,Liu 等[26]分別使用胰腺癌細胞株PANC-1、ASPC-1、CAPAN-2、SW19990 進行體外實驗,發現lncRNA GAS5 通過靶向miR-221/SOCS3 逆轉EMT 介導的胰腺癌吉西他濱耐藥。 Gao 等[28]建立人胰腺癌BxPC-3-Gem 耐藥細胞和腫瘤異種移植模型,發現linc-DYNC2H1-4 通過分泌miR-145 促進胰腺癌細胞EMT 使胰腺癌吉西他濱耐藥。
對比腫瘤細胞和腫瘤耐藥細胞發現腫瘤耐藥細胞表現出了更強的侵襲性,這有可能和EMT 有關。 LncRNA 具有調控EMT 的作用,需要找出調控EMT 的關鍵lncRNA,研究表明lncRNA GAS5 是調節EMT 的關鍵分子,lncRNA GAS5 可作為miRNA或剪切因子的誘餌,通過靶向結合miRNA 而負性調控miRNA 下游靶基因的表達調控EMT[36],這可能為臨床上治療EMT 程度高的胰腺癌吉西他濱耐藥提供新的靶點。
5 總結與展望
胰腺癌被稱為“癌王”,5 年內生存率極低,化療預后差,準確評估患者狀況是胰腺癌患者治療最重要的環節,因此找到胰腺癌吉西他濱耐藥的生物標志物有著重要的意義。 目前lncRNA 表達對患者預后的研究發現癌組織和血清中的lncRNA 與癌旁組織有著明顯的差異,而癌組織和血清中的lncRNA表達呈正相關,再通過生存曲線分析血清中lncRNA表達與癌癥患者預后的關系。 因此,將以上lncRNA進行分析對比,以期尋找到胰腺癌吉西他濱耐藥的預后標志物。 近幾年測定患者唾液中lncRNA 水平并探討其作為胰腺癌的早期生物學指標的價值取得了令人滿意的成果,提示我們可以從患者體液,如唾液、尿液、血液等標本獲取lncRNA,從而提高其臨床應用的可行性[37]。
研究表明胰腺癌吉西他濱耐藥與lncRNA 關系密切,不同的lncRNA 通過不同的途徑發揮各自的作用(見表1)。 大多數lncRNA 在胰腺癌吉西他濱耐藥中上調,通過直接或間接的調節相關基因的表達影響胰腺癌吉西他濱耐藥。 其中也有單個lncRNA 通過調節多個表型發揮作用,例如:lncRNA PVT1 可以通過調節自噬和CSCs 促使胰腺癌吉西他濱耐藥,lncRNA GAS5 也可通過調節CSCs 和自噬促進胰腺癌吉西他濱耐藥。 通過揭示不同lncRNA 在胰腺癌吉西他濱耐藥中的具體作用機制,可為臨床治療胰腺癌吉西他濱耐藥帶來新的靶向藥物。 比如lncRNA H19 的靶向藥物BC-819(DTAH19),目前正在進行包括PC 在內的人類惡性腫瘤的臨床試驗[38]。 目前臨床上PC 早期生物標志物的缺乏和獲得性耐藥是PC 治療的難點,因此,迫切需要尋找一種新的腫瘤生物標志物和治療靶點來進行早期診斷和治療。 未來應大量開展胰腺癌動物模型實驗,進一步深入研究lncRNA 的潛在機制,發現具有腫瘤耐藥后特異性表達的lncRNA,基于特定lncRNA 的表達情況對化療藥物的效果進行評判,這將是未來臨床上治療PC 所要突破的重點問題。 綜上所述,發現lncRNA PVT1 可以調控多個表型調節胰腺癌吉西他濱耐藥,并在不同的胰腺癌吉西他濱耐藥細胞株得到了驗證。 期望在未來,基于lncRNA PVT1 在胰腺癌吉西他濱耐藥中的研究可以在臨床上取得重要的突破。
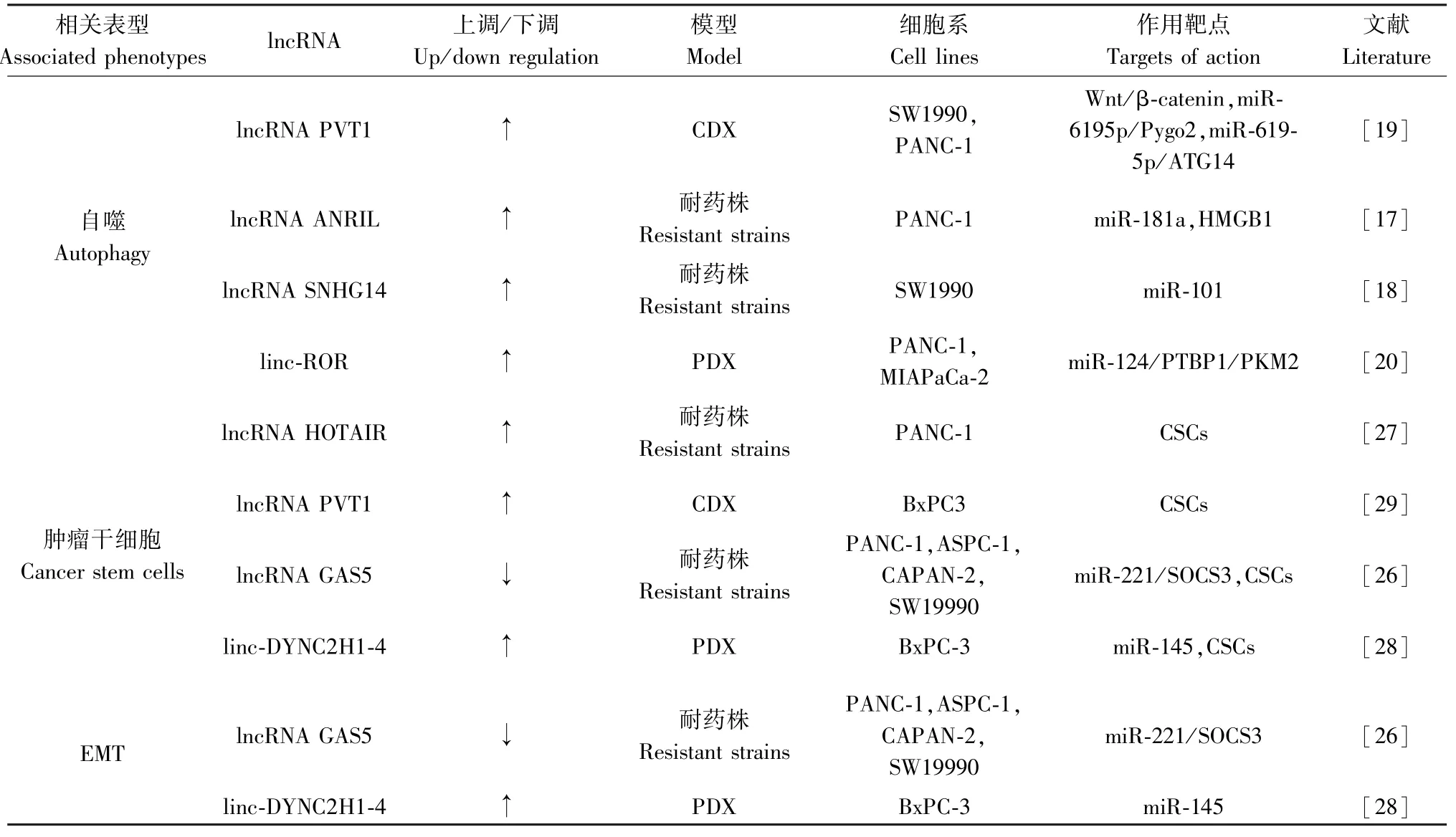
表1 lncRNA 在胰腺癌吉西他濱耐藥中的作用機制Table 1 The mechanism of lncrna in gemcitabine resistance of pancreatic cancer

