基于網絡藥理學研究“杜仲-續斷”藥對治療膝關節炎的作用機制
許茂玉,盛炎炎,方 祥,周正新,李文華,朱 磊
(1.安徽中醫藥大學,安徽 合肥 230012; 2.安徽中醫藥大學第一附屬醫院骨科,安徽 合肥 230031)
膝關節炎(knee osteoarthritis,KOA)是一種以軟骨和軟骨下骨退變、磨損及滑膜炎癥為特征,以疼痛、畸形和功能障礙為臨床表現的常見慢性筋骨疾病,嚴重影響患者的生活質量。KOA是使老年人致殘的常見疾病之一,與性別、年齡、體質量指數、生物力學等因素有關[1]。該病好發于中老年人群,且女性多于男性。
中醫學將KOA歸屬于“痹證”“骨痹”范疇[2]。中醫藥治療KOA由來已久,早在《黃帝內經》就確立了“痹證”的基礎理論體系。中醫認為KOA因肝腎虧虛、筋脈瘀滯所致,總體治療原則以補肝益腎、強筋健骨、活血化瘀為主[3]。中藥治療KOA具有療效確切、安全性高的優勢,對KOA的治療具有很好的臨床效應,在KOA的診治中起到至關重要的作用。杜仲的主要功效為補肝腎、強筋骨、安胎,用于治療肝腎不足、腰脊酸疼、足膝痿弱。現代藥理學研究[4]表明,杜仲具有抗炎、抗氧化和促進骨愈合的作用。續斷的主要功效是補肝腎、強筋骨、續折傷、止崩漏,用于治療肝腎不足、腰膝酸軟、筋傷痹痛等。現代藥理研究[5]顯示,續斷具有抗炎、促進骨愈合、平衡骨吸收與骨形成速率的作用。杜仲-續斷配伍使用具有補腎壯骨、通痹止痛的作用[6]。但杜仲-續斷配伍治療KOA的作用機制尚不明確,因此有必要基于網絡藥理學方法進行探究。
網絡藥理學是藥理學融合多學科方法而形成的一種新學科,能夠全面地反映藥物對疾病網絡的分子作用機制[7]。本研究運用網絡藥理學和分子對接的方法,從杜仲、續斷的化學物質基礎出發,更加系統深入地挖掘杜仲-續斷配對調治KOA的重要靶點和潛在的分子作用機制,以期更好地為治療KOA的臨床用藥提供理論參考,同時為治療KOA的新藥研發提供新思路。
1 資料與方法
1.1 杜仲-續斷相關靶點篩選 通過中藥系統藥理數據庫和分析平臺(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP;https://tcmspw.com/tcmsp.php)[8]檢索杜仲、續斷的化學成分,根據口服生物利用度(oral bioavailability,OB)≥30%且類藥性指數(drug-likeness,DL)≥0.18[9]對活性成分進行初步篩選,以獲取活性化合物,結合SwissTargetPrediction平臺(http://www.swisstargetprediction.ch/)查找藥物作用的有效蛋白質靶點。
1.2 杜仲-續斷活性的成分-靶點網絡 篩選出蛋白質靶點后,利用Uniprot蛋白質數據庫(http://www.uniprot.org)為化合物作用的蛋白質靶點信息進行標準化,使用Cytoscape3.8.0[10]構建杜仲-續斷活性成分-靶點網絡,其中“node”表示靶點,“edge”表示兩者之間的關系。
1.3 KOA相關靶點篩選 通過檢索OMIM數據庫(http://www.omim.org)[11]、GeneCards數據庫(http://genecards.org)[12]、TTD數據庫(http://db.idrblab.net/ttd/)[13]中KOA的潛在靶點,結合DrugBank數據庫(https://go.drugbank.com/)挖掘治療KOA的臨床藥物作用靶點[14]。合并4個疾病數據庫靶點后,刪除重復值得到KOA的靶點。
1.4 蛋白質交互作用(protein-protein interaction,PPI)網絡構建 為明確杜仲-續斷潛在靶點與KOA相關靶點之間的相互作用,運用Venny 2.1.0平臺(https://bioinfogp.cnb.csic.es/tools/venny/)將杜仲-續斷成分靶點與疾病靶點取交集,并繪制韋恩圖。將共同靶點輸入String 11.0數據庫(http://string-db.org)構建PPI網絡模型,選擇蛋白種類為“Homo sapiens”,最小互相作用值設置為“medium confidence(0.400)”,隱藏網絡中斷開連接的節點,得到PPI網絡。
1.5 杜仲-續斷成分-KOA靶點功能與通路的富集分析 David平臺(https://david.ncifcrf.gov/home.jsp)擁有一套全面的功能注釋工具,以了解大量基因背后的生物學含義。將杜仲-續斷配對調治KOA的共同靶點錄入David平臺,獲取生物學過程和信號通路并進行富集分析,將獲得的4個數據庫資料根據count值選用TOP10、TOP20數據采用微生信平臺(http://www.bioinformatics.com.cn/)繪制GO富集分析條形圖、KEGG通路富集分析氣泡圖。
2 結果
2.1 杜仲-續斷活性成分與靶點的獲取 初步提取杜仲化學成分147種、續斷化學成分31種,經ADME篩選和SwissTargetPrediction平臺補充后共獲得杜仲28種、續斷7種有效活性成分,包括β-谷甾醇(beta-sitosterol)、槲皮素(quercetin)。杜仲有效成分作用靶點489個,續斷有效成分作用靶點75個,合并后刪除重復值共得到靶點243個。利用Cytoscape3.8.0對杜仲-續斷活性成分及其作用靶點的關系網絡進行繪制和分析,共獲得279個節點與561條關系,節點的面積代表Degree值大小,面積越大說明該節點越重要,結果見圖1。

注:三角形為藥物有效活性成分,菱形為靶點,面積代表Degree值大小;DZ代表杜仲,XD代表續斷;A為杜仲、續斷共有活性成分圖1 杜仲-續斷活性成分-靶點網絡圖
2.2 KOA相關靶點的獲取 從GeneCards數據庫中共獲得KOA潛在靶點2 070個,相關性得分(relevance score, RS)越高則代表該靶點與疾病聯系更密切。本研究設定RS大于2倍中位數的目標靶點作為KOA的潛在靶點,在該數據庫中KOA靶點RS的中位數為1.32,故設定RS>2.64的靶點為KOA的潛在靶點,共1 021個。結合OMIM、DrugBank、TTD數據庫補充相關靶點,合并4個數據庫相關靶點后刪除重復值,最終得到1 072個KOA相關靶點。
2.3 PPI網絡的構建 將篩選出來的藥物有效活性成分靶點與KOA疾病靶點取交集,得到杜仲-續斷藥物成分-KOA共同靶點98個。進而將共同靶點輸入String平臺,得到杜仲-續斷藥對-KOA靶點的PPI網絡,見圖2。
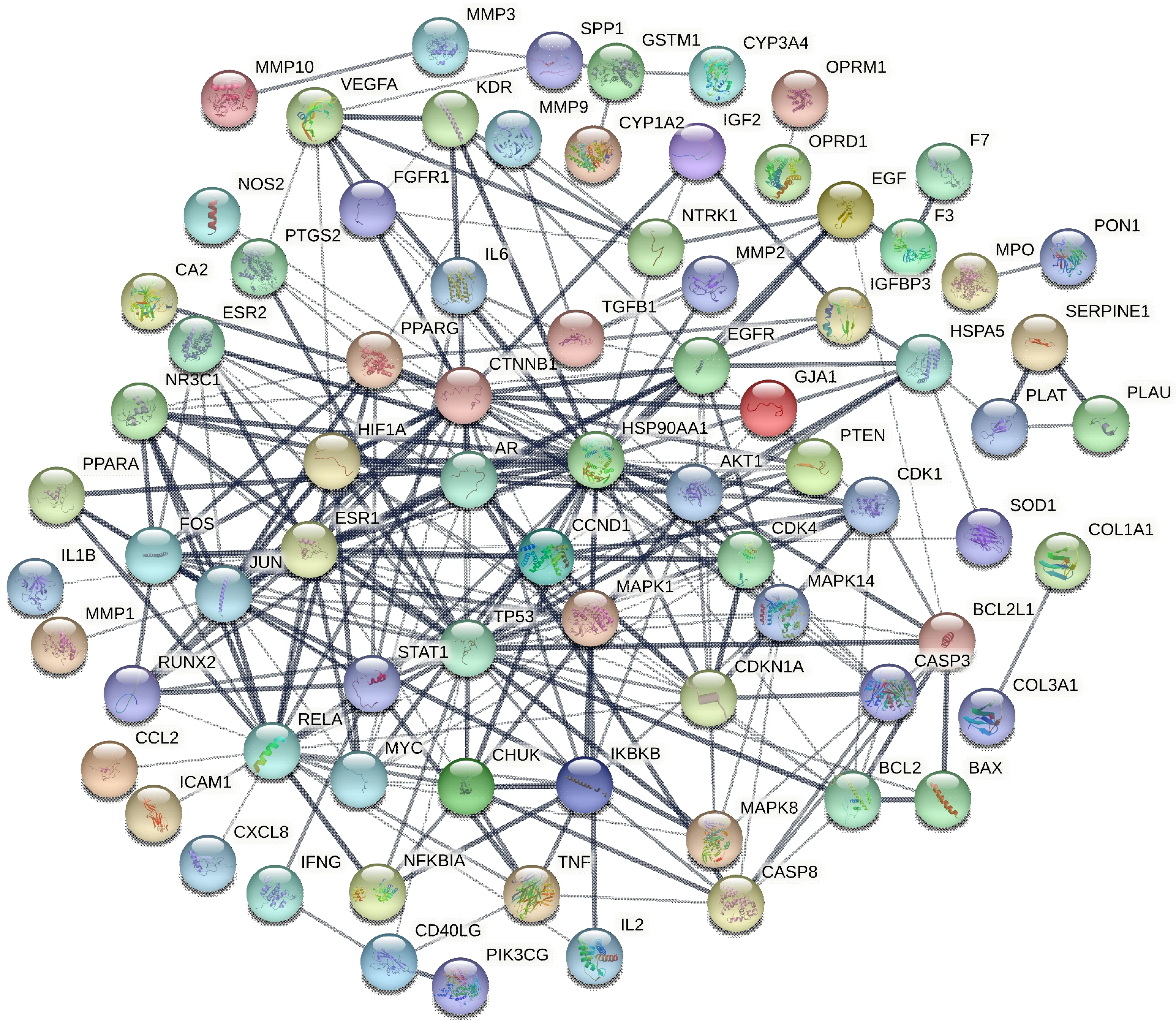
圖2 杜仲-續斷藥對-KOA靶點PPI網絡圖
2.4 靶點功能與通路的富集分析 應用David數據平臺對上述獲取的98個杜仲-續斷藥對調治KOA的關鍵節點進行信號通路分析,借助微生信平臺對結果進行可視化。結果表明,多個靶點的功能與KOA的發生密切相關。杜仲-續斷藥對主要參與的生物學過程包括RNA聚合酶Ⅱ啟動子的轉錄正調控(positive regulation of transcription from RNA polymerase Ⅱ promoter)、藥物反應(response to drug)、凋亡過程的負調控(negative regulation of apoptotic process)、轉錄的正調控DNA模板(positive regulation of transcription, DNA-templated)、炎癥反應(inflammatory response)等,見圖3中BP。在細胞組分中,主要作用于細胞外隙(extracellular space)、細胞核(nucleus)、細胞質(cytosol)、細胞質(cytoplasm)、胞外區(extracellular region)等,見圖3中CC。相關靶點調節KOA的功能主要富集于蛋白結合(protein binding)、酶結合(enzyme binding)、相同的蛋白結合(identical protein binding)、蛋白質同二聚活動(protein homodimerization activity)、ATP結合(ATP binding)等,見圖3中MF。將KEGG通路結果繪制成氣泡圖,氣泡顏色從青到紅代表Lg(P)值由小到大,氣泡面積代表該通路的基因計數,橫軸代表該通路基因富集數。KEGG富集通路顯示杜仲-續斷藥對防治KOA的通路與腫瘤壞死因子(tumor necrosis factor,TNF)信號通路、磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol-3-kinase/protein kinase B,PI3K/Akt)信號通路、絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信號通路等通路相關。見圖4。
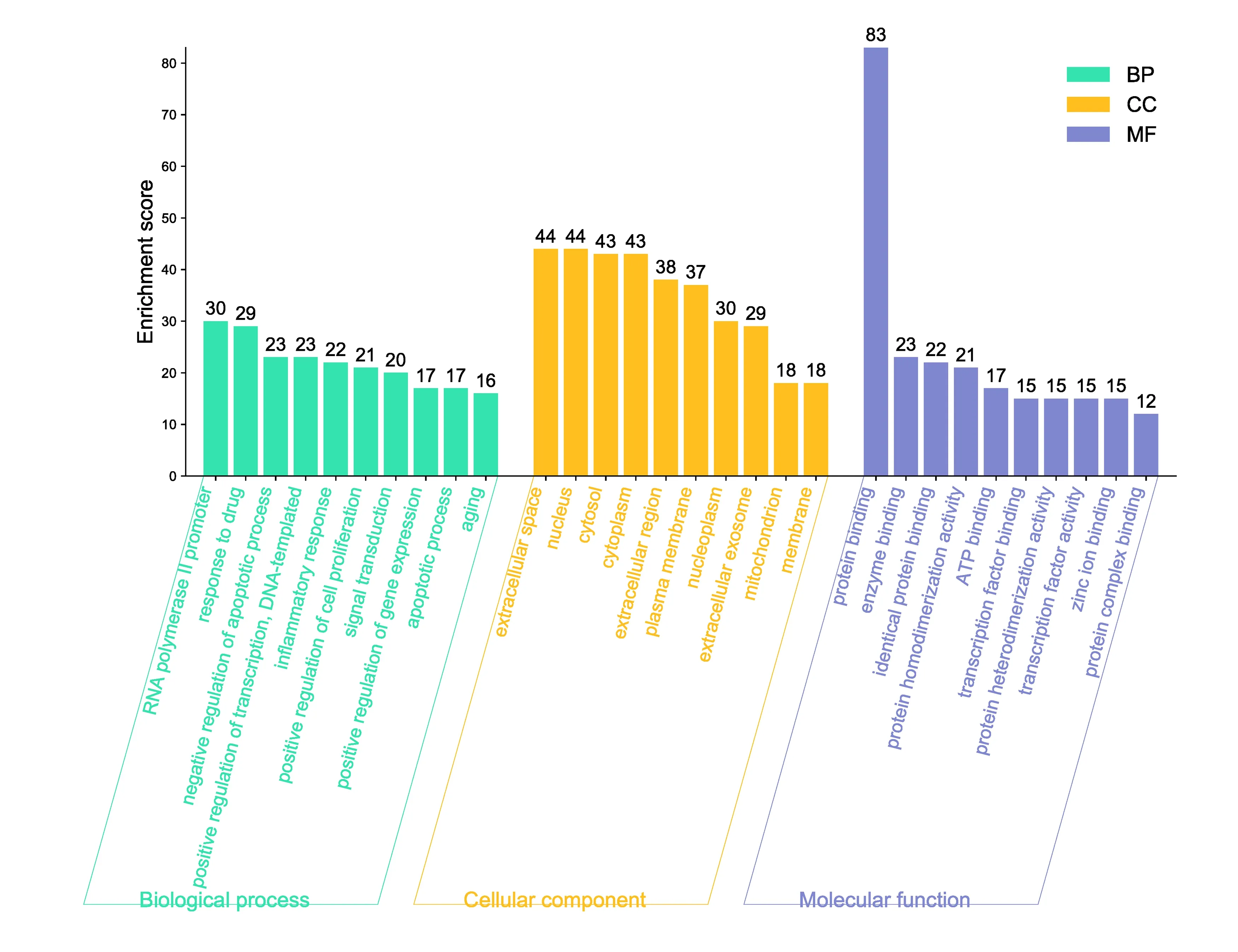
注:綠色代表生物過程(biological process,BP),藍色代表細胞組成(cellular component,CC),紅色代表分子功能(molecular function,MF);Enrichment score代表富集基因數,數值越大代表BP、CC、MF越重要圖3 杜仲-續斷藥對治療KOA的作用靶點富集分析條形圖
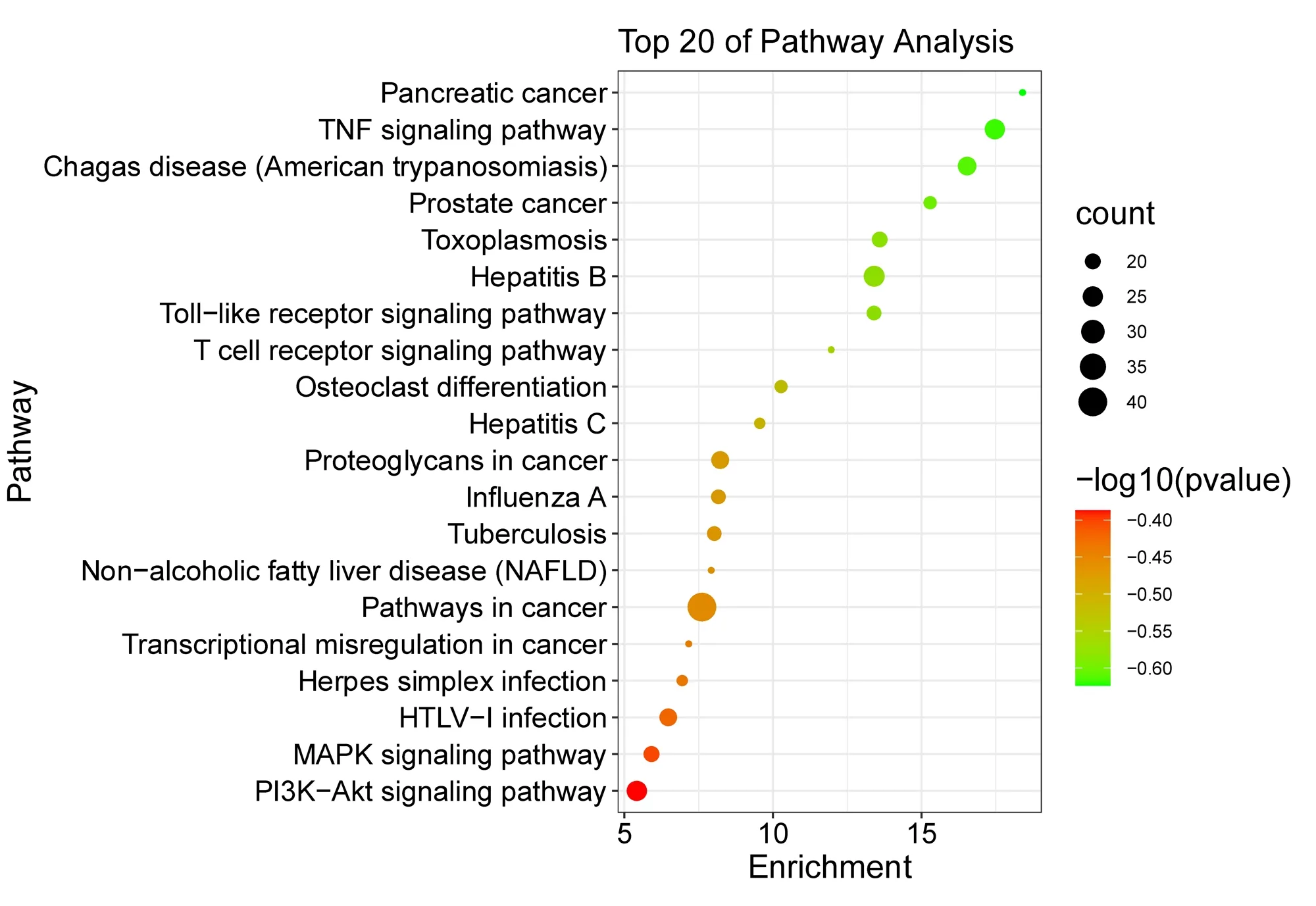
注:橫坐標為該通路富集的基因數,氣泡越大、顏色越紅,代表富集程度越顯著圖4 杜仲-續斷藥對治療KOA的KEGG通路富集分析氣泡圖
3 討論
通過分析圖1可以得出,β-谷甾醇、槲皮素等可能是杜仲-續斷藥對治療KOA的核心有效成分。β-谷甾醇是植物甾醇類,屬于四環三萜類化合物,具有抗炎、鎮痛、抗氧化和調節骨代謝平衡的作用[15]。有研究發現β-谷甾醇能明顯抑制TNF-ɑ、白細胞介素-2(interleukin-2,IL-2)、C-反應蛋白(C-reactive protein, CRP)的水平起到抗炎作用,從而減輕關節炎的癥狀,同時還具有促進成骨和抑制破骨作用,達到骨保護的效果[16]。槲皮素是一種類黃酮化合物,存在于許多植物類藥材中。現代藥理學研究[17]表明,槲皮素具有抗炎、抗氧化的作用,通過降低TNF-ɑ、IL-6、CRP的含量從而具有治療關節炎的作用,通過降低軟骨變性和膝關節軟骨細胞凋亡從而起到保護關節的作用。此外,槲皮素可以通過MAPK信號通路恢復成骨細胞功能,進而起到骨保護的作用[18]。KOA的臨床疼痛癥狀多由局部炎癥反應所致,杜仲-續斷藥對中活性物質β-谷甾醇、槲皮素在炎癥反應中都具有獨特的生物抗炎特性,符合KOA的治療原則。
從本次PPI網絡分析結果得到較為重要的靶點有MAPK1、TNF等。MAPK1屬于MAPK家族成員,可被炎癥因子激活,參與細胞增殖、分化的調節。有研究[19]表明,MAPK的高表達與軟骨的降解密切相關,同時在保護關節被破壞方面具有極其重要的作用。TNF是由巨噬細胞分泌,能夠激活細胞增殖,誘導細胞分化。病理研究[20]表明,在KOA的發病過程中,TNF是關鍵的炎癥遞質,密切參與調節炎癥反應。同時有研究顯示,TNF與KOA軟骨變性相關,能夠延緩軟骨變性和KOA發展的作用[21]。可見,杜仲-續斷藥對可通過減輕炎癥反應、調節細胞代謝和KOA靶點蛋白表達,從而緩解KOA的進程。
KOA發病首先侵犯關節軟骨,參與關節軟骨細胞增殖、分化的信號通路對于治療KOA至關重要。KEGG通路富集分析結果顯示,杜仲-續斷藥對治療KOA涉及的信號通路有TNF信號通路、PI3K-Akt信號通路、MAPK信號通路。①TNF信號通路。Bonaventura等[22]研究發現,TNF信號通路參與炎癥反應,調節軟骨細胞、滑膜細胞的功能,從而促進血管增生、滑膜增殖。②PI3K-Akt信號通路。該通路屬于調節自噬的經典通路,參與調節關節軟骨細胞的平衡[23],已被證實與血管修復再生、成骨細胞和破骨細胞分化密切相關[24]。相關研究[25]表明,PI3K-Akt信號通路在KOA患者中被抑制,該通路能夠促進軟骨細胞的自噬與凋亡,減少軟骨細胞丟失率和減輕炎癥反應,從而緩解KOA的癥狀。③MAPK信號通路。該通路屬于骨關節炎軟骨損傷的重要信號傳導通路,能夠影響成骨細胞的分化和凋亡[26],同時有研究[27]證明該通路在改善KOA癥狀方面發揮重要作用。重要靶點富集出眾多信號通路,可見杜仲-續斷對于KOA的復雜調控過程,以上所討論通路是重要靶點作用的主要通路,均與軟骨細胞密切相關,可能在調控KOA的過程中起到關鍵作用。
綜上,杜仲-續斷藥對調治KOA的主要成分可能是β-谷甾醇、槲皮素作用于MAPK1、TNF靶點,涉及的通路有TNF、PI3K-Akt、MAPK通路等,與炎癥反應、自噬、血管生成、骨代謝等多個生物學過程息息相關。由此可知,杜仲、續斷相須的配伍使用并不是簡單的相同成分含量的增加,而是通過相關信號通路形成互補作用。本研究結果可為臨床治療KOA的用藥提供一定的理論參考,同時能夠為新藥的研發提供新思路。

