利奈唑胺不敏感腸球菌的耐藥機制及分子分型
陳清清, 吳云麗, 吳一波, 林玉玲, 閆小利, 邱慧娜, 張建明, 鄭廷金, 張志珊
腸球菌對利奈唑胺耐藥機制除主要為23S rRNA基因的突變外,移動遺傳元件(MGE)相關的cfr、cfr(B)、optrA、poxtA等獲得性耐藥基因也起重要作用[4],這些基因可隨著質粒、轉座子等在不同腸球菌和其他革蘭陽性球菌中快速傳播。耐藥基因的存在及傳播不僅加速了細菌耐藥性的獲得,而且增加了腸球菌相關感染性疾病的治療難度。通過細菌分型可探究各菌株間的克隆關系,確定病原菌和感染源之間的關系,可為控制此類耐藥菌的流行和交叉感染提供參考依據。
1 材料與方法
1.1 材料
1.1.1 菌株來源 采用常規細菌培養方法對福建醫科大學附屬泉州第一醫院2018—2019年的臨床微生物標本進行細菌培養,腸球菌屬鑒定采用Phoenix100全自動細菌鑒定及藥敏儀(美國BD公司)及MALDI-TOF細菌質譜鑒定儀(布魯克公司)進行鑒定。
1.1.2 抗菌藥物和培養基 抗菌藥物紙片為英國OXOID公司產品,藥敏試驗所用的MH瓊脂培養基為廣州市迪景生物有限公司產品。商品化藥敏板-革蘭陽性菌藥敏板PMIC/ID-55為美國BD公司的Phoenix100檢測系統配套產品。CAMHB肉湯粉劑為青島海博生物公司產品。利奈唑胺高純度標準品(CAS:165800-03-3)為四川省維克奇生物科技有限公司產品。96孔藥敏培養空板為艾斯特實驗器材公司產品。
1.2 方法
1.2.1 藥敏試驗 采用革蘭陽性菌藥敏板PMIC/ID-55(美國BD公司)檢測腸球菌的常規藥敏試驗及利奈唑胺的最低抑菌濃度(MIC);采用藥敏紙片法(K-B法)和肉湯微量稀釋法(MIC法)對經儀器法檢測出的利奈唑胺不敏感腸球菌(LISE)菌株進行確認。藥敏試驗質控菌株為糞腸球菌ATCC 29212,參照2019年美國臨床和實驗室標準化協會(CLSI)推薦的抗菌藥物折點判讀結果。
1.2.2 微量藥敏板的制備 預制96孔肉湯微量稀釋法的藥敏培養板,根據純度計算并稱量藥物配置濃度為1 280 mg/L的儲存液,使用滅菌蒸餾水進行倍比稀釋,將倍比稀釋后不同濃度的抗菌藥物溶液分別加到滅菌的96孔聚苯乙烯板中,于A~G的1~11列從上至下第1至第8孔加藥液,每孔50 μL,MIC范圍為0.5~64 mg/L,第12列不加藥作為生長對照,加蓋-80℃以下保存備用。
1.2.3 統計分析 采用WHONET 5.6 軟件進行數據統計分析。
1.2.4 同源性分析 采用多位點序列分型(MLST)分析LISE菌株的同源性。
1.2.5 耐藥基因檢測 采用PCR法檢測23S rRNA、rplC、rplD、rplV、optrA、poxtA、cfr、cfr(B)利奈唑胺耐藥相關基因,并使用基因測序方法驗證擴增的PCR產物,耐藥基因PCR引物序列及擴增產物大小見表1。

表1 耐藥基因PCR引物序列及擴增產物Table 1 Primer sequences for PCR detection of relevant drug resistance genes and amplicon size
2 結果
2.1 腸球菌屬的菌種分布及藥敏結果
2018—2019年共檢出腸球菌屬細菌522株,其中糞腸球菌332株,占63.6%;屎腸球菌121株,占23.2%;其他腸球菌69株,占13.2%,見表2。除利奈唑胺、四環素外,屎腸球菌對其他測試藥物的耐藥率明顯高于糞腸球菌,見表3。經MIC法復核確認檢出LISE 44株,均為糞腸球菌,其中中介糞腸球菌(LIEf)16株,占4.8%(16/332),MIC值為4 mg/L;耐藥糞腸球菌(LREf)28株,占8.4%(28/332),有25株MIC值為8 mg/L,3株MIC值為16 mg/L。
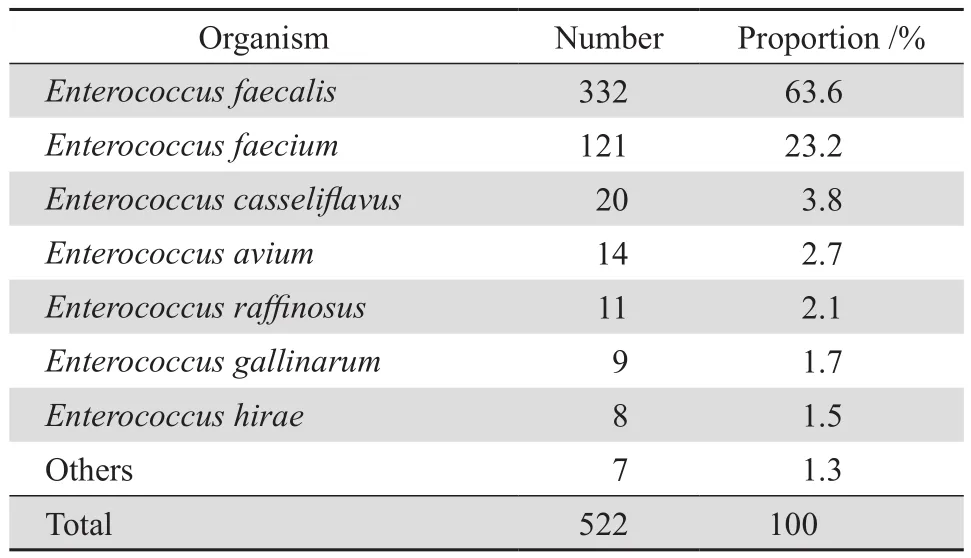
表2 522株腸球菌屬的菌種分布Table 2 Species distribution of 522 Enterococcus strains
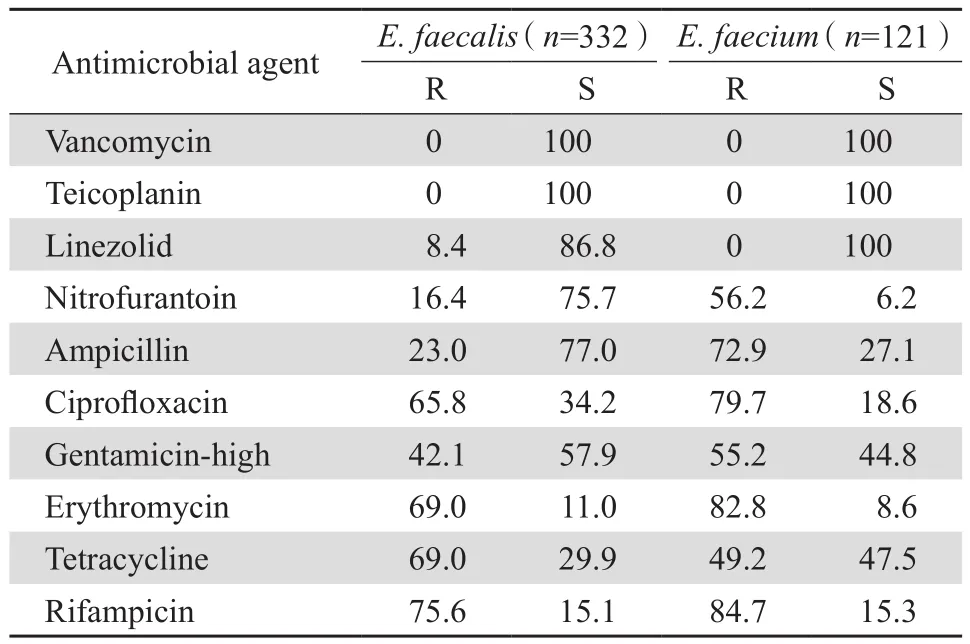
表3 腸球菌屬細菌對抗菌藥物的耐藥率和敏感率Table 3 Susceptibility of Enterococcus species to antimicrobial agents (%)
2.2 LISE菌株的科室和標本類型分布
LISE菌株科室分布中泌尿外科占43.2%(19/44),腫瘤科占9.1%(4/44),老年病科和肝膽外科均為6.8%(3/44),其他分別為神經外科、胃腸外科、內分泌科、甲狀腺外科、燒傷科等;標本類型中尿液占52.3%(23/44)、抽出液占18.2%(8/44)、分泌物占13.6%(6/44)、引流液占4.5%(2/44)、其他占11.4%(5/44)。
2.3 LISE菌株的耐藥基因檢測結果
選取與利奈唑胺耐藥相關的基因23S rRNA、rplC、rplD、rplV、optrA、poxtA、cfr、cfr(B)進行檢測,44株LISE菌株optrA基因陽性的23株,cfr基因陽性的1株,poxtA基因陽性的1株,23S rRNA發生基因突變(G2601C)的1株,編碼L3核糖體蛋白的rplC基因發生突變 (C291T、C369T、T107A)的有4株,編碼L4核糖體蛋白的rplD基因發生突變 (C348T、A144G)的有19株,編碼L22核糖體蛋白的rplV基因未發生突變,見表4。

表4 LREf和LIEf菌株耐藥基因及耐藥表型Table 4 Drug resistance genes and resistance phenotypes of linezolid-resistant and linezolid-intermediate Enterococcus faecalis strains
2.4 MLST分析
將44株LISE的7個管家基因(pstS、gdh、gyd、xpt、yiqL、aroE、gki)上傳至 MLST 官網進行比對,共有32個ST型,其中9株為ST16型,ST480、ST689、ST995、ST985型各2株,其他分別為ST179、ST302、ST975、ST991等,共有13個新的ST型(ST975、ST976、ST978~ST981、ST984、ST985、ST987、ST990、ST991、ST995、ST1003),見表 5。

表5 44株LISE菌株的MLST分布Table 5 Multilocus sequence typing of 44 linezolid-insensitive Enterococcus strains
3 討論
2018-2019年我院糞腸球菌藥敏結果顯示其對利奈唑胺的耐藥率為8.4%,高于CHINET監測網顯示2018-2019年糞腸球菌對利奈唑胺的耐藥率(2.2%)。從臨床上共分離44株LISE,其中28株為 LREf,16株為 LIEf。28株 LREf的 MIC值為8~16 mg/L,目前對于腸球菌利奈唑胺耐藥水平的定義尚無共識,有文獻建議將MIC范圍為8~16 mg/L定義為低水平的耐藥,將MIC>64 mg/L定義為高水平的耐藥[5]。低水平的耐藥可能成為發展更高水平耐藥性的“墊腳石”,這可能導致醫院“超級細菌”的產生[6]。44株LISE分離的科室主要為泌尿外科、腫瘤科、老年病科和肝膽外科,標本來源主要為尿液、抽出液、分泌物、引流液。
23S rRNA的V區點突變是目前LRE菌株最普遍的耐藥機制且具有多樣性,主要的突變類型為G2576T,其次為G2447T、G2505A[7]。本研究結果顯示LRE-EF03的23S rRNA發生了G2601C點突變,引起了Q867H氨基酸的改變,該菌株同時攜帶optrA基因,與美國LEADER項目報道的腸球菌攜帶optrA基因同時發生23S rRNA G2576T的突變位置不同[8]。
我院糞腸球菌檢測出1株cfr陽性的LRE,命名為EF02,該菌株同時攜帶optrA,利奈唑胺對其的MIC值為8 mg/L,基因型為ST330。cfr編碼一種rRNA甲基轉移酶,可引起唑烷酮類、氯霉素類、林可霉素類、截短側耳素類和鏈霉菌素A耐藥和大環內酯類敏感性下降[9]。自2012年首次報道了由質粒攜帶cfr基因介導人源糞腸球菌(ST16)對利奈唑胺耐藥以來[10],逐漸出現了一些類似的報道[11-14]。2015年Wang 等[11]第一次報道了optrA耐藥基因來自于國內人和動物分離的腸球菌,為cfr之后報道的第2個可轉移性利奈唑胺耐藥基因,該基因很容易在腸球菌之間轉移[11,15-16]。本研究44株LISE菌株optrA基因陽性的有23株,占52.3%,其中21株為LREf,2株為LIEf。2018年報道了在意大利臨床分離的高度耐利奈唑胺MRSA中檢測到1種新的耐藥基因poxtA,其在金黃色葡萄球菌、腸球菌中的表達可導致對酚類、唑烷酮類和四環素類藥物敏感性降低[17]。2019年國內研究者發現了1株豬源糞腸球菌攜帶了1個具有optrA和poxtA基因的質粒[18],我院LRE菌株中亦發現了EF94同時攜帶optrA和poxtA。根據目前文獻報道,EF02和EF94均為國內首次發現同時攜帶兩種耐藥基因的人源糞腸球菌。
核糖體蛋白L3、L4或L22突變可能是造成利奈唑胺非轉移性耐藥的另一種機制。有研究顯示由rplC和rplD編碼的核糖體蛋白L3和L4保守結構域的改變與利奈唑胺非敏感腸球菌(MIC 4~8 mg/L)有一定的相關性[19]。本研究的44株LISE中有23株發生點突變(rplC4株,rplD19株),其中只有LIEf-EF04的rplC發生了L36del (T107A)突變,其他22株雖發生點突變但并未引起氨基酸的改變,其中13株合并optrA且有11株為LRE。
MLST分析顯示44株LISE可分為32個不同的ST型,ST16最為多見(9/44)且有7株攜帶optrA,利奈唑胺對其的MIC值為8~16 mg/L,與國內劉暢[20]和樓亞玲[21]報道的LRE菌株中ST16(均攜帶optrA)為最常見型別一致。而與葡萄牙[22]檢出的optrA陽性糞腸球菌的基因型為ST476(5/28) 和 ST585(3/28) 不 一 致。44株LISE出現了新的ST型,說明菌株也在不斷進化以應對艱難的生存環境。ST16-179-302-985復合群(EF13、EF29、EF34、EF42、EF43、EF51、EF60、EF78) 與 ST480-689復 合 群(EF04、EF16、EF58、EF86)分布在泌尿外科,提示泌尿外科存在ST16型與ST480為主的多克隆傳播現象。其他ST型菌株分布于各個科室,呈散在流行,不存在院內克隆傳播。
LRE菌株optrA的高攜帶率表明其為我院LRE的主要耐藥機制,且可作為利奈唑胺耐藥性篩查的有效分子標志。另外,需要進一步常規和持續篩選患者攜帶optrA基因菌株的危險因素,這些因素可能與利奈唑胺耐藥性的快速傳播有關。44株LISE中有9株未發現其他耐藥機制。細菌生物膜的形成在細菌適應性耐藥方面被認為能夠導致細菌耐藥性增強,因此不能排除生物膜形成有助于降低對利奈唑胺敏感性的可能性。有研究通過透射電子顯微鏡進行觀察比較利奈唑胺敏感腸球菌與LISE的生物膜,與敏感株相比,LISE的菌體細胞壁往往更厚[23]。生物膜是否參與了LISE對利奈唑胺的耐藥形成有待進一步探究。

