十四烷基硫酸鈉注射液包材中元素雜質鎢和硫的風險評估
薛曉 陳辰 黃臻輝 曾垂宇
(1. 上海上藥第一生化藥業有限公司 上海 200240;2. 上海上藥創新醫藥技術有限公司 上海 200020)
藥物中存在的元素雜質可能會潛在地危害患者的健康,或者使藥物加速降解,從而對患者產生危害或者失去治療作用。因此,對允許可接受的元素雜質濃度范圍進行分析評估尤為重要。國際人用藥物注冊技術協調會議(International Conference of Harmonization,ICH)制定的關于制劑中元素雜質的 Q3D指南[1],對元素雜質的分類、風險評估和控制、制劑日允許暴露量與濃度限度之間的轉換等做了詳細闡述,為藥企在生產藥品中元素雜質的風險評估與控制提供了依據。目前,有少量文獻對ICH Q3D指南中元素雜質評估及控制的相關政策進行了相關解讀[2-3],但對于在實際研發、生產和質量研究中具體的評價方法,及某些情況下高于分析限度且缺乏直接的每日允許暴露(permitted daily exposure,PDE)[1]劑量的推導值時,如何對PDE的元素雜質水平進行推導和評估,還缺乏相關文獻評價討論。
本論文基于十四烷基硫酸鈉注射液的包材相容性研究的遷移試驗的結果,其中金屬元素鎢和單質硫超出了分析評價閾值(analytical evaluation threshold,AET)(0.3 μg/瓶)[4],結合ICH Q3D指南的內容對兩種元素進行相應的安全評估,以評估其對治療患者的潛在的健康風險。為藥物研發和生產中如何進行元素雜質的評估提供一些借鑒。
1 材料和方法
1.1 儀器
Perkin Elmer電感耦合等離子體發射質譜儀(美國PE公司,ICP-MS Nexion 300X);HPLC 1260高效液相色譜儀(安捷倫公司)。
1.2 試劑
十四烷基硫酸鈉注射液(規格2 mL:60 mg,批號1612701、1612702、1612703,上海上藥第一生化藥業有限公司);乙腈(色譜純,批號18035171,Tedia公司);鎢元素標準溶液(規格1 000 μg/mL,批號214045034,AccuStandard公司);超純水均為Merck Millipore制備;單質硫(批號S2BE09.0XV, Fluka公司)。
1.3 方法
1.3.1 鎢元素的測定
平行制備供試品和空白樣品,采用質譜進行檢測,射頻功率1.1 kW;等離子氣流量15 L/min;輔助氣流量1.2 L/min;霧化氣流量0.87 L/min。
1.3.2 硫元素的測定
平行制備供試品和空白樣品,采用高效液相色譜進行檢測,Agilent Eclipse XDB-C18色譜柱(4.6 mm×250 mm,5 μm);流速1.0 mL/min;柱溫30 ℃;進樣量20 μL;DAD檢測器;流動相100%乙腈;檢測波長225 nm。
1.4 包材相容性研究
根據包材相容性研究的相關指導原則,對十四烷基硫酸鈉注射液與其內包裝材料進行相容性考察。研究內容包括提取試驗、方法學驗證、遷移試驗及玻璃內表面侵蝕性(圖1)。
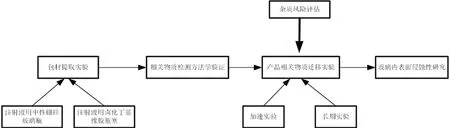
圖1 包材相容性研究內容
遷移試驗中將樣品置于穩定性試驗條件下,對0天、加速3個月、加速6個月、長期6個月樣品進行遷移物檢測。
2 結果
2.1 遷移試驗
遷移試驗中鎢與硫超出產品閾值(AET 0.3 μg/瓶)(表1)。AET是基于安全性關注閾值(safety concern threshold,SCT)、產品規格、產品最大日攝入量計算得出。歐洲藥品局、美國產品質量研究所、腸外及眼用藥物工作組推薦SCT為1.5 μg/d。本產品的SCT采用1.5 μg/d。每日最大攝入10 mL(5瓶),則本產品AET計算為 :1.5 μg/d÷5 瓶 /d=0.30 μg/瓶。
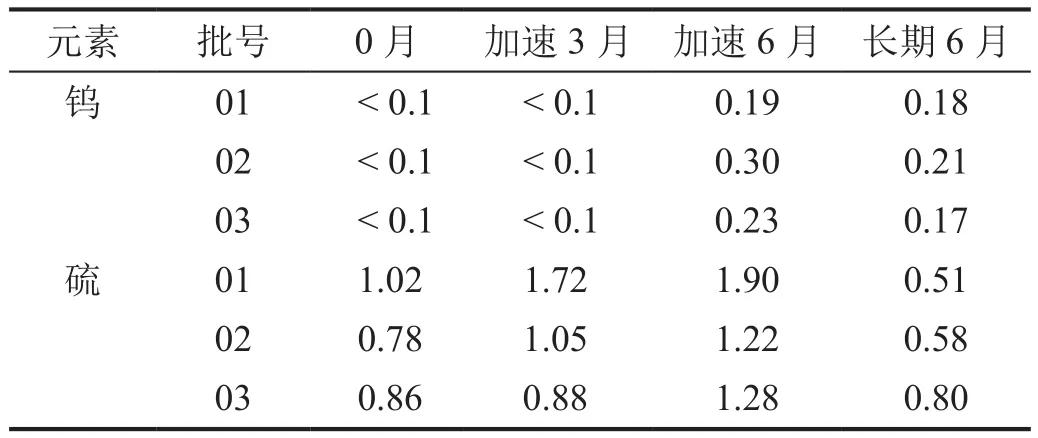
表1 在各種儲存條件下可浸出的元素量(μg·瓶-1)
2.2 鎢的PDE推導
PDE推導中的各校正因子的具體選擇參照ICH Q3D指南相關規定。鎢在歐盟CLP(物質和混合物分類、標簽和包裝)法規[5]中未被分類為任何危險特性。從鎢的毒理學論著[6]與歐盟REACH(Registration, Evaluation,Authorization and Restriction of Chemicals)注冊檔案[7]中公布的實驗數據顯示,鎢無明顯皮膚與眼睛刺激性,皮膚致敏性反應為陰性,無明顯繁殖致畸性。
2.2.1 毒性安全限度
1)數據來源1 美國國家職業安全與健康研究所(NIOSH)設定了鎢的推薦暴露極限(recommended exposure limit,REL)為 5 mg/m3(10 h工作班次)。美國政府工業衛生學家會議(ACGIH)定義了一個鎢的暴露限度閾值(threshold limit value,TLV):工作8 h為5 mg/m3。從這些引用的亞急性吸入研究中,可以推導出一般人群每天0.48 mg/kg的衍生無效水平(derived no effect level,DNEL)。
2)數據來源2 在健康人群中,鎢血清濃度為6 μg/L。據估計,成人每日膳食攝入鎢估計約為0.01 mg(0.05 μmol)。人類會從各種飲食攝取鎢,如葡萄酒[平均含量 (1.7±1.4) μg/L],礦泉水 [平均含量 (7.4±6.5)μg/L],啤酒 [平均含量 (0.31±0.51) μg/L]和茶 [平均含量 (1.8±0.3) μg/L][6]。
2.2.2 口服途徑PDE的推導
1)數據來源1 吸入途徑可用于推導皮膚、吸入、注射途徑PDE值,無推導口服途徑PDE值的參考。
2)數據來源2 根據美國《藥典論壇》關于鎢的PDE討論[8],鎢的口服PDE值=375 μg/d。
假設體質量為50 kg,則鎢的口服PDE值=375/50 μg/(kg·d)=7.5 μg/(kg·d)。
2.2.3 注射途徑PDE的推導
1)數據來源1 國家職業安全與健康研究所(NIOSH)設定了鎢的推薦暴露極限為5 mg/m3。這個限度可以推廣到普通人群,計算普通人群的相應限度:

注:公式中“40 h”為ICH Q3D中定義,以常規每周工作40 h計算的時間加權平均濃度[國際理論和應用化學聯合會(International Union of Pure and Applied Chemistry,IUPAC)]。
鎢的工作場所最大吸入閾值濃度為1.19 mg/m3,假設每天吸入28.8 m3空氣(輕度運動時),成年人體質量為 50 kg,則 NOAEL 為 :1.19×28.8/50=0.685 mg/(kg·d)。
鎢的吸入PDE值=0.685/[1×10×1×1×1]mg/(kg·d)=68.5 μg/(kg·d),取校正因子為 1,鎢的注射 PDE 值=68.5 μg/(kg·d)。
2)數據來源2 鎢口服生物利用度為57%~74%(比格犬)[6],校正因子取2,鎢的注射PDE值(數據來源2)=7.5/2 μg/(kg·d)=3.75 μg/(kg·d)。
綜合兩種數據來源推算的PDE結果,取更嚴格的限度值作為鎢的PDE值,即口服為7.5 μg/(kg·d),注射途徑為 3.75 μg/(kg·d)。
2.3 硫的PDE推導
2.3.1 毒性安全限度
大鼠口服硫的LD50>2 000 mg/kg,大鼠亞慢性毒性試驗中口服硫的未觀察到不良作用水平(no observed adverse effect level,NOAEL)為 1 000 mg/(kg·d)[9]。
2.3.2 口服途徑的PDE推導
根據毒理學評估報告提供的數據和信息,用于計算PDE的各個校正因子見表2。

表2 校正因子數據
2.3.3 注射途徑的PDE推導
未見硫的口服生物利用度數據,依據ICH Q3D指南的相關規定,因此校正因子取100。
注射途徑硫的 PDE 值 =4/100=40 μg/(kg·d)。
總之,已確定硫為十四烷基硫酸鈉注射液包材中的可浸出物質,PDE 40 μg/(kg·d)可用于風險評估。
2.4 風險評估總結及質量控制策略
元素風險評估過程包括3個步驟:確定元素雜質的已知和潛在來源;測定特定元素雜質水平,與PDE比較,評價該元素在藥品中可能存在的水平;總結和記錄風險評估[1]。
根據浸出試驗研究中超出產品閾值的鎢、硫元素的最大測量值來計算人體每天可能的最大系統暴露劑量(systemic exposure dose,SED)(表3),并比較他們的SED值與對應的PDE值(表4)。結果表明,鎢和硫的風險比遠小于0.3(ICH規定“將藥品既定PDE值的30%定義為控制閾值”[1]);硫的風險主要是皮膚刺激,未見其他毒性。

表3 十四烷基硫酸鈉注射液包材浸出試驗中各元素SED值
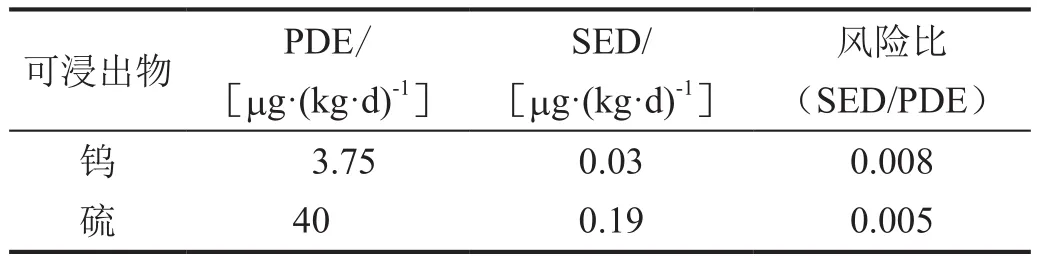
表4 十四烷基硫酸鈉注射液中兩元素風險比
經毒理學評估,鎢及硫的浸出量遠小于控制閾值。由于硫來源明確為膠塞,且膠塞成分比例固定,工藝驗證三批樣品浸出試驗研究的硫水平應與正式生產樣品相當,因此可不列入日常檢驗。
3 討論
本產品中原料藥十四烷基硫酸鈉生產過程中無有意添加鎢元素,而輔料苯甲醇、磷酸氫二鈉使用量較少,且使用的輔料均符合中國藥典2020版標準,引入鎢元素雜質的風險低;本品溶劑為注射用水,其制備工藝中無有意添加的潛在元素雜質,且該注射用水符合中國藥典2020版注射用水標準,公司也對其質量進行嚴格控制,故鎢元素超標的風險很低。本品pH為7.5~7.9,為中性藥液。而生產系統中使用的不銹鋼為316 L材質,在該中性pH條件下,不銹鋼中各元素雜質引入藥品的風險低。據內包材供應商提供的資質證明,均未有意添加鎢元素。經與供應商溝通,膠塞生產工藝中需使用鎢鋼刀將硫化好的成片橡膠密封件切割成單只產品,推測鎢元素的來源為膠塞。因此,應加強對供應商審計,并對每年穩定性留樣產品進行鎢元素的追蹤檢測。
本研究參考ICH Q3D,結合公開有效來源的毒理學數據,對超出分析評價閾值的鎢和硫元素的PDE進行推導,并作出相應的安全評估。最終確定包材相容性試驗中鎢及硫的浸出量遠小于控制閾值,在正式生產中風險極低,不列入日常檢驗。此外,元素的風險評估只是評價手段,應從來源去降低元素的引入風險,國內藥品相關原輔料及包材廠商應積極關注原料及生產中各元素的分析及管控,藥品生產企業在研發和生產過程中加強對人、機、料、法、環的控制,以滿足藥品的質量和安全性需求。

