治療非小細胞肺癌新藥:kras基因突變靶向藥物sotorasib
黃鈺雯 王春暉 李曉宇 呂遷洲
(復旦大學附屬中山醫院藥劑科 上海 200032)
肺癌是世界上最常見的惡性腫瘤,在我國惡性腫瘤發病率和死亡率均位居第一[1-2]。其中非小細胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌的80%以上[3],包括鱗癌、腺癌和大細胞癌。與小細胞癌相比,NSCLC細胞生長分裂較慢,擴散轉移相對較晚。Kirsten大鼠肉瘤病毒致癌基因同源(Kirsten rat sarcoma viral oncogene homolog,kras)突變是NSCLC中最常見的基因突變之一(腺癌中占20%~30%)[4]。kras基因編碼鳥苷三磷酸酶(guanosine triphosphatase,GTPase),該酶通過耦合細胞膜生長因子受體與細胞內信號通路和轉錄因子起到調節信號轉導的分子開關作用[5-6]。kras突變破壞GTPase內在活性,阻止GTPase激活蛋白將活性的鳥苷三磷酸(guanosine triphosphate,GTP)轉化為非活性的鳥苷二磷酸(guanosine diphosphate,GDP)[5-6]。kras突變通常與靶向治療耐藥性和腫瘤患者的不良預后有關[7]。kras突變存在種族差異,白種人的發生率(25%~50%)高于亞洲人(5%~15%)[4]。kras突變最早在肺癌中被發現,最常見的突變類型是G12C(41%)和G12V((19%),也意味著無進展生存期更短[8]。其中krasG12C突變在13%的NSCLC、3%的結腸直腸癌和2%的其他實體腫瘤患者中可見[9]。對于kras突變NSCLC患者的治療方案鮮有突破,化療仍然是主要治療手段[10],如果一線治療失敗,后續治療選擇十分有限。
2021年5月28日,美國食品藥品監督管理局宣布批準安進公司研發的Lumakras(sotorasib)上市,用于至少經過一次系統治療且病情進展的kras基因G12C陽性非小細胞肺癌患者。sotorasib是全球首款針對kras基因突變的靶向藥物,通過取代甘氨酸與krasG12C獨特的半胱氨酸形成不可逆共價鍵,將蛋白質鎖定在非活性GDP結合狀態,阻斷下游信號傳導,而不影響野生型kras[11]。本文將對sotorasib的基本信息、作用機制、藥代動力學、藥物相互作用、特殊人群用藥、臨床試驗、用藥注意事項、安全性等方面進行概述,以期為臨床合理用藥提供參考。
1 藥物基本信息
sotorasib是RAS GTPase家族抑制劑,化學名:6-氟-7-(2-氟-6-羥基苯基)-(1M)-1-[4-甲基-2-(丙基-2-基)吡啶-3-基]-4-[(2S)-2-甲基-4-(丙基-2-烯基)哌嗪-1-基]吡啶[2,3-d]嘧啶-2(1H)-酮,分子式:C30H30F2N6O3,相對分子質量為560.0。化學結構式見圖1。
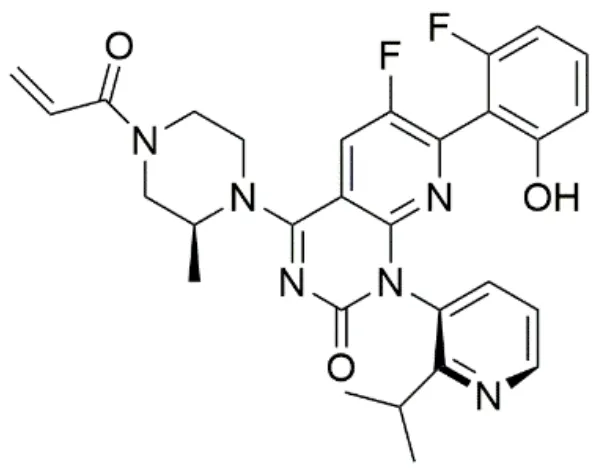
圖1 sotorasib的結構式
sotorasib的pKa為8.06和4.56,溶解度隨pH升高而減小。sotorasib為口服薄膜包衣片,每片含有120 mg活性成分。輔料包括微晶纖維素、乳糖單水合物、交聯羧甲基纖維素鈉、硬脂酸鎂、聚乙烯醇、二氧化鈦、聚乙二醇、滑石粉、氧化鐵黃[11]。
2 作用機制
sotorasib通過與P2 pocket的獨特相互作用,特異性地、不可逆轉地抑制krasG12C,其是RAS GTPase的一種腫瘤限制性突變致癌形式,是參與腫瘤細胞生長和存活的細胞內信號通路的重要中介物。sotorasib與krasG12C的獨特半胱氨酸形成不可逆的共價鍵,將蛋白質鎖定在非活性GDP結合狀態,阻斷下游信號傳導。sotorasib僅在krasG12C腫瘤細胞系中阻斷kras信號傳導、抑制細胞生長并促進細胞凋亡。sotorasib對krasG12C在體內和體外均有抑制作用,具有最小的可監測脫靶活性。在小鼠腫瘤異種移植模型中,sotorasib可使腫瘤消退,并延長生存期,這種作用與抗腫瘤免疫性相關。
3 藥代動力學
sotorasib在每日一次180 mg至960 mg劑量范圍內表現出非線性的、時間依賴的藥代動力學特點。穩狀下各劑量之間有相似的全身暴露(即AUC0-24h和Cmax)。薄膜衣片和在水中預分散的薄膜衣片的全身暴露量類似。血藥濃度達峰中位時間(Tmax)為1 h,血藥濃度在22 d內達到穩態,穩態表觀分布容積(Vd)為211 L(CV:135%)[12]。sotorasib血漿蛋白結合率為89%。平均終末消除半衰期為5 h。每日一次960 mg給藥時,穩態表觀清除率為26.2 L/h(CV:76%)。sotorasib的主要代謝途徑為與CYP3As的非酶結合和氧化代謝,其74%經糞便排泄(其中原型占53%),6%經尿液排泄(其中原型占1%)[11-12]。年齡、性別、種族、體重等差異、輕中度腎功能或肝功能損害對其藥代動力學均無臨床統計學意義。
4 藥物相互作用
禁食狀態下單劑量sotorasib與多劑量奧美拉唑合用時,Cmax降低57%,AUC降低42%;進食狀態下合用則Cmax降低65%,AUC降低57%[13]。在進食狀態下服用單劑量sotorasib前10 h和后2 h給予單劑量法莫替丁,Cmax降低35%,AUC降低38%[11]。所以sotorasib應避免與質子泵抑制劑、H2受體拮抗劑等抑酸藥合用,如果確需合用,建議在抑酸藥使用前4 h或使用后10 h服用。
sotorasib應避免與強效CYP3A4誘導劑合用,與多劑量利福平合用可使sotorasib的Cmax降低35%,AUC降低51%[14]。也應避免與CYP3A4底物合用,以免導致后者治療失敗,如sotorasib可使咪達唑侖Cmax降低48%,AUC降低53%[11]。必須合用時應增加CYP3A4底物劑量。sotorasib與P-gp底物(地高辛)合用可使地高辛Cmax升高91%,AUC升高21%,增加其不良反應甚至導致嚴重毒性,應避免合用[11]。
5 臨床研究
一項評估sotorasib治療攜帶krasG12C突變晚期實體瘤患者的多中心、開放性1期臨床試驗[7]共納入129例患者,其中59例為NSCLC患者。NSCLC亞組患者被分為4組,每天給予不同劑量sotorasib:180 mg(3例)、360 mg(16例)、720 mg(6例)和960 mg(34例),每個治療周期為21 d。連續給藥直至疾病進展、出現不可耐受不良反應、患者撤回知情同意書或研究結束。NSCLC亞組中位隨訪時間為11.7個月。所有劑量組均有應答,總應答率(overall response rate,ORR)為88.1%,其中19例(32.2%)為部分緩解(PR),33例(55.9%)為病情穩定(SD)。960 mg劑量組34例患者中,ORR為91.2%,其中12例(35.3%)為PR,19例(55.9%)為SD,1例PR患者接近完全緩解(CR)。中位起效時間為1.4個月,中位無進展生存期為6.3個月,中位緩解持續時間為10.9個月,19例PR患者中,緩解持續時間≥3個月為11例(57.9%),≥6個月為6例(31.6%),≥9個月為5例(26.3%)。最常見的不良反應為腹瀉(29.5%)、乏力(23.3%)和惡心(20.9%),3級或以上不良反應包括轉氨酶水平升高、腹瀉、貧血、肝炎、低鈉血癥和淋巴細胞計數減少。2例患者發生嚴重不良事件,1例發生4級丙氨酸氨基轉移酶(ALT)升高,1例因發生3級ALT和門冬氨酸氨基轉氨酶(AST)水平升高而停止治療。
一項單臂、多中心、開放性2期臨床試驗(NCT03600883)評估了sotorasib單藥二線治療(已接受過免疫檢查點抑制劑和/或鉑類化療)局部晚期或轉移性krasG12C突變NSCLC患者的有效性和安全性[15]。試驗共納入126名患者,其中2例因基線無影像學可測量病灶未納入有效性分析。所有患者腫瘤組織中均存在krasG12C突變,檢測112例患者的血樣,70%患者(78/112)發現krasG12C突變,28%患者(31/112)未發現krasG12C突變,3例檢測失敗無法評估。124例患者ORR為80.6%,其中4例(3.2%)為CR,42例(33.9%)為PR,54例(43.5%)為SD。中位無進展生存期為6.8個月,中位緩解持續時間為11.1個月,中位總生存期為12.5個月。46例獲得客觀緩解的患者中,緩解持續時間≥3個月占90.5%,≥6個月占70.8%,≥9個月占57.3%。126例患者中88例(69.8%)發生治療相關不良事件,最常見的為腹瀉(31.7%)、惡心(19.0%)、轉氨酶升高(15.1%)和乏力(11.1%)。其中25例患者發生3級事件(19.8%),1例患者發生4級事件(0.8%),3級或以上不良反應主要包括ALT、AST和γ-谷氨酰轉移酶水平升高和腹瀉。28例(22.2%)患者因治療相關不良事件調整劑量,9例(7.1%)患者終止治療。
基于2期臨床試驗中sotorasib對krasG12C突變NSCLC患者帶來快速而持久的臨床獲益,一項比較sotorasib與多西他賽治療經多線治療、局部晚期、不可切除或轉移性krasG12C突變NSCLC患者(NCT04303780)的3期臨床試驗正在開展[16]。此外,sotorasib在聯合治療方案中的作用(NCT04185883)以及哪些患者可以從sotorasib一線治療中獲益的研究也將展開[16]。
6 用藥注意事項及警示
sotorasib最常見的不良反應包括腹瀉、惡心、乏力、肌肉骨骼疼痛、肝毒性和咳嗽。sotorasib最嚴重的不良反應包括肝毒性(藥物性肝損傷和肝炎)和間質性肺炎。盡管3級或以上肝毒性發生率(1.4%)不高,但3級或以上轉氨酶水平升高發生率為6.6%,7.0%患者因ALT/AST水平升高導致劑量調整或中斷治療,2.0%患者因ALT/AST水平升高而終止治療,還有5.0%的患者因肝毒性接受糖皮質激素。因此建議定期監測肝功能(ALT、AST和總膽紅素),治療前3個月每3周進行一次,然后每月一次,對于出現轉氨酶和/或膽紅素水平升高的患者需檢測更頻繁,并根據不良反應嚴重程度,減少劑量、中斷或永久停用sotorasib。間質性肺炎發生率為0.8%,但所有病例發生時均為3級或4級,1例患者死亡。首發中位時間為2周,0.6%患者因間質性肺炎停用sotorasib。應監測患者是否出現新發或惡化的肺部癥狀(如呼吸困難、咳嗽、發燒等),對疑似患者,應立即停用sotorasib,如果在鑒別診斷過程中未能發現其他潛在病因,則應永久停用sotorasib。
7 結語
kras突變的患者自1984年被發現以來均被認為無藥可用,sotorasib獲批上市改變了多年來沒有針對此靶點有效藥物的現狀,在krasG12C突變NSCLC患者已表現出不錯的療效和良好的耐受性。但其在krasG12C突變結直腸癌患者中應答率較低,預先聯合表皮生長因子受體(EGFR)靶向治療可提高這類患者的krasG12C抑制效果[17-18]。Sotorasib在其他krasG12C突變實體瘤中的療效仍有待更大規模的臨床研究進行評估和觀察。

