迷迭香酸對胃癌細胞SGC-7901增殖和凋亡的影響及機制
楊曉南 丁玉忠 楊桃 李雪松 褚斌
(武威市中醫醫院 1中醫內科,甘肅 武威 733000;2普外科;3甘肅省腫瘤醫院消化腫瘤內一科;4武威市中醫醫院胃鏡室)
胃癌是消化系統常見的惡性腫瘤,但因臨床表現隱匿,缺乏辨識度,大部分患者確診時已進入中晚期〔1~4〕。盡管手術、放療、化療等治療手段可抑制胃癌的病程,但仍有較大的毒副反應〔5〕,且預后效果不佳,患者5年生存率較低〔6〕。
迷迭香酸(RA)主要來源于迷迭香、薄荷、鼠尾草、百里香等植物中〔7〕。具有廣泛的藥理活性,抗氧化〔8~10〕、抗微生物〔11〕、抗炎〔12,13〕、抗病毒〔14〕、抗癌〔15〕等作用。鑒于前期學者研究顯示,RA對多種癌細胞的抑制作用顯著。本課題探討RA對胃癌細胞SGC-7901生長、增殖、凋亡的影響及機制。
1 儀器與材料
1.1細胞 人胃癌細胞SGC-7901購自中國科學院上海細胞研究所。
1.2主要試劑 RA(美國Sigma公司);胎牛血清、RPMI1640培養基、青霉素-鏈霉素雙抗(美國Gibco公司);胰蛋白酶、磷酸鹽緩沖液(PBS)(北京譜析科技有限公司);抗膽囊收縮素細胞計數試劑盒(CCK8)試劑盒、二喹啉甲酸(BCA)蛋白定量檢測試劑盒、低密度脂蛋白(LDL)試劑盒、丙二醛(MDA)試劑盒(南京建成生物工程研究所),活性氧(ROS)檢測試劑盒(碧云天生物工程有限公司),放射免疫沉淀試驗(RIPA)裂解液、磷酸化蛋白酶抑制劑、顯影定影試劑、β-actin(武漢賽維爾生物科技有限公司)。
1.3主要儀器 Navios流式細胞分析儀,美國Beckman Coulter公司;酶標儀,美國Bio-Tek公司;細胞粉碎機,安拓思納米技術(蘇州)有限公司;ECO1.2超凈工作臺及CO2培養箱,美國Thermo Scientific公司;Ne0fuge15R臺式高速冷凍離心機,Heal Force 力康儀器(上海)有限公司;DYCZ-24K型雙板垂直電泳儀,北京六一生物科技有限公司。
1.4方法
1.4.1細胞培養 將胃癌細胞SGC-7901接種于培養基(含有10%胎牛血清、1%青鏈霉素雙抗的RPMI1640),放置于37℃、5%CO2、飽和濕度的無菌培養箱中。后續試驗中,取對數生長期細胞,并用0.25%胰蛋白酶進行消化處理。
1.4.2CCK8法測細胞活性 取對數生長期SGC-7901胃癌細胞,經消化離心后,加入培養液,以1×105細胞密度,接種于96孔板中,置培養箱24 h。加入10 μl不同濃度的RA溶液培養,濃度分別為0.00、0.25、0.50、1.25、2.50、5.00、10.00、20.00、40.00、80.00、160.00 μmol/L,設定3個平行組,48 h后,每孔加入10 μl的CCK8試劑,放置培養箱孵育2 h后用酶標儀(450 nm)測吸光度值(OD)。根據下列公式計算:細胞存活率=實驗孔OD/對照孔OD×100%。
1.4.3BrdU檢測細胞增殖 取對數生長期胃癌細胞SGC-7901,經消化離心后,加入培養液,以1×105細胞密度,接種于96孔板中,置培養箱24 h。加入10 μl不同濃度的RA溶液(0、10、20、40 μmol/L)培養48 h后,分別加入BrdR試劑,按照說明書進行操作處理。
1.4.4流式檢測細胞凋亡 取對數生長期胃癌細胞SGC-7901,經消化離心后,加入培養液,以1×105細胞密度,接種于96孔板中,置培養箱24 h。加入10 μl不同濃度的RA溶液(0、10、20、40 μmol/L),每組設置3個復孔,培養48 h后,經低溫離心、PBS洗滌,于4℃避光水浴染色5 min,1 h內用流式細胞儀檢測。
1.4.5ELISA檢測氧化應激標志物 取對數生長期胃癌細胞SGC-7901,經消化離心后,加入培養液,以1×105細胞密度,接種于96孔板中,置培養箱24 h。加入10 μl不同濃度的RA溶液(0、10、20、40 μmol/L),培養48 h后,分別依據試劑盒說明書步驟,配制測定孔及各種空白對照孔;將培養板置于酶標儀,測定450 nm吸光度,根據所測OD值分別計算LDL活力及MDA含量。
1.4.6熒光探針檢測活性氧(ROS) 取對數生長期胃癌細胞SGC-7901,經消化離心后,加入培養液,以1×105細胞密度,接種于96孔板中,置培養箱24 h。加入10 μl不同濃度的RA溶液(0、10、20、40 μmol/L),培養48 h后,吸凈清液,每孔中加入100 μl的H2DCFDA染液(5 μmol/L),放置于避光條件反應30 min后,激光掃描共聚焦顯微鏡檢測細胞熒光強度,激發波長和吸收波長分別為488和490 nm。熒光強度越強,ROS水平越高。
1.4.7流式檢測線粒體膜電位的變化 取對數生長期胃癌細胞SGC-7901,加入培養液,以1×105細胞密度,接種于6孔板,置培養箱24 h,加入不同濃度的RA處理(0、10、20、40 μmol/L),藥物作用48 h后,收集細胞,經PBS重懸細胞、染色及過濾處理后,采用流式細胞儀檢測。
1.4.8Western印跡檢測相關蛋白表達 取對數生長期胃癌細胞SGC-7901,加入培養液,以1×105細胞密度,接種于6孔板,置培養箱24 h,加入不同濃度的RA處理(0、10、20、40 μmol/L),藥物作用48 h后,用預冷的PBS洗滌,加入裂解液處理30 min,收集細胞,離心15 min(4℃,12 000 r/min),收集上清液。按照BCA試劑盒說明,進行蛋白定量。取樣后進行聚丙烯酰胺凝膠電泳、轉膜、封閉、洗膜、一抗、二抗處理后,加入顯色劑進行檢測。
1.5統計學處理 采用SPSS20.0軟件進行方差分析。
2 結 果
2.1CCK8測定RA對SGC-7901細胞生長的影響 RA 10 μmol/L組細胞生長率〔(79.38±5.88)%〕,與對照組〔(100.00±4.90)%〕相比,RA對細胞生長的抑制作用較小,不具有顯著性差異。隨藥物濃度的增加,自20 μmol/L開始〔20 μmol/L(52.92±8.82)%、40 μg/L(29.40±7.84)%、80 μmol/L(12.74±5.88)%、160 μmol/L(7.84±6.68)%〕,RA細胞生長的抑制作用增加,具有顯著性差異(P<0.05)。由CCK8實驗結果,選擇0、10、20、40 μmol/L RA濃度,進行后續實驗。
2.2BrdU檢測RA對SGC-7901細胞增殖的影響 與對照組(RA 0 μmol/L)Brd U陽性細胞率(92%±6%)相比,除RA 10 μmol/L組(88%±6%)差異無統計學意義外,20、40 μmol/L組BrdU陽性細胞率均顯著降低(42%±7%、17%±8%,P<0.05)。見圖1。
2.3流式檢測細胞凋亡 與對照組細胞凋亡率(4.7%±0.8%)相比,除RA 10 μmol/L組(5.0%±1.0%)差異無統計學意義外,RA 20、40 μmol/L組細胞凋亡率均顯著升高(28.4%±4.1%、36.8%±3.3%,P<0.05),見圖2。
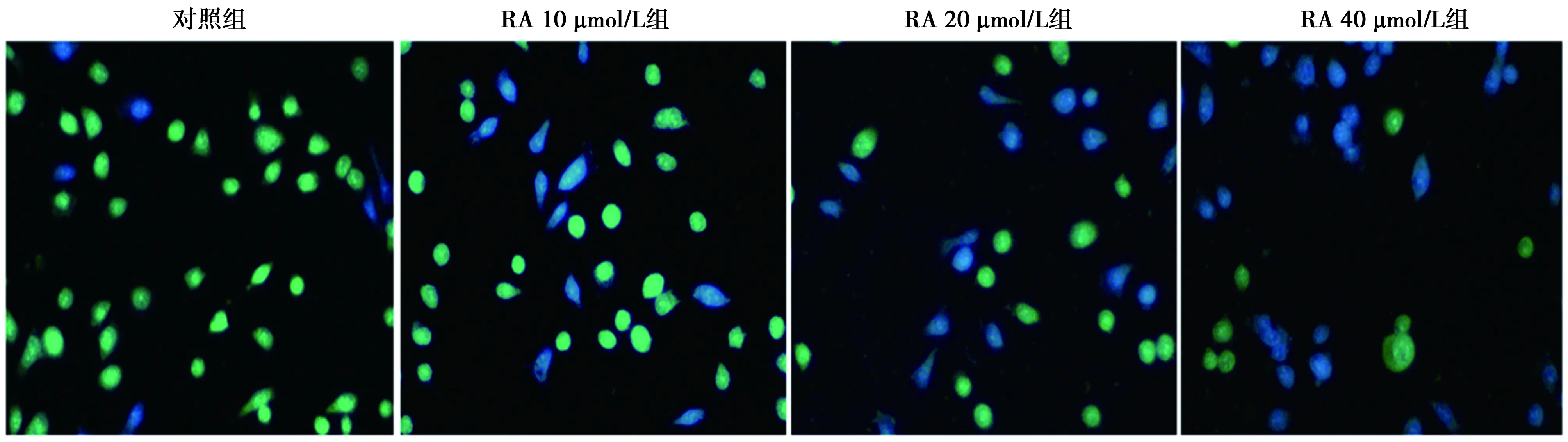
圖1 不同濃度RA對SGC-7901細胞增殖的影響(BrdU染色,×200)

圖2 不同濃度RA對SGC-7901細胞凋亡的影響
2.4ELISA檢測氧化應激標志物 與對照組相比,除RA 10 μmol/L組差異無統計學意義外,RA 20、40 μmol/L組LDL、MDA水平顯著增加(P<0.05),見表1。
2.5熒光探針檢測ROS 與對照組(6±4)相比,除RA 10 μmol/L組(7±3)差異無統計學意義外,RA 20、40 μmol/L組熒光強度逐漸增強,ROS水平顯著升高(29±6、76±9,P<0.05),見圖3。
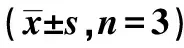
表1 各組SGC-7901細胞中LDL和 MDA含量比較

圖3 不同濃度RA對SGC-7901細胞ROS的影響(免疫熒光染色,×200)
2.6流式檢測線粒體膜電位的變化 與對照組〔(123.88±8.07)%〕相比,RA組(RA 10、20、40 μmol/L)綠色熒光細胞(紅色熒光百分比/綠色熒光百分比)增加〔(20.96±4.77)%、(3.03±1.29)%、(1.28±0.78)%〕,其中20、40 μmol/L組促進線粒體膜去極化的效果顯著(P<0.05)。
2.7Western印跡檢測線粒體損傷標志物相關蛋白表達 與對照組相比,除RA 10 μmol/L組差異無統計學意義外,其余兩組(RA 20、40 μmol/L)線粒體凋亡途徑相關蛋白指標B細胞淋巴瘤-2相關X蛋白/B細胞淋巴瘤-2(Bax/Bcl-2)及活化的含半胱氨酸的天冬氨酸蛋白水解酶(Cleaved caspase)3/caspase3顯著上升(P<0.05),見表2、圖4。
2.8Western印跡檢測核因子E2相關因子2/血紅素氧合酶(Nrf2/HO)-1通路相關蛋白表達比較 與對照組相比,除RA 10 μmol/L組差異無統計學意義外,其余兩組(RA 20、40 μmol/L)Nrf2/HO-1通路相關蛋白p-Nrf2/Nrf2、NAPDH醌氧化還原酶(NQO)1、HO-1表達均顯著上升(P<0.05),見表3、圖5。
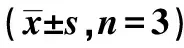
表2 各組SGC-7901細胞中線粒體損傷 標志物相關蛋白表達比較

1~4:對照組,RA 10 μmol/L組,RA 20 μmol/L組,RA 40 μmol/L組,下圖同圖4 不同濃度RA對SGC-7901細胞線粒體 損傷標記物相關蛋白表達的影響
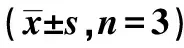
表3 各組SGC-7901細胞中Nrf2/HO-1 通路相關蛋白表達比較

圖5 不同濃度RA對SGC-7901細胞 Nrf2/HO-1通路相關蛋白表達的影響
3 討 論
胃癌是消化系統中常見的惡性腫瘤,發病機制受到多種因素的調控。與前期相比,胃癌的治療水平有所提高,患者的預后得到一定程度的改善,但治療效果仍不令人滿意〔5〕。前期學者研究顯示,RA對口腔癌〔16〕、乳腺癌〔17〕、肝癌〔18〕、直腸癌〔19〕等腫瘤細胞的生長和增殖具有抑制作用顯著。本研究結果顯示RA對細胞生長及增殖有抑制作用,與上述研究一致。
細胞凋亡是在復雜的分子生物學機制下,細胞受相關因子調控的自主死亡,對機體具有重要的生理學意義〔20,21〕。Xie等〔22〕的研究發現,通過抑制細胞生長與增殖,誘導癌細胞凋亡。本研究結果顯示細胞凋亡率顯著升高,與上述研究一致。因此,推斷RA抑制SGC-7901細胞的生長及增殖,可能與調控細胞凋亡有關。
在生物體內,MDA是自由基作用于脂質發生過氧化反應的產物,反映脂質的過氧化程度及膜系統的受損程度〔23〕。載脂蛋白結合細胞外基質中負電性的蛋白聚糖引起LDL駐留在內膜〔24〕,而線粒體解聯的呼吸鏈,會產生大量的ROS,氧化相關脂質物質〔25〕。本研究結果提示膜系統受損及細胞過氧化程度嚴重;熒光強度逐漸增強,ROS水平顯著升高,說明發生氧化應激反應,結果與前面標志物水平吻合。因此,說明RA通過氧化應激反應,促進胃癌SGC-7901細胞凋亡。
線粒體轉膜電位不平衡,其中高表達的Bcl-2及Bax能影響膜電位的耗散,導致膜穿透性的改變,線粒體表面發生聚合并形成孔道,使線粒體內的促凋亡因子和細胞色素C釋放入細胞質引發凋亡〔26〕。caspase-3是細胞凋亡中重要的效應因子及主要執行者。其活化形式為Cleaved caspase-3,同樣是細胞凋亡進入不可逆階段的重要標志〔27〕。本研究與上述研究一致。因此,說明RA通過調控線粒體損傷相關指標水平,促進胃癌SGC-7901細胞凋亡。
Nrf2是調控細胞氧化應激反應的重要轉錄因子,同時也是維持細胞內氧化還原穩態的中樞調節者〔28〕。NQO1及HO-1均是Nrf2調控的抗氧化因子。李慧等〔29〕研究表明,Nrf2/HO-1是誘導細胞凋亡的重要通路。本研究結果提示RA通過調控Nrf2/HO-1通路相關蛋白表達,促進胃癌SGC-7901細胞凋亡。

