《中國大劑量甲氨蝶呤循證用藥指南》解讀Δ
宋再偉 ,劉 爽 ,趙榮生 #,翟所迪 ,張相林 ,李幼平 ,杜冠華 ,石遠凱 ,繆麗燕 ,張伶俐 ,景紅梅
(1.北京大學第三醫院藥劑科,北京 100191;2.北京大學醫學部藥物評價中心,北京 100191;3.中日友好醫院藥學部,北京 100029;4.四川大學華西醫院中國循證醫學中心,成都 610041;5.中國醫學科學院北京協和醫學院藥物研究所藥物靶點研究與新藥篩選北京市重點實驗室,北京 100050;6.中國醫學科學院北京協和醫學院腫瘤醫院內科,北京 100021;7.蘇州大學附屬第一醫院藥學部,蘇州 215006;8.四川大學華西第二醫院藥學部,成都 610044;9.北京大學第三醫院血液內科,北京 100191)
大劑量甲氨蝶呤(high-dose methotrexate,HDMTX)指甲氨蝶呤(methotrexate,MTX)的給藥劑量大于500 mg/m2,常用于急性淋巴細胞白血病(acute lymphoblastic leukemia,ALL)、非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)、骨肉瘤等疾病的一線化療[1]。目前,HDMTX在臨床治療中存在較高的用藥風險,且毒副作用表現出顯著的個體差異,其相關代謝酶基因檢測以及血藥濃度監測時機、目標濃度等個體化用藥方面亟待規范。
《中國大劑量甲氨蝶呤循證用藥指南》(以下簡稱“指南”)是一部由北京大學第三醫院藥劑科發起,經中國藥理學會治療藥物監測研究專業委員會批準制訂,由中國藥學會循證藥學專業委員會、中國循證醫學中心和推薦意見分級的評價、制定與評估(Grades of Recommendations Assessment,DevelopmentandEvaluation,GRADE)中國中心提供方法學支持的臨床實踐指南[2]。指南的使用人群為臨床醫師、藥師、護師和其他相關者,目標人群為接受HDMTX治療的血液惡性腫瘤或骨肉瘤患者。指南項目組成員包括指導委員會、共識專家組、制訂工作組以及外審專家組。其中,指導委員會負責指南的重要決策,審核并批準推薦意見和指南發布;共識專家組由臨床藥學、血液腫瘤學、骨腫瘤學、循證醫學及藥物經濟學等多學科專家組成,負責臨床問題的確定與推薦意見共識的達成。
2017年5月,指南在國際實踐指南注冊平臺上進行注冊,注冊號為IPGRP-2017CN021。指南項目組嚴格遵從臨床實踐指南的最新定義與世界衛生組織指南制訂的方法學規范,在系統分析、梳理2.5萬余篇研究證據的基礎上,對HDMTX藥物治療證據進行了循證評價和定性、定量整合,采用GRADE方法進行證據質量評價與推薦意見強度分級,并考慮了國內7家醫院共計124例患者的意愿[3],經過9家醫院共計48位專家同行的外部評審后完成制訂,最終形成了涵蓋臨床用藥全流程的28條推薦意見,涉及用藥前評估、預處理與常規給藥方案、治療藥物監測(therapeutic drug monitoring,TDM)、亞葉酸鈣解救、不良事件管理等[4]。指南全文于2022年2月發表于 British Journal of Clinical Pharmacology期刊[5],指南編寫組現就指南的推薦意見進行中文版本的總結和解讀,以促進指南更好地在我國進行推廣實施,為HDMTX全程個體化給藥提供全面的技術支撐和使用建議。
1 證據分級與推薦強度
指南采用GRADE方法進行證據質量評價與推薦意見強度分級,即證據質量分為高、中、低、極低4個等級,推薦意見強度分為強推薦、弱推薦2個等級。推薦意見的強度主要基于對利弊的權衡,不完全依賴于證據質量。此外,對于必須在指南中形成推薦意見但已發表文獻證據有限的臨床問題,通過綜合臨床經驗與專家證據[6],參考已發布的專家共識或診療規范,并經指南指導委員會與共識專家組取得共識后形成推薦意見,在指南中將此類證據分級標記為“專家意見”。
2 推薦意見總結與解讀
指南推薦意見的總體框架見圖1。在多維度、全流程規范臨床用藥的前提下,個體化給藥是指南的核心內容,藥物基因檢測與TDM是實現HDMTX個體化用藥的“雙臂”。用藥前基因檢測,可預先對患者的用藥風險進行分層,如亞甲基四氫葉酸還原酶(methylenetetrahydrofolate reductase,MTHFR)活性重度減低提示HDMTX用藥風險可能增加;用藥后TDM,可監測實際治療后的血藥濃度(CMTX),評估是否達到目標濃度范圍并指導劑量優化,確保CMTX維持在安全有效的治療范圍。
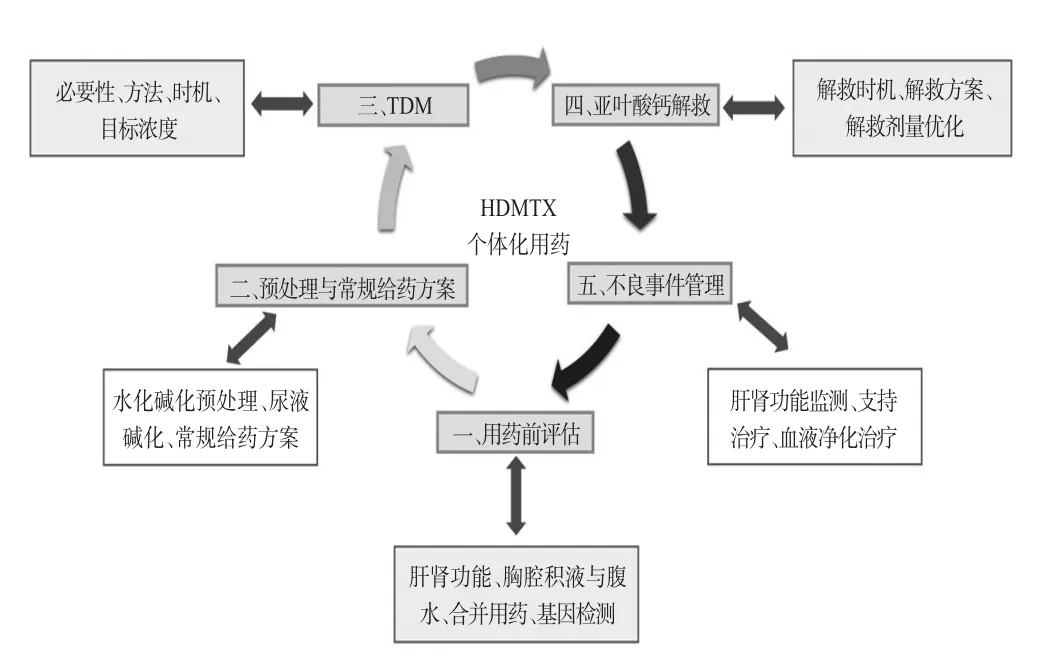
圖1 指南推薦意見的總體框架
2.1 用藥前評估
2.1.1 用藥前評估腎功能的必要性
指南推薦意見1:推薦用藥前常規檢測腎功能,并將其作為個體化劑量調整的考慮因素之一(強推薦,低質量證據)。
約90%的MTX以原型經尿液排泄。HDMTX誘導的腎功能損傷與MTX及其代謝物7-羥基甲氨蝶呤(7-OHMTX)在腎小管中沉淀及MTX對腎小管的直接毒性作用有關[7]。有2%~12%的患者可能發生急性腎損傷,腎損傷后可引起排泄延遲,導致藥物蓄積,進而引起全身毒性反應[8]。系統評價證據表明,用藥前評估腎功能并調整藥物劑量,可顯著降低肝損傷、消化道毒性和口腔黏膜炎等的發生風險(受篇幅所限,本文中的系統評價證據若無特別說明均可參見指南附件[5])。故指南推薦臨床用藥前常規完善血清肌酐等腎功能評估,并綜合考慮患者既往化療耐受性及是否合并使用了腎毒性藥物,必要時應調整MTX劑量。對于基線腎功能不全的患者,水化堿化預處理、用藥后進行TDM與腎功能監測對確保其用藥安全尤其重要。此外,兒童和青少年ALL及骨肉瘤患者根據基線腎功能調整HDMTX初始劑量的方法參考國家衛生健康委員會發布的ALL及骨肉瘤診療規范,即當肌酐清除率分別為80~100、60~<80、40~<60、20~<40 mL/min時,MTX的劑量應分別下調至原劑量的80%、70%、50%、40%[9-10]。
2.1.2 用藥前評估肝功能的必要性
指南推薦意見2:推薦用藥前常規檢測肝功能,并將其作為個體化劑量調整的考慮因素之一(強推薦,低質量證據)。
HDMTX相關的肝功能損傷多表現為一過性轉氨酶等實驗室指標升高,但多次重復的HDMTX治療可能引起肝臟毒性累積。肝功能損傷的風險因素包括酒精性、病毒性以及脂肪性肝炎等病史[8]。系統評價證據表明,HDMTX治療后患者的丙氨酸轉氨酶(alanine aminotransferase,ALT)、天冬氨酸轉氨酶(aspartate aminotransferase,AST)、γ-谷氨酰轉肽酶(γ-glutamyl transferase,GGT)等指標水平顯著升高,堿性磷酸酶(alkaline phosphatase,ALP)水平顯著降低。故指南推薦臨床用藥前常規完善ALT、AST、GGT、ALP等肝功能指標檢查,評估患者肝炎病史。目前國內外尚缺乏肝功能不全患者的MTX劑量調整方案,嚴重肝功能不全者應避免或謹慎應用HDMTX,并注意加強用藥后定期肝功能監測。
2.1.3 用藥前評估胸腔積液與腹水的必要性
指南推薦意見3:建議用藥前評估胸腔積液與腹水。當積液量較大且必須使用HDMTX時,建議酌情減量并加強TDM,監測不良事件并及時處置(弱推薦,極低質量證據)。
當存在胸腔積液和腹水等第三間隙積液時,HDMTX在體內的藥動學過程將發生變化。MTX可能在第三間隙積液中蓄積并從中緩慢流出,導致MTX終末半衰期延長,引起排泄延遲和其他嚴重不良事件[11]。胸腔積液和腹水等第三間隙積液被認為是HDMTX治療的潛在相對禁忌。故指南建議用藥前評估胸腔積液和腹水情況,當積液量較大時,建議臨床評估是否可抽取積液。若大量積液無法抽取,是否應用HDMTX治療取決于風險與獲益的平衡;若繼續采取HDMTX治療,建議酌情減少劑量,并對CMTX與不良事件進行更嚴密的監測。
2.1.4 用藥前評估合并用藥的必要性
指南推薦意見4:推薦充分評估合并用藥情況,并謹慎聯用如下藥物——(1)影響MTX藥動學的藥物,包括競爭血漿蛋白結合的藥物(如阿司匹林、苯妥英)和影響MTX清除的藥物(如非甾體抗炎藥、青霉素類、質子泵抑制劑、磺胺類、環丙沙星以及維生素C等影響尿液酸堿度的藥物)等。(2)影響MTX藥效學的藥物,包括引起血液毒性、腎毒性、肝毒性的藥物以及華法林、環孢素、氫氯噻嗪或其他與MTX具有不良相互作用的藥物。必須聯用上述藥物時,需密切監測CMTX與不良事件(強推薦,中等質量證據)。
MTX臨床用藥風險較高,藥物相互作用復雜。基于對相關研究證據的系統評價,以及對藥品說明書、Micromedex數據庫的補充檢索,指南將MTX藥物相互作用類別歸納總結為藥動學和藥效學兩大類,其中藥動學方面的相互作用包括對MTX分布或排泄的影響。故指南推薦用藥前應常規完善上述合并用藥的風險評估,尤其警惕維生素C、質子泵抑制劑、利尿劑等化療常用輔助藥物對MTX的影響。鑒于HDMTX用藥風險較高,應盡量避免聯用具有潛在相互作用的藥物,必須合并用藥時需對CMTX與不良事件進行更嚴密的監測。
2.1.5 用藥前檢測代謝酶基因多態性的必要性
指南推薦意見5:血液惡性腫瘤患者可考慮檢測MTHFR 677C>T(rs1801133)和1298A>C(rs1801131)基因多態性(弱推薦,中等質量證據)。
指南推薦意見6:特定情況下,血液惡性腫瘤患者可考慮檢測ABCB1 3435C>T(rs1045642)基因多態性(弱推薦,低質量證據)。
指南推薦意見7:不推薦血液惡性腫瘤患者檢測SLC19A1 80A>G(rs1051266)基因多態性(弱推薦,低質量證據)。
指南推薦意見8:不推薦骨肉瘤患者常規實施基因檢測,必要時可考慮MTHFR與ABCB1相關基因檢測(弱推薦,低質量證據)。
MTX在體內的藥動學過程以及患者療效或不良反應的個體差異較大,相關代謝酶與轉運體的基因多態性可能為重要的影響因素之一。因此,基因檢測是HDMTX個體化用藥的熱點問題,也是指南推薦意見的重點。目前的藥物遺傳學研究多聚焦于HDMTX相關不良反應,尚缺乏足夠的證據支持基因多態性與臨床療效的相關性,所以指南中有關基因檢測的推薦意見僅基于安全性考慮。鑒于血液惡性腫瘤與骨肉瘤患者的MTX給藥劑量與輸注方案差異較大,指南對這2類人群分別提供了推薦意見。
(1)對于血液惡性腫瘤患者:①MTHFR基因是HDMTX藥物遺傳學領域研究最廣泛的基因,該基因的突變可導致酶活性下降和葉酸代謝障礙,進而影響MTX等葉酸拮抗劑的藥理活性。系統評價結果顯示,有較多證據支持MTHFR 677C>T位點的單核苷酸多態性(single nucleotide polymorphism,SNP)與血液毒性、口腔黏膜炎毒性風險增加有關;②ABCB1基因編碼的P-糖蛋白(P-gp)參與MTX細胞外排轉運,一定數量的證據表明3435C>T位點的SNP與肝臟毒性風險增加有關;③還原型葉酸載體(reduced folate carrier 1,RFC1/SLC19A1)參與MTX向胞內轉運,但現有證據不支持其基因80A>G位點的SNP與HDMTX毒性相關[12]。此外,患者意愿調查顯示,86.90%的血液惡性腫瘤患者愿意接受基因檢測[3]。鑒于目前仍缺乏直接證據證實基因檢測指導HDMTX用藥的臨床獲益,也缺乏HDMTX基因檢測的經濟學證據,結合上述關聯性證據的系統評價結果,指南建議可考慮進行MTHFR相關基因檢測,必要時也可考慮檢測ABCB1 3435C>T,但不建議檢測SLC19A1 80A>G。藥師應基于基因檢測結果提供個體化用藥解讀與指導,對于用藥高風險的患者可考慮酌情減量,并加強TDM與不良事件監測。
(2)對于骨肉瘤患者:支持MTHFR C677T與HDMTX毒性關聯的證據較為有限,其他基因位點與HDMTX毒性的相關性尚不十分明確[13]。患者意愿調查顯示,82.5%的骨肉瘤患者愿意接受基因檢測[3]。指南專家依據臨床經驗一致認為,骨肉瘤患者中HDMTX相關基因檢測的臨床獲益尚不明確。因此,綜合考慮現有證據、臨床經驗與經濟成本,指南不建議對骨肉瘤患者進行常規基因檢測。對于骨肉瘤患者,盡管缺乏基因檢測結果,但若規范開展TDM也有助于降低用藥風險、促進個體化用藥。
2.2 預處理與常規給藥方案
2.2.1 水化堿化的預處理方案
指南推薦意見9:推薦在HDMTX輸注前12 h或更早開始靜脈水化堿化,并在用藥前、用藥期間及用藥后持續規范地進行水化堿化(每日入量2.5~3 L/m2,持續時間≥72 h),直至CMTX低于0.1~0.2 μmol/L(強推薦,中等質量證據)。
充分的水化和尿液堿化對維持MTX在腎小管的溶解度以及經腎清除是必要的。系統評價證據表明,提前12 h或更早水化堿化與降低腎損傷發生風險有關,持續、充分的水化堿化與用藥安全性改善和住院時間縮短有關。充分水化的定義為每日入量2.5~3 L/m2,持續時間≥72 h。
考慮到化療可能引起患者的消化道反應,進而影響口服碳酸氫鈉的吸收,結合臨床可操作性,指南建議在靜脈水化液體中加入碳酸氫鈉,以實現尿液堿化。在臨床實踐中,建議臨床醫師與護理人員在滴注HDMTX前12 h或更早開始水化堿化。水化量可通過記錄飲食與靜脈滴注的入量進行估算,堿化可通過監測尿液pH判斷是否達標。此外,監測出入量并維持平衡有助于以最低風險進行有效的水化作用。
2.2.2 尿液堿化的目標pH范圍
指南推薦意見10:建議給藥前、給藥期間以及給藥后維持尿液pH≥7.0(弱推薦,低質量證據)。
MTX及其代謝物7-OHMTX易在酸性條件下發生沉淀,引起急性腎損傷[7]。系統評價證據與臨床經驗表明,尿液pH≥7.0可顯著改善用藥安全、減少腎損傷發生。在臨床實踐中,筆者建議每天常規監測尿液pH,直至CMTX達到安全范圍(即低于0.1~0.2 μmol/L)。對于發生排泄延遲或急性腎損傷的患者,建議增加監測頻率,對尿液pH進行更嚴密的監測,并維持尿液pH≥7.5。
2.2.3 血液惡性腫瘤患者的常規給藥方案
指南推薦意見11:用于血液惡性腫瘤的給藥劑量通常為1~8 g/m2,建議采用首劑量/負荷劑量結合維持治療的給藥方式,其中首劑量/負荷劑量(給藥總量的1/10)于0.5 h內靜脈滴注,維持治療劑量(給藥總量的9/10)在23.5 h內持續滴注;用于中樞神經系統淋巴瘤時,通常于3~4 h內快速滴注(弱推薦,專家意見)。
對于ALL、NHL等疾病,快速滴注負荷劑量有助于盡早達到血藥峰濃度(Cmax),剩余劑量持續滴注可維持穩態血藥濃度(Css)。對于中樞神經系統淋巴瘤,快速滴注有助于MTX透過血腦屏障,增加腦脊液中的藥物濃度。該推薦意見參考了已發布的專家共識和臨床診療規范[7,9]。由于缺乏高質量的證據,指南建議全面評估患者的實際情況,結合既往化療的療效與耐受性,審慎制訂給藥與滴注方案。
2.2.4 骨肉瘤患者的常規給藥方案
指南推薦意見12:用于骨肉瘤的劑量通常為8~12 g/m2,建議于4~6 h內快速滴注(弱推薦,專家意見)。
HDMTX用于治療骨肉瘤時,需要更高的CMTX以增加藥物在腫瘤組織的暴露,因此宜采用更高劑量,并在短時間內快速滴注。該條推薦意見參考了已發布的專家共識和臨床診療規范[8-9]。但由于缺乏高質量的證據,指南建議全面評估患者的實際情況,審慎制訂給藥與滴注方案。
2.3 TDM
2.3.1 HDMTX給藥后開展TDM的必要性
指南推薦意見13:推薦常規開展TDM(強推薦,低質量證據)。
MTX個體差異大,CMTX易受多種因素影響,且腫瘤患者往往伴隨較多的合并用藥。實施TDM并優化MTX和亞葉酸鈣解救劑量有助于提高血藥濃度達標率,降低不良事件發生率,改善療效。患者意愿調查顯示,95.24%的血液惡性腫瘤患者與92.50%的骨肉瘤患者均愿意接受TDM[3]。因此,指南推薦HDMTX給藥后常規開展TDM。
2.3.2 TDM方法
指南推薦意見14:基于藥物檢測特異性與結果準確性,推薦采用高效液相色譜-串聯質譜(HPLC-MS/MS)、高效液相色譜(HPLC)等分析方法開展TDM;當條件受限或需快速檢測時,可采用熒光偏振免疫分析(FPIA)、酶放大免疫分析(EMIT)和化學發光微粒子免疫分析(CMIA)等試劑盒方法(強推薦,極低質量證據)。
MTX以原型和代謝物的形式存在于體內,包括MTX、7-OHMTX、多聚谷氨酸化甲氨蝶呤(PGMTX)、2,4-二氨基-N10-甲基蝶酸(DAMPA)。在MTX代謝物中,PGMTX和7-OHMTX被發現與抗腫瘤細胞增殖活性和/或不良反應有關,但其檢測意義、檢測時機及目標濃度范圍均有待進一步明確,目前臨床TDM仍以MTX為主。
HPLC和HPLC-MS/MS可用于檢測和區分MTX及其代謝物,但成本相對高、樣品處理復雜。試劑盒方法測定所需時間短,但線性范圍窄、無法區分MTX及其代謝物(不同TDM方法的詳細比較詳見指南附件)。由于TDM發展水平因地區而異,色譜分析方法和試劑盒方法在TDM工作中均發揮了重要作用。指南建議各醫療機構可根據臨床需求與自身條件選用合適的TDM方法。但值得注意的是,試劑盒方法的結果可能需校正。此外,應用美國FDA批準的MTX解毒劑谷卡匹酶后,患者體內MTX均轉化為DAMPA,此時免疫測定方法可能會高估CMTX。故對于應用谷卡匹酶的患者,指南建議選用色譜分析方法,避免應用FPIA法。
2.3.3 TDM時機
指南推薦意見15:對于24 h持續滴注方案,推薦至少于滴注開始后24、48、72 h各監測 1次 CMTX,直至CMTX≤0.1~0.2μmol/L;當出現排泄延遲、急性腎損傷或其他嚴重不良事件時,應縮短監測間隔、增加監測頻率(強推薦,專家意見)。
指南推薦意見16:對于滴注時間≤6 h的快速滴注方案,推薦至少于滴注開始后3~6 h(即滴注結束時)、24、48、72 h各監測1次CMTX,直至CMTX≤0.1~0.2 μmol/L;當出現排泄延遲、急性腎損傷或其他嚴重不良事件時,應縮短監測間隔、增加監測頻率(強推薦,專家意見)。
HDMTX給藥方案根據滴注時間可分為24 h持續滴注和快速滴注2類。相對應地,TDM方案根據滴注時間可分為2類:對于24 h持續滴注方案,滴注結束時的血藥濃度(C24h)被認為是Css,與療效和安全性相關,而消除相的C48h和C72h則主要與安全性有關;對于滴注時間≤6 h的快速滴注方案,滴注結束時的C3~6h被認為是Cmax,與療效和安全性相關,而消除相的C24h、C48h、C72h則主要與安全性相關。故指南建議,至少在滴注結束時和滴注結束后24、48、72 h各監測1次CMTX。藥師應結合不同時間點的目標濃度范圍,為臨床提供TDM結果解讀;當出現排泄延遲或不良事件時,應縮短監測間隔、增加監測頻率。
2.3.4 血液惡性腫瘤患者的C24h目標范圍
指南推薦意見17:對于ALL患兒,推薦24 h滴注結束時C24h(即Css)的目標范圍為16~40μmol/L(強推薦,中等質量證據)。
目前尚缺乏成人患者C24h目標范圍的臨床研究,相關證據僅關注ALL患兒——對于ALL患兒,C24h>16μmol/L可能有助于提高臨床療效,而C24h>40μmol/L可能會增加毒性風險[14]。故基于療效和安全性平衡的考慮,指南推薦將16、40μmol/L分別作為ALL患兒C24h目標范圍的下限和上限。對于成人血液惡性腫瘤患者,藥師可一定程度上參考該濃度范圍進行TDM結果解讀,并積極探索驗證成人患者的C24h目標范圍。此外,開展TDM的同時仍有必要密切監測不良事件。
2.3.5 骨肉瘤患者的C4~6h目標范圍
指南推薦意見18:對于骨肉瘤患者,建議4~6 h滴注結束時的C4~6h(即Cmax)的目標范圍為1 000~1 500μmol/L(弱推薦,低質量證據)。
系統評價證據表明,對于骨肉瘤患者,C4~6h>1 000μmol/L的臨床療效更好,但C4~6h>1 500 μmol/L時療效未顯著改善,而嚴重毒性發生風險增加[15]。故基于療效和安全性平衡的考慮,指南建議將1 000、1 500μmol/L分別作為Cmax目標范圍的下限和上限。鑒于骨肉瘤患者MTX給藥劑量較大,且需在短時間內快速滴注,故臨床在開展TDM的同時仍有必要密切監測不良事件。
2.3.6 基于TDM的劑量調整
指南推薦意見19:建議基于TDM結果與目標治療濃度,結合藥動學特性,對MTX劑量進行個體化調整(弱推薦,低質量證據)。
已有不少群體藥動學研究確定了HDMTX藥動學參數的影響因素,但個體化濃度的預測模型尚未廣泛建立。指南建議根據患者的個體情況(包括化療療效、耐受性以及本周期TDM結果),審慎調整下一周期的給藥劑量。對于24 h持續滴注的患者,當條件允許時,可測定負荷劑量給藥結束時的CMTX,并使用經過驗證的藥動學模型預測C24h,以調整維持劑量的輸注速率,優化本周期給藥劑量。
2.3.7 快速滴注方案的C24h目標范圍
指南推薦意見20:對于滴注時長≤6 h的快速滴注方案,建議滴注后C24h的目標范圍為C24h≤10μmol/L(弱推薦,低質量證據)。
從藥動學角度考慮,快速滴注方案通常用于治療骨肉瘤和中樞神經系統淋巴瘤,該方案中C24h可用于評估排泄延遲并預警不良事件。系統評價證據表明,C24h≤10μmol/L提示MTX清除正常、不良事件風險低;而C24h>50μmol/L則提示早期排泄延遲[5]。故指南建議骨肉瘤和中樞神經系統淋巴瘤患者接受HDMTX快速滴注方案時,C24h應≤10μmol/L。當出現排泄延遲時,應增加TDM頻率,加強水化、堿化、亞葉酸鈣解救等支持治療,并密切監測不良事件。
2.3.8 C48h與C72h目標范圍
指南推薦意見21:推薦開始滴注后C48h與C72h的目標范圍分別為C48h≤1 μmol/L、C72h≤0.1~0.2 μmol/L;當C72h>0.1~0.2μmol/L時,可考慮縮短監測間隔、增加監測頻率,并持續監測至CMTX≤0.1~0.2μmol/L(強推薦,中等質量證據)。
對于快速滴注方案或24 h持續滴注方案,消除相的C48h與C72h均用于評估MTX的清除情況。系統評價證據表明,C48h≤1μmol/L可提示清除正常、不良事件風險低,而C48h>5μmol/L則提示排泄延遲;C72h則被廣泛用于評估是否已達到安全濃度,C72h≤0.1~0.2μmol/L時可停止TDM與解救[5]。故指南建議C48h應≤1μmol/L,C72h應≤0.1~0.2μmol/L。當存在排泄延遲時,應增加TDM頻率,加強水化、堿化、亞葉酸鈣解救等支持治療,并密切監測不良事件。多數情況下,停止TDM的CMTX為≤0.1~0.2μmol/L;對于出現排泄延遲、急性腎損傷的患者,CMTX的安全范圍應更為嚴格,以<0.05μmol/L為宜。
針對不同滴注方案的TDM時機與目標濃度相關推薦意見的總結見圖2。
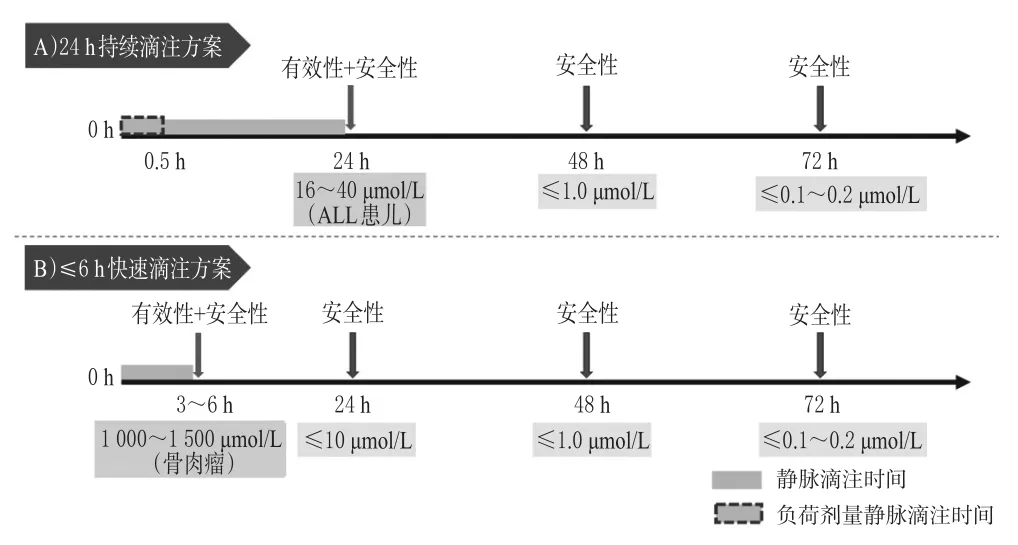
圖2 HDMTX的TDM時機與目標濃度
2.4 亞葉酸鈣解救
2.4.1 初始解救時機
指南推薦意見22:對于24 h持續滴注方案,推薦開始滴注后36~44 h給予首劑亞葉酸鈣解救;當出現嚴重不良事件時,應結合臨床、個體化地調整首劑解救時機(強推薦,低質量證據)。
指南推薦意見23:對于滴注時間≤6 h的快速滴注方案,建議開始滴注后12~24 h給予首劑亞葉酸鈣解救;當出現嚴重不良事件時,應結合臨床、個體化地調整首劑解救時機(弱推薦,專家意見)。
MTX是二氫葉酸還原酶抑制劑,通過拮抗葉酸發揮藥理作用。亞葉酸鈣是葉酸在體內的活化形式,可用作MTX解毒劑,故HDMTX治療又稱為HDMTX-亞葉酸鈣解救療法。合理的亞葉酸鈣解救至關重要,過早解救可能拮抗化療效果,而過晚解救則可能導致嚴重的不良事件[16]。
系統評價證據表明,與36 h時解救相比,24 h持續滴注方案首次解救延遲至42或44 h的療效與安全性無顯著差異,故指南推薦首次解救時機為開始滴注后36~44 h[5]。對于滴注時間≤6 h的快速滴注方案,參考已發布的專家共識[16]和臨床診療規范[10],指南建議首次解救時機為開始滴注后12~24 h,但通常不晚于24 h。臨床實際中,指南建議結合患者既往HDMTX化療的耐受性與不良事件發生情況,個體化調整首劑亞葉酸鈣解救時機;對于首劑解救相對較晚的患者,應加強不良事件監測。
2.4.2 初始解救方案
指南推薦意見24:首劑亞葉酸鈣解救時,推薦常規予亞葉酸鈣15 mg/m2,q6 h,靜脈滴注或肌內注射(強推薦,低質量證據)。
系統評價證據表明,15 mg/m2劑量的用藥安全性與20或30 mg/m2相比無顯著差異。理論上,亞葉酸鈣劑量越低,對化療的拮抗作用越弱。此外,亞葉酸鈣半衰期為4~6 h,盡管存在亞葉酸鈣q3 h給藥的經驗性用法,但目前尚無研究證實縮短亞葉酸鈣給藥間隔的臨床獲益[16]。故指南推薦初始亞葉酸鈣解救劑量為15 mg/m2,q6 h,加強解救的方法通常為增加單次解救劑量[16]。考慮化療引起的消化道反應可能影響口服藥物吸收,且亞葉酸鈣生物利用度可能隨劑量增加而降低,故建議給藥途徑優先考慮靜脈注射或肌內注射。
2.4.3 解救劑量優化
指南推薦意見25:建議臨床監測CMTX,并基于C42~48h調整亞葉酸鈣解救劑量(弱推薦,專家意見)。
亞葉酸鈣劑量調整方案參考ALL患兒臨床診療規范制訂[7],詳見表1。當CMTX極高時,指南建議結合臨床,適當上調亞葉酸鈣劑量進行個體化解救,但需注意避免亞葉酸鈣過量;當單次解救劑量較高時,建議輸注時間宜保持在1 h以上,并警惕高鈣血癥副作用。亞葉酸鈣解救應持續至CMTX降至安全范圍(通常為CMTX≤0.1~0.2μmol/L);對于存在排泄延遲或不良事件的患者,可考慮持續解救至CMTX<0.05μmol/L。
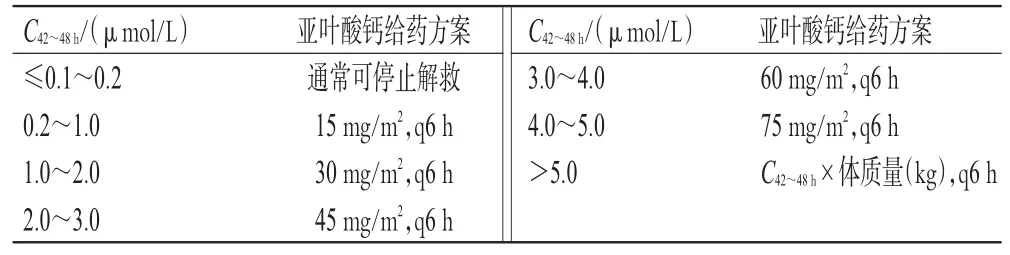
表1 亞葉酸鈣劑量調整方案
2.5 不良事件管理
2.5.1 用藥后肝腎功能監測
指南推薦意見26:建議用藥后注意監測肝腎功能,直至CMTX達到安全范圍(弱推薦,低質量證據)。
肝腎功能損傷為HDMTX常見的不良事件。系統評價證據表明,HDMTX給藥后患者的肝腎功能會發生顯著變化。指南建議結合臨床,每1~3 d監測1次肝腎功能,直至CMTX≤0.1~0.2 μmol/L。
2.5.2 發生不良事件的支持治療
指南推薦意見27:發生不良事件時,建議增加亞葉酸鈣解救劑量,結合患者個體情況加強水化,持續堿化以維持尿液pH>7.0,并及時予含漱劑等其他對癥支持治療(弱推薦,專家意見)。
該推薦意見主要基于本指南專家組共識。發生不良事件需加強水化、堿化等支持治療,建議維持每日入量2.5~3 L/m2,維持尿液pH≥7.5。水化過程需注意充分結合患者個體情況(如心力衰竭、腎功能不全),并注意監測出入量與電解質。對于口腔黏膜炎的防治,可使用含有氯己定、甲硝唑、復合維生素B、利多卡因、亞葉酸鈣等的復方含漱劑,并注意囑咐患者每日多次漱口。
2.5.3 血液凈化治療
指南推薦意見28:當CMTX過高、并發嚴重急性腎損傷或其他嚴重不良反應,且常規解救與支持治療無法在短期內有效降低CMTX時,可考慮采用血液凈化治療。建議選用高通量血液透析、持續腎替代療法或聯合血液凈化技術,并注意監測濃度反跳及血液凈化治療的副作用(弱推薦,低質量證據)。
當CMTX過高時,細胞內亞葉酸鈣解救可能受到抑制,指南建議可考慮給予血液凈化治療以實現細胞外解救。常規血液透析和腹膜透析對于解救MTX中毒的療效可能欠佳,不同血液凈化治療的比較詳見指南附件[5]。當CMTX極高時,建議可聯用高通量血液透析和血液灌注。當出現血流動力學不穩定或其他危及生命的緊急情況時,建議選用持續腎替代療法。給予血液凈化治療的同時,需注意監測CMTX及血液凈化相關副作用。
此外,谷卡匹酶已獲美國FDA批準用于HDMTX中毒,該藥可將體內MTX轉化為DAMPA,迅速降低CMTX,臨床可考慮將其作為一種治療選擇。目前也已有專家共識提供了谷卡匹酶給藥的具體建議[10]。
3 討論
本指南是國內首部抗腫瘤藥物循證用藥指南。與現有國內外HDMTX專家共識相比[16-17],本指南的區別和優勢如下:(1)本指南遵循了國際公認的世界衛生組織和GRADE方法等指南制訂規范,每條推薦意見均基于現有最佳證據的系統評價產生,通過嚴格設計的德爾菲法達成共識,并通過同行外部評審后定稿;(2)本指南的制訂過程不僅重視指南專家組利益沖突管理,還通過調查患者的價值觀與偏好實現了指南制訂的患者參與,大大提高了指南的透明度和患者接受度;(3)本指南為HDMTX個體化給藥提供了全面、實用的建議,涵蓋用藥前評估、預處理與常規給藥方案、TDM、亞葉酸鈣解救、不良事件管理等HDMTX用藥全流程。綜上,本指南可為進一步促進臨床規范化開展HDMTX的TDM及其合理用藥提供參考。
《中國大劑量甲氨蝶呤循證用藥指南》工作組名單
指導委員會:杜冠華、石遠凱、翟所迪、張相林、李幼平
共識專家組(按姓氏筆畫順序):王卓、王天有、王曉玲、牛曉輝、朱珠、湯靜燕、克曉燕、李國輝、吳久鴻、邱峰、沈靖南、張畢奎、張伶俐、張艷華、陳耀龍、鄭胡鏞、郭衛、郭瑞臣、黃紅兵、黃曉軍、董梅、景紅梅、甄健存、詹思延、肇麗梅、繆麗燕
外審專家組(代表):趙立波、張威、黃琳、蔡驊琳、夏凡、劉鐸、劉韜、黃真
制訂工作組:宋再偉、劉爽、胡楊、談志遠、黃振城、林巧楠、王冠儒、姜丹

