連續光源火焰原子吸收光譜法測量鎂電解質中四元組分的含量
張遠琴
(攀西釩鈦檢驗檢測院 四川攀枝花 617000)
鎂電解質是電解法生產金屬鎂的電解液。目前,世界各國鎂電解生產使用的電解質體系為MgCl2-NaCl-CaCl2系、MgCl2-KCl-NaCl 和MgCl2-KCl-NaCl-CaCl2系[1],這些體系有一系列狀態點,其初晶溫度低于MgCl2和Mg 的熔點,這就可以使鎂電解生產能在比鎂熔點高出不多的溫度下進行,就可以保證熔體有足夠的流動性,鎂能很好上浮,又不會引起鎂的過大的化學損失[2-3]。在實際生產中,通常是根據原料和電解槽結構來選定電解質配比。電解質中各組分在電解過程中分別扮演重要角色:電解質中MgCl2濃度的控制是非常重要的指標,MgCl2濃度直接影響電流效率、單槽產鎂量、氯氣濃度等[4]。生產實踐中,當MgCl2濃度過高,電解槽內就會發生電解質高循環,電解質的高循環會造成電流效率的損失,并且高循環會生成大量氯氣被帶入到電解槽隔間,致使氯氣與鎂液發生二次反應,電流效率大幅降低;當電解質中MgCl2濃度過低后,電流密度大幅增高,電流密度增高會使堿金屬放電增多,從而導致電流效率大幅降低。NaCl 在電解質組成中保證電解質成分穩定的同時,其電導率最大,電解質的電導率隨NaCl含量的增大而增大,這一特性能有效降低電解質壓降,從而降低槽電壓,提高電流效率;KCl 表面張力較小,能使電解質很好地浸潤鎂層表面,保護鎂不燃燒;CaCl2主要是改善電解質密度,促使電解過程中陰極產生的鎂珠上浮[5];由此可見,電解質中各組分含量的控制是影響電解槽電流效率、槽電壓、產鎂量、氯氣濃度等關鍵指標。
目前,測定高含量鈣、鎂通常采用EDTA 滴定法[6],電感耦合等離子發射光譜法測量工業鹽中鈣鎂鋇鉛[7-8],鉀鈉常用原子吸收光譜法[9-10]。由于K、Na第一電離電位較低,在ICP-OES炬焰中會提前電離,會造成測量穩定性下降,也可采用離子色譜法同時測量鉀鈉鈣鎂[11],但電解質中鉀鈉鈣鎂含量較高,采用離子色譜測量會產生較大的稀釋誤差。本文以國內某廠電解槽四元電解質MgCl2-KCl-NaCl-CaCl2,其組成包括MgCl2(10%~20%)、NaCl(40%~50%)、KCl(3%~10%)、CaCl2(5%~10%)為研究對象,采用連續光源火焰原子吸收光譜法,同時測定四組分的含量,此方法可快速準確地測定上述電解質中四元組分含量。
1 試驗部分
1.1 儀器與試劑
ContreAA700連續光源原子吸收光譜儀(德國耶拿儀器有限公司);鹽酸(38%,優級純);鉀、鈉、鎂、鈣的單元素標準儲備溶液(各元素濃度均為1000μg/mL);100g/L 氯化鑭溶液:稱取100g 氯化鑭(分析純)溶解于1000mL 蒸餾水中;稀鹽酸(2%,V/V):取20mL 鹽酸(38%)加入到1000mL容量瓶中用純水定容;混合標準溶液的配制:取7 支100mL 容量瓶中分別取鉀、鈣、鎂標準儲備溶液(1000μg/mL)0μl、100μl、200μl、400μl、600μl、800μl、1000μl,鈉標準儲備溶液(1000μg/mL)0μl、500μl、1000μl、1500μl、2000μl、2500μl、3000μl,再加入2mL 氯化鑭溶液(100g/l),用2%的稀鹽酸定容,混均備用;實驗用水均為超純水。
1.2 儀器工作條件
原子吸收光譜儀分析條件見表1。
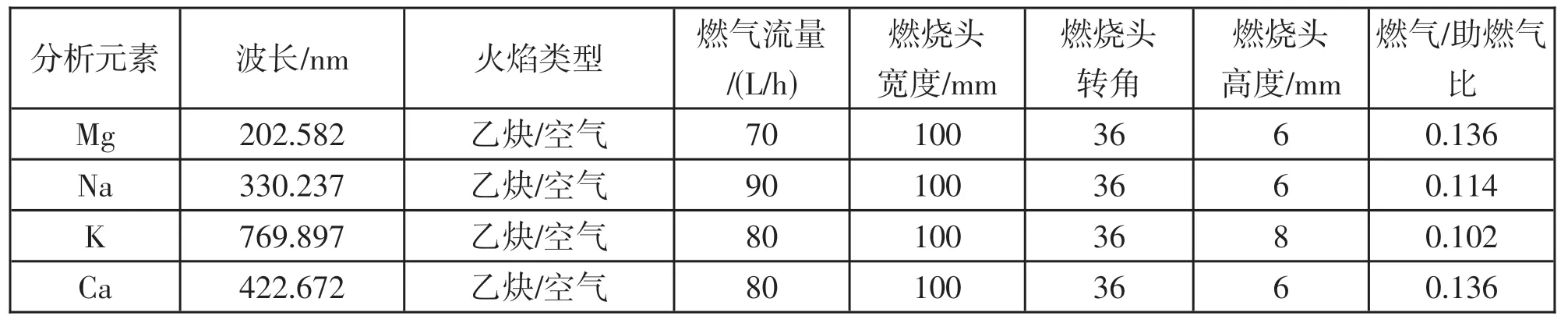
表1 各元素的分析條件
1.3 實驗方法
稱取0.20g(精確到0.0001g)試樣于200mL 燒杯中,加入溫度為75℃的蒸餾水50mL,溶解完全后定容到200mL 容量瓶中,將此溶液過濾,分取濾液10mL 到100mL 容量中,加入2mL 氯化鑭溶液(100g/L),用2%的稀鹽酸定容,混均上機測量。
2 結果與討論
2.1 火焰對測定的影響
對于火焰原子吸收,火焰溫度是決定待測元素原子化效率的重要因素之一,而火焰溫度取決于乙炔和空氣的流量大小。在本實驗中,利用儀器軟件自帶的對被測元素火焰參數進行優化的功能,實驗選擇標準曲線第四個濃度(Mg、Ca、K=6mg/L,Na=20mg/L)的混合標準溶液對待測元素火焰參數(燃氣流量、助燃比、燃燒頭高度)進行自動優化。優化后的火焰參數見表1。
2.2 待測元素分析譜線的選擇
電解質中的鈉、鎂、鈣、鎂的含量在5%~60%之間,四組分含量各不相同,各元素分析譜線靈敏度也不盡相同,要滿足4種元素同時測量,選擇合適的分析譜線至關重要。為找到最佳的分析譜線,實驗配制了濃度范圍覆蓋上述范圍的四元素模擬混合溶液,每個元素選擇兩條以上不同分析譜線(Na:589.522nm、330.237nm、
330.298nm,Mg:285.213nm、202.582nm,K:769.897nm、404.414nm,Ca:422.673nm、239.856nm),按照優化后的火焰條件進行測量,通過實驗發現Na(589.522nm)、Mg(285.213nm)靈敏度過高,高濃度點吸光度趨于飽和;K(404.414nm)、Ca(239.856nm)靈敏度過低,測量波動大,不宜做分析譜線;綜合考慮四元素,同時測量靈敏度要求,實驗選擇Na(330.237nm)、Mg(202.582nm)、K(769.897nm)、Ca(422.673nm)為分析譜線。
2.3 干擾及消除
在火焰中,由于鉀、鈉屬于易電離元素,在火焰中易發生提前電離減少了參與原子吸收的基態原子數而產生電離干擾,使被測元素吸光度降低。另一方面,溶液或空氣中一些分子在火焰中會產生分子吸收光譜對鈉、鎂、鈣測定有干擾,如Na330.237nm處存在NH分子光譜干擾(見圖1),Mg202.582nm 處存在SiO 分子光譜干擾(見圖2)。為解決上述元素測量干擾,實驗采用在溶液中加入2mL 氯化鑭溶液(100g/L),氯化鑭既是消電離劑也是釋放劑,在測定K、Na時可以消除電離干擾,在測定Ca、Mg時可以消除分子吸收光譜干擾。
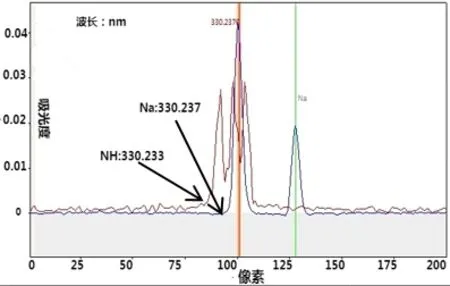
圖1 Na330.237nm處存在NH分子光譜干擾
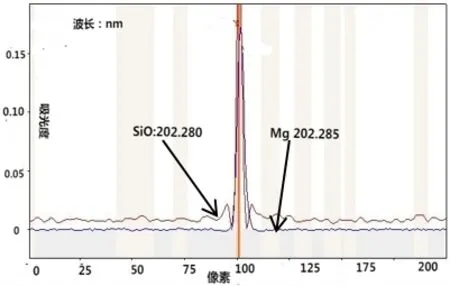
圖2 Mg202.582nm 處存在SiO 分子光譜干擾
2.4 測精密度實驗
將樣品溶液重復測定5次,實驗結果見表2。由表2 可知,K、Na、Ca、Mg4 種元素的相對標準偏差分別為0.108、0.108、0.034、0.062,各元素的相對標準偏差均小于1%,重現性好,精密度高。
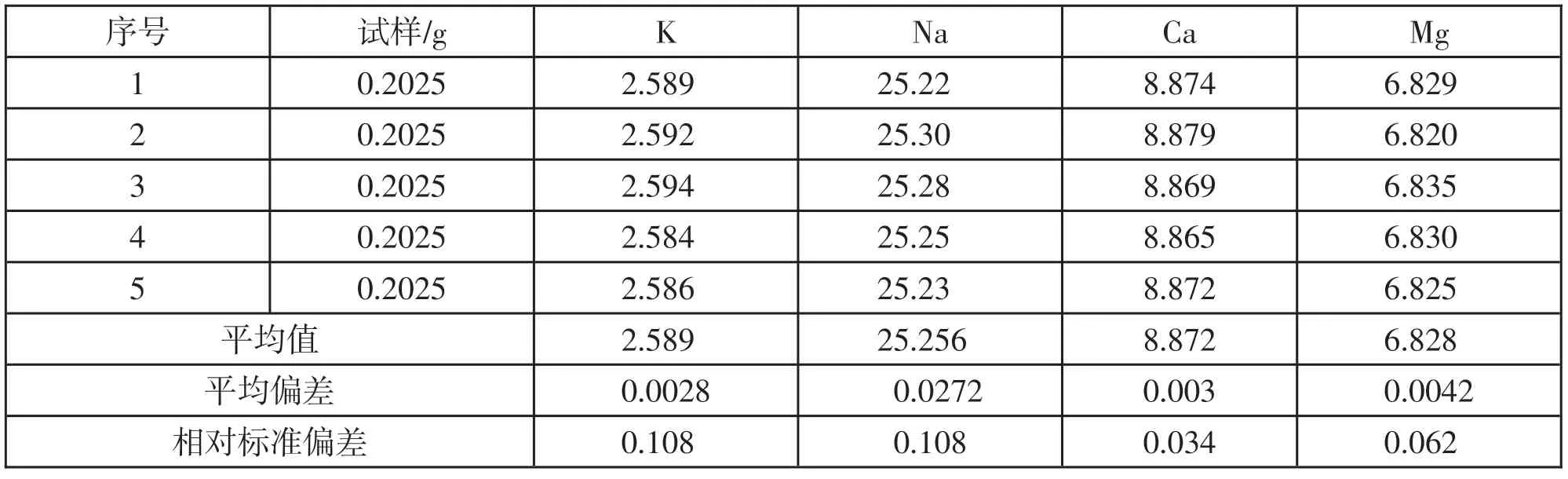
表2 精密度實驗
2.5 回收實驗
為驗證測量準確性,實驗進行加標回收試驗(見表3),K、Na、Ca、Mg4 種元素的回收率在93.3%~103%,回收率較好。
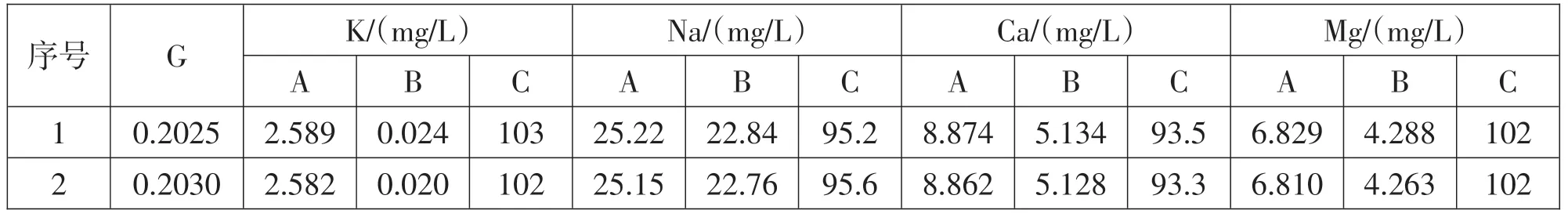
表3 加標回收實驗
2.6 樣品測量
隨機選擇3 個電解質生產試樣,按照實驗方法進行測量,實驗數據見表4。
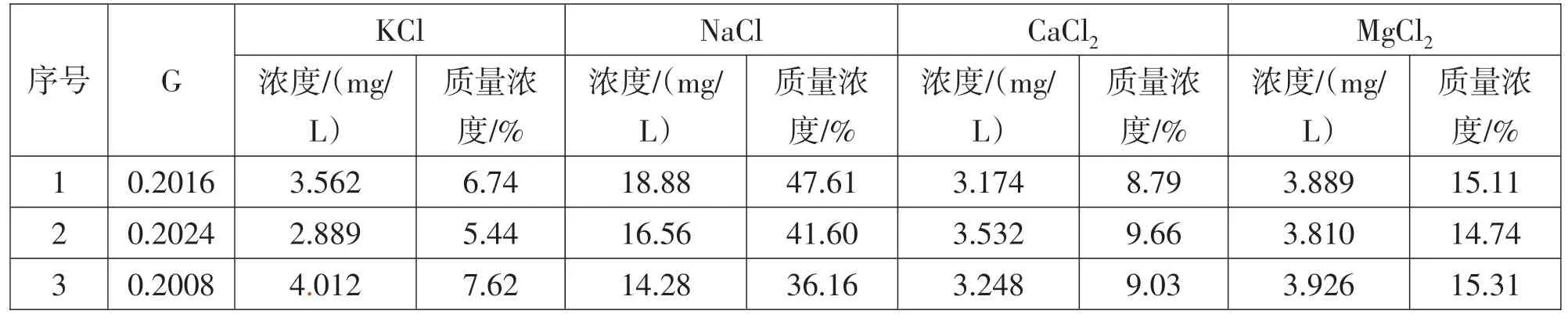
表4 樣品測量數據
3 結語
通過上述實驗建立的火焰原子吸收光譜法,同時測量鎂電解質中四元組分含量的方法,能實現電解質中四元組分同時測量,方法準確度好,能為生產質量控制提供快速、準確的分析數據。

