烏司他丁緩解子癇前期大鼠高血壓、蛋白尿和炎癥反應的實驗研究
董彥,崔劍,張麗,郎楠,王建波,于志強
子癇前期(pre-eclampsia,PE)是指妊娠20周以后新出現的血壓升高或原有的高血壓加重,常伴有蛋白尿和其他多器官、多系統癥狀的疾病[1]。PE的發病率為2%~8%,可引起子癇、腎功能不全、HELLP(hemolysis,elevated liver enzymes,low plateled syndrome)綜合征、胎兒生長受限、胎兒窘迫、胎盤早剝及胎死宮內等嚴重的并發癥,是孕產婦和圍產兒死亡的主要原因之一[2]。PE的病因和發病機制尚未完全闡明,其中子宮螺旋動脈滋養細胞重鑄障礙,導致胎盤缺血、缺氧并釋放多種胎盤因子進入母體血液循環,引起全身炎癥反應和血管內皮細胞損傷是PE的重要特征[3]。目前,PE缺乏有效的對因治療,只能對癥治療以減輕癥狀,選擇適當的時機終止妊娠。因此,針對PE的病因和發病機制,積極尋找治療或減緩PE的策略,對保證孕產婦和圍產兒的安全具有重要意義。
烏司他丁(Ulinastatin,UTI)是從人體尿液中提取的一種絲氨酸蛋白酶抑制劑,可抑制機體釋放腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)、白細胞介素(interleukin,IL)-6、IL-8等炎性介質,緩解機體的炎癥反應,改善血管內皮細胞功能,已有效用于重癥胰腺炎、膿毒血癥及感染性休克等炎性疾病的治療[4]。但UTI能否抑制PE中的炎癥反應,目前尚不清楚。本研究通過建立PE大鼠模型,研究UTI能否通過降低PE大鼠血漿和胎盤中炎性介質水平,減輕血管內皮細胞損傷,從而改善PE大鼠的癥狀,以期為PE的治療提供新的方向。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物 孕(gestation,G)12 d(G12)SD大鼠購自北京斯貝福生物科技有限公司,SPF級,實驗動物生產許可證號:SCXK(京)2016-0002。共56只,體質量230~270 g,分籠飼養于室溫22~24℃、標準清潔、空氣流通、晝夜交替循環的環境中,可自由進食、飲水。本研究中所有動物相關操作均遵循國際標準的動物實驗管理條例。
1.1.2 主要試劑與儀器 血漿TNF-α、IL-6、血管性假血友病因子(von Willebrand factor,vWF)、胎盤生長因子(placental growth factor,PLGF)酶聯免疫吸附試驗(ELISA)試劑盒均購自武漢伊萊瑞特生物科技有限公司。兔源TNF-α、vWF、PLGF抗體均購自武漢三鷹生物技術有限公司。兔源IL-6抗體購自北京博奧森生物技術有限公司。兔源β-Tubulin抗體、所有兔源二抗、磷酸鹽緩沖液(PBS)、檸檬酸鈉抗原修復液、中性樹膠等均購自北京索萊寶生物科技有限公司。
1.2 研究方法
1.2.1 動物分組及PE模型的建立 隨機數字表法將56只大鼠隨機分為對照(C)組、PE組、PE+U1組、PE+U2組,每組14只。PE組大鼠分別于G13~G19腹腔注射左旋硝基精氨酸甲酯(L-NAME,上海博湖生物科技有限公司)200 mg·kg-1·d-1,建立PE模型,C組注射等量生理鹽水。PE+U1組和PE+U2組大鼠于G13~G19腹腔注射L-NAME 200 mg·kg-1·d-1,同時分別腹腔注射UTI 5 000和10 000 IU·kg-1·d-1,C組、PE組注射等量生理鹽水。
1.2.2 孕鼠血壓和24 h尿蛋白測定 4組大鼠均于G12、G13、G15、G17、G19采用大鼠尾套無創血壓儀測量尾動脈收縮壓(SBP)。測量前先把孕鼠置于預熱箱內預熱至38~40℃,待其安靜后測量。每只大鼠測量3次,取平均值。分別于G12和G19用標準代謝籠收集24 h尿液,以考馬斯亮藍染色(上海瑞番生物科技有限公司)測定24 h尿蛋白水平。
1.2.3 取材 所有大鼠于G20時在七氟醚麻醉下行剖宮產術,獲取胎盤組織,同時于腹主動脈采集血液標本。
1.2.4 血漿中TNF-α、IL-6、vWF、PLGF水平測定 取血標本6 mL置入含EDTA抗凝劑的試管中,充分混勻后3 000 r/min離心20 min,取上清液,采用ELISA法測定血漿中TNF-α、IL-6、vWF、PLGF水平。所有大鼠中,C、PE+U1和PE+U2組中均有7例,PE組中有6例血標本量達到6 mL,其余大鼠血標本量未達到實驗要求。
1.2.5 Western blot檢測胎盤中TNF-α、PLGF、IL-6、vWF蛋白表達 將胎盤組織放入EP管內,加入RIPA裂解液,組織剪碎后以超聲處理。超聲處理后的組織液置于4℃冰箱中靜置30 min,4℃、16 000 r/min離心10 min,取上清液,BCA法蛋白定量。十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDSPAGE)后進行轉膜,加入TNF-α、PLGF、IL-6、vWF一抗(均為1∶1 000稀釋)。4℃孵育過夜,漂洗后加入二抗(1∶5 000稀釋)室溫孵育1 h,將化學發光試劑A液與B液等量混合,孵育PVDF膜1 min,于凝膠成像儀中成像。使用Image J軟件進行灰度分析。通過計算目的條帶與內參蛋白β-Tubulin的比值,計算目的蛋白TNF-α、PLGF、IL-6、vWF的相對表達量,分析各實驗組目的蛋白的表達變化。
1.3 統計學方法 采用GraphPad Prism 9軟件進行數據分析,正態分布資料以均數±標準差(±s)表示,多組間比較采用單因素方差分析,各組間的多重比較采用Bonferroni檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 UTI對PE大鼠血壓和24 h尿蛋白的影響 56只孕鼠中有4只注射L-NAME后出現流產,其中PE組2只,PE+U1和PE+U2組各1只。G12時,各組大鼠SBP和尿蛋白水平差異均無統計學意義(P>0.05);G13~G19時,PE、PE+U1和PE+U2組SBP均較C組升高,PE+U1和PE+U2組SBP較PE組降低,G19時PE+U2組降低SBP的作用更明顯(P<0.05)。G19時,PE、PE+U1和PE+U2組尿蛋白水平均較C組升高,PE+U1和PE+U2組尿蛋白水平較PE組降低,PE+U2組降低尿蛋白的作用更明顯(P<0.05)。見表1、2。
Tab.1 Comparison of SBP of rats during different gestation between the four groups表1 各組大鼠不同孕期SBP水平比較(mmHg,±s)
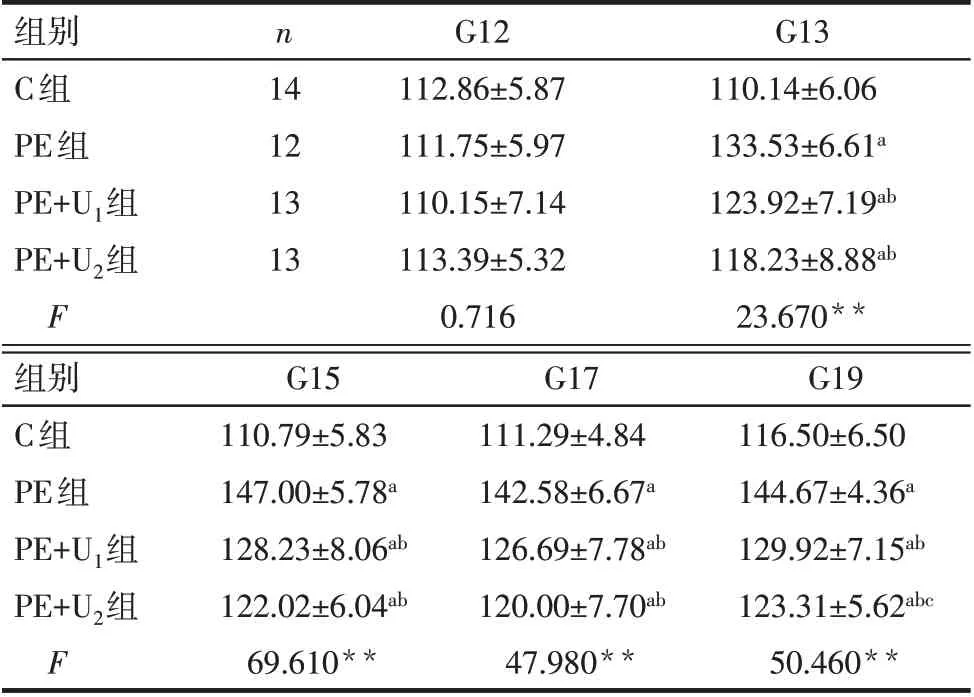
Tab.1 Comparison of SBP of rats during different gestation between the four groups表1 各組大鼠不同孕期SBP水平比較(mmHg,±s)
**P<0.01;1 mmHg=0.133 kPa;a與C組比較,b與PE組比較,c與PE+U1組比較,P<0.05。
組別C組PE組PE+U1組PE+U2組F n 14 12 13 13 G12 112.86±5.87 111.75±5.97 110.15±7.14 113.39±5.32 0.716 G13 110.14±6.06 133.53±6.61a 123.92±7.19ab 118.23±8.88ab 23.670**組別C組PE組PE+U1組PE+U2組F G15 110.79±5.83 147.00±5.78a 128.23±8.06ab 122.02±6.04ab 69.610**G17 111.29±4.84 142.58±6.67a 126.69±7.78ab 120.00±7.70ab 47.980**G19 116.50±6.50 144.67±4.36a 129.92±7.15ab 123.31±5.62abc 50.460**
Tab.2 Comparison of 24-hour urinary protein levels of rats on G12 and G19 between the four groups表2 各組大鼠G12和G20 24 h尿蛋白水平的比較(mg,±s)
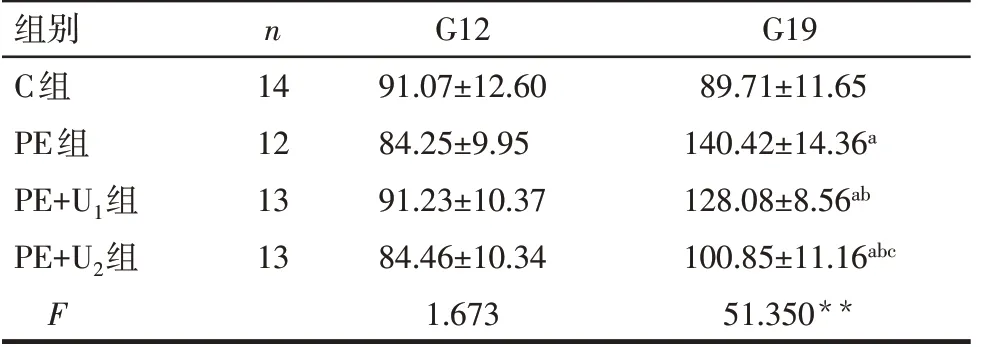
Tab.2 Comparison of 24-hour urinary protein levels of rats on G12 and G19 between the four groups表2 各組大鼠G12和G20 24 h尿蛋白水平的比較(mg,±s)
**P<0.01;a與C組比較,b與PE組比較,c與PE+U1組比較,P<0.05。
組別C組PE組PE+U1組PE+U2組F n 14 12 13 13 G12 91.07±12.60 84.25±9.95 91.23±10.37 84.46±10.34 1.673 G19 89.71±11.65 140.42±14.36a 128.08±8.56ab 100.85±11.16abc 51.350**
2.2 UTI對PE大鼠炎癥指標的影響 G20時,與C組相比,PE組、PE+U1組血漿和胎盤中TNF-α、IL-6水平升高,PE+U2組僅胎盤中TNF-α水平升高(P<0.05);與PE組相比,PE+U1、PE+U2組血漿和胎盤中TNF-α、IL-6水平均降低(P<0.05);與PE+U1組相比,PE+U2組血漿和胎盤中TNF-α水平、胎盤中IL-6水平降低(P<0.05),但血漿中IL-6水平差異無統計學意義(P>0.05),見表3,圖1。
2.3 UTI對血管內皮損傷指標的影響 G20時,與C組相比,PE組、PE+U1組血漿和胎盤中PLGF水平降低、vWF水平升高,PE+U2組僅血漿和胎盤中vWF水平升高(P<0.05);與PE組相比,PE+U1、PE+U2組血漿和胎盤中PLGF水平升高,vWF水平降低(P<0.05);與PE+U1組相比,PE+U2組血漿和胎盤中vWF水平降低(P<0.05),但血漿和胎盤中PLGF水平差異無統計學意義(P>0.05);見表4,圖1。
Tab.3 Comparison of inflammatory cytokines levels in plasma and placenta between the four groups表3 各組大鼠血漿和胎盤中炎性因子水平的比較(±s)
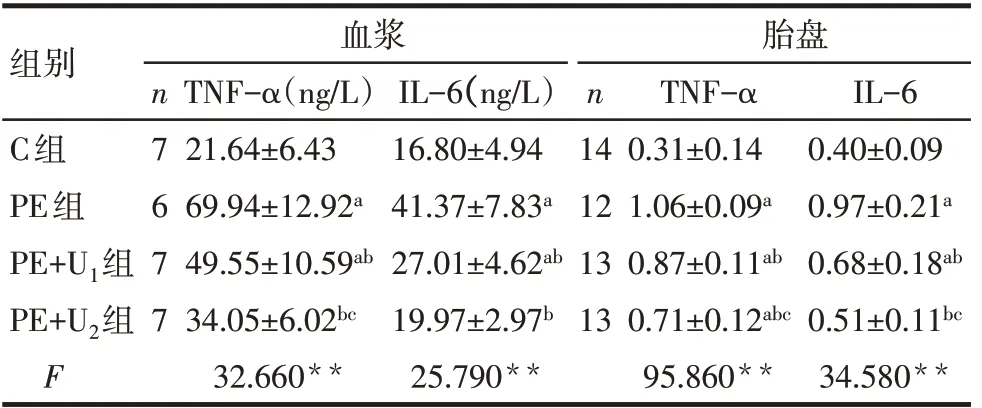
Tab.3 Comparison of inflammatory cytokines levels in plasma and placenta between the four groups表3 各組大鼠血漿和胎盤中炎性因子水平的比較(±s)
**P<0.01;a與C組比較,b與PE組比較,c與PE+U1組比較,P<0.05。
組別C組PE組PE+U1組PE+U2組F n7 6 7 7血漿TNF-α(ng/L)21.64±6.43 69.94±12.92a 49.55±10.59ab 34.05±6.02bc 32.660**IL-6(ng/L)16.80±4.94 41.37±7.83a 27.01±4.62ab 19.97±2.97b 25.790**n 14 12 13 13胎盤TNF-α 0.31±0.14 1.06±0.09a 0.87±0.11ab 0.71±0.12abc 95.860**IL-6 0.40±0.09 0.97±0.21a 0.68±0.18ab 0.51±0.11bc 34.580**
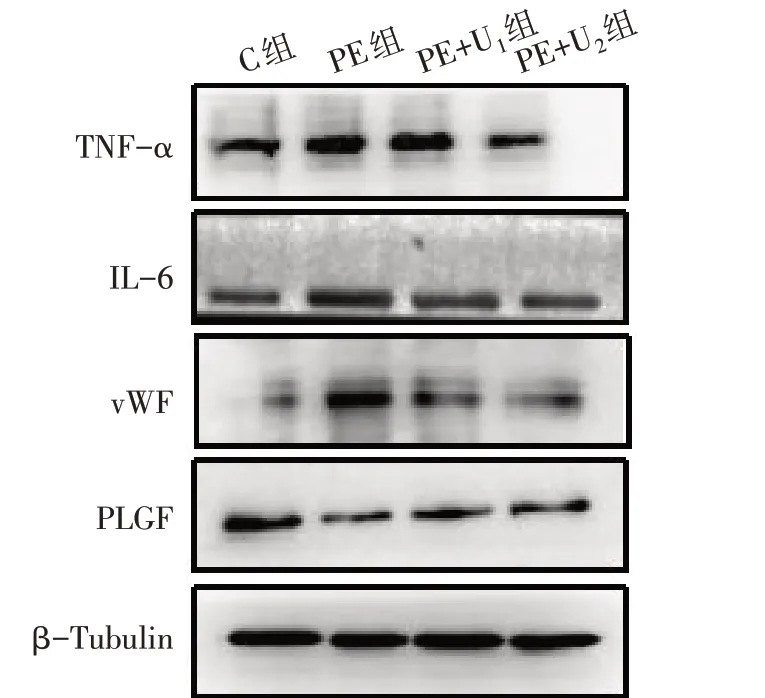
Fig.1 Expressions of TNF-α,IL-6,vWF and PLGF proteins in placental tissue in the four groups圖1 4組大鼠胎盤組織中TNF-α、IL-6、vWF、PLGF的蛋白表達
Tab.4 Comparison of vascular endothelial injury marker levels in plasma and placenta between the four groups表4 各組大鼠血漿和胎盤中血管內皮損傷指標比較(±s)
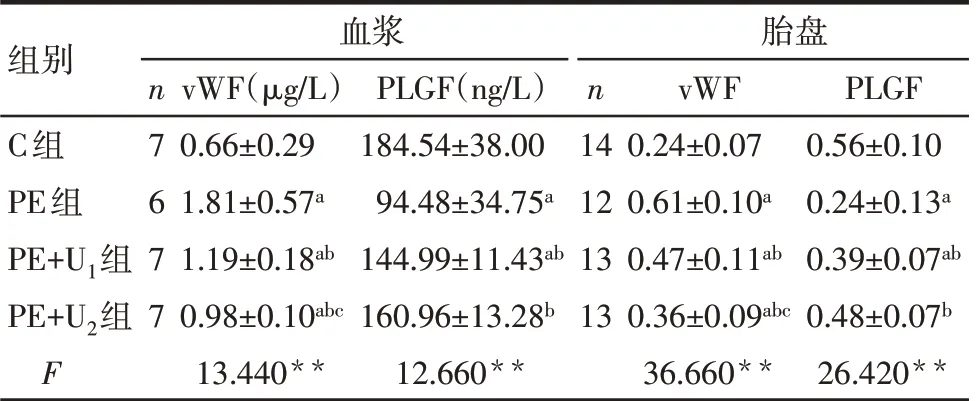
Tab.4 Comparison of vascular endothelial injury marker levels in plasma and placenta between the four groups表4 各組大鼠血漿和胎盤中血管內皮損傷指標比較(±s)
**P<0.01;a與C組比較,b與PE組比較,c與PE+U1組比較,P<0.05。
組別C組PE組PE+U1組PE+U2組F n7 6 7 7血漿vWF(μg/L)0.66±0.29 1.81±0.57a 1.19±0.18ab 0.98±0.10abc 13.440**PLGF(ng/L)184.54±38.00 94.48±34.75a 144.99±11.43ab 160.96±13.28b 12.660**n 14 12 13 13胎盤vWF 0.24±0.07 0.61±0.10a 0.47±0.11ab 0.36±0.09abc 36.660**PLGF 0.56±0.10 0.24±0.13a 0.39±0.07ab 0.48±0.07b 26.420**
3 討論
3.1 PE的發病與全身和胎盤的炎癥反應有關 PE是妊娠期特有的疾病,其發病機制與全身和胎盤的炎癥反應及胎盤血管的形成異常有關。全球每年約有76 000例產婦和500 000例胎兒及新生兒死于PE相關疾病[5]。研究表明,與正常妊娠或非孕期的育齡女性相比,PE患者體內炎性因子水平增加,有血管內皮功能障礙[6]。PE患者血漿中TNF-α和IL-6水平明顯高于正常妊娠女性,且兩者的血漿水平被認為是評價PE患者預后的指標之一[7]。因此,TNFα和IL-6在PE的發生、發展過程中發揮了重要作用。
炎癥存在時TNF-α主要由巨噬細胞和單核細胞產生,并進一步增加IL-6等其他細胞因子和趨化因子的生成[8]。體內和胎盤中TNF-α、IL-6等炎性因子增加后,引起氧化應激反應,降低一氧化氮生物利用度,導致細小血管收縮和PE的發生;過多的TNF-α增加血管通透性,特異性地抑制滋養層細胞遷移和整合到內皮細胞中,促進淋巴細胞活化和成纖維細胞增殖,進一步引起血管痙攣,影響胎盤血供[9]。因此,抑制炎性介質的產生可能有益于PE的治療。
3.2 UTI抑制血漿及胎盤中的炎癥反應 UTI是一種廣譜的絲氨酸蛋白酶抑制劑,存在于尿液、血漿以及所有主要器官。UTI可明顯抑制感染性動物模型中TNF-α和IL-6的分泌,抑制蛋白水解酶活性和炎性細胞因子的釋放,清除氧自由基,穩定溶酶體膜[10]。臨床研究發現,UTI可通過下調TNF-α和IL-6的表達,緩解膿毒癥導致的急性肺損傷[11]。體外研究發現,在人臍靜脈血管內皮細胞中加入TNF-α或重度PE患者血清后,血管內皮細胞凋亡數量增多,體外培養體系中加入UTI可降低血管內皮細胞凋亡率,表明UTI可阻斷炎性因子對PE血管內皮細胞的損傷[12]。
本研究發現,UTI可緩解PE大鼠的高血壓、降低尿蛋白水平、改善大鼠受損的腎功能,并降低血漿及胎盤vWF水平。其原因可能為:UTI降低PE大鼠血漿及胎盤中炎性介質(TNF-α、IL-6)水平,抑制胎盤的炎癥反應;降低炎性介質引起的血管內皮細胞高通透性,保護血管內皮的完整性,緩解血管痙攣和全身炎癥性血管內皮水腫。UTI緩解PE的可能機制:UTI通過抑制蛋白水解酶、絲裂原活化蛋白激酶(MAPKs)活性,減少巨噬細胞釋放TNF-α、IL-6等炎性介質;通過抑制核轉錄因子活性減少TNF-α和IL-6等炎性介質生成;通過RhoA/ROCK信號通路減輕TNF-α引起的血管內皮細胞損傷[13]。
3.3 UTI減輕PE胎盤血管內皮的損傷 PLGF是血管內皮生長因子家族的成員之一,在血管生成中有促進胎盤血管發育和成熟的作用[14]。重度PE患者血清和胎盤中的PLGF水平明顯低于輕度PE患者和血壓正常的女性;妊娠晚期母體PLGF水平較低時,妊娠期高血壓、圍產期不良結局以及胎兒生長受限的發生率均增加[15]。vWF是由內皮細胞合成并分泌的一種具有黏附功能的糖蛋白,在正常孕婦體內輕度升高,在重度PE患者體內明顯升高。當血管內皮細胞受損時,vWF釋放到血液中,故血漿vWF水平升高可作為反映血管內皮細胞受損的指標[16]。本研究發現UTI能降低PE大鼠血漿及胎盤vWF水平、提升PLGF水平,故推測UTI可減輕血管內皮的損傷,改善胎盤血管的發育和胎盤的供血,其機制可能與UTI抑制血漿和胎盤中的炎癥反應有關。同時,本研究發現,10 000 IU·kg-1·d-1UTI在降低血漿和胎盤中炎性介質水平、抑制vWF釋放、緩解蛋白尿等作用方面優于5 000 IU·kg-1·d-1。然而,在緩解高血壓時2種劑量差別微弱,僅在孕晚期(G19)時有差異。
3.4 UTI用于PE的應用前景 國內外關于UTI用于產科患者的研究較少,陰道內注射UTI可預防宮頸縮短合并下生殖道炎癥引發的早產[17]。不伴有妊娠期高血壓的產婦,圍術期預防性靜脈滴注UTI 5 000 IU·kg-1·d-1可改善剖宮產術中的高凝血狀態,有助于預防術后深靜脈血栓形成[18]。本課題組既往研究發現,UTI可降低重度PE剖宮產術患者血漿vWF水平,推測UTI可減輕患者血管內皮損傷,有利于PE的治療[19]。然而,該研究僅限于胎兒娩出后(斷臍后)單次用藥,缺乏妊娠期間重復用藥的觀察,無法系統性地研究UTI的作用機制及評價治療效果。人類PE的發病機制是復雜的、多因素的,不同于注射L-NAME建立的PE大鼠模型。因此,UTI能否安全有效地用于預防和治療人類PE,仍需進一步審慎地研究。

