陰陽雙補方治療骨轉移癌痛作用機制的網絡藥理學研究*
楊夢霞 毛 昀 蘆殿榮 朱世杰 周 磊
(1.北京中醫藥大學,北京 100029;2.中國中醫科學院望京醫院,北京 100102;3.湖南中醫藥大學第二附屬醫院,湖南 長沙 410005)
疼痛是骨轉移癌患者常見并發癥,發生率為40%~70%,給晚期腫瘤患者的生存質量帶來了嚴重不良影響[1]。盡管現代醫學上各種癌痛管理指南不斷出現,但仍有50%的患者沒有得到足夠的疼痛緩解[2],45%的晚期患者會經歷中到重度的疼痛[3],并且癌痛發生率在過去40年中并未降低[4]。近年來,中醫藥工作者在長期臨床實踐中發現,中醫作為一種癌痛輔助治療的方法,在臨床上取得了一定療效。
歷代中醫典籍中雖沒有癌痛的明確記載,但根據其臨床表現,多將其歸于“痛證”范疇。《金匱要略·臟腑經絡先后病脈證并治》中有“病人語聲寂寂然喜驚呼者,骨節間病”,其描述與骨轉移癌痛相似;此外亦有“骨節疼痛”“骨痛肉枯”等可與骨轉移癌痛相聯系。腎主骨生髓,故其病位在腎,腎精不充、骨髓失養、癌毒乘虛入骨膠結不去導致骨腫瘤形成是骨轉移癌痛形成的前提,而后癌毒盤踞,可致筋骨經絡失養或肌肉、骨骼等受壓,進而發生疼痛。故在臨床實踐中,中醫治療多以扶正祛邪為主。本研究團隊通過總結全國名老中醫李佩文教授臨床用藥經驗發現,歸腎經方“陰陽雙補方”不僅對骨轉移有效,在癌痛治療方面也有著較好的臨床療效,前者作用機制已在團隊前期研究中闡明[5],而后者作用機制尚未清楚。因此本研究擬從網絡藥理學角度對“陰陽雙補方”治療癌痛的作用機制進行初步探討,以便為今后癌痛臨床治療提供更多參考依據。
1 材料與方法
1.1 陰陽雙補方主要化合物篩選 在中藥數據庫TCMSP中,檢索陰陽雙補方所有化合物,保留OB≥30%且DL≥0.18的成分;當某些藥物化合物在TCMSP中檢索不到時,使用TCMID及TCM Database@Taiwan數據庫進行補充。
1.2 陰陽雙補方藥物靶點預測 使用化合物信息數據庫PubChem檢索陰陽雙補方主要化合物所對應的SMILES化學結構,并在Swiss Target Prediction數據庫中根據化學結構相似性,保留相似度高的靶點;最后使用Cytoscape3.8.2中的cytoHubba插件,篩選出藥物Hub靶點并進行可視化。
1.3 骨轉移癌疾病基因篩選 使用GeneCards疾病數據庫分別查詢骨轉移及癌痛基因,保留“Score≥15”的疾病基因。
1.4 陰陽雙補方潛在治療靶點預測 通過將“陰陽雙補方”、骨轉移及癌痛基因進行韋恩映射分析,篩選出潛在治療靶點;使用STRING11.5數據庫分析潛在治療靶點功能關聯情況并可視化。
1.5 “中藥-化合物-潛在治療靶點”網絡圖繪制 分別構建“中藥-化合物-潛在治療靶點”關系表和節點屬性表,并將其導入Cytoscape3.8.2中,繪制多層次相互作用的“中藥-化合物-潛在治療靶點”網絡圖。
1.6 潛在治療靶點功能分析 在DAVID數據庫中對潛在治療靶點進行GO富集分析及KEGG通路富集分析(FDR < 0.05)。
2 結果
2.1 陰陽雙補方主要化合物 在中藥數據庫中檢索到88個“陰陽雙補方”主要化合物,見表1(根據每味藥OB值,僅列出排名前5的化合物)。

表1 陰陽雙補方主要有效成分
2.2 陰陽雙補方藥物靶點 檢索到陰陽雙補方藥物靶點有673個;將這些靶點導入Cytoscape3.8.2中,發現這些靶點網絡由657個節點、11 253條邊組成,同時使用cytoHubba插件篩選出排名前50的藥物靶點,見圖1。

圖1 陰陽雙補方Hub靶點
2.3 陰陽雙補方潛在治療靶點 在疾病基因數據庫中檢索到483個骨轉移癌疾病基因、858個癌痛基因,將兩種疾病基因與673個藥物靶點進行映射,得到94個交集基因即潛在治療靶點,見圖2。在STRING11.5數據庫中構建潛在治療靶點PPI網絡,見圖3A;并在Cytoscape3.8.2中繪制“中藥-化合物-潛在治療靶點”網絡圖,見圖3B;同時進行拓撲結構分析,根據節點拓撲指標Degree值,取排名前10的靶點繪制條形圖,見圖3C。
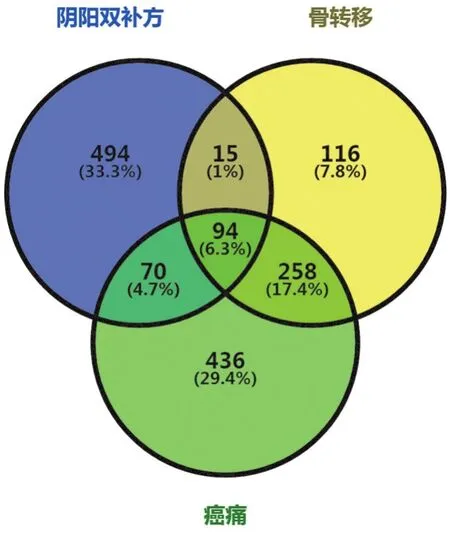
圖2 陰陽雙補方靶點、骨轉移基因和癌痛基因的韋恩圖
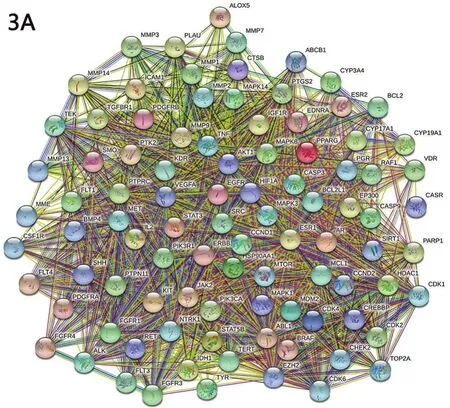
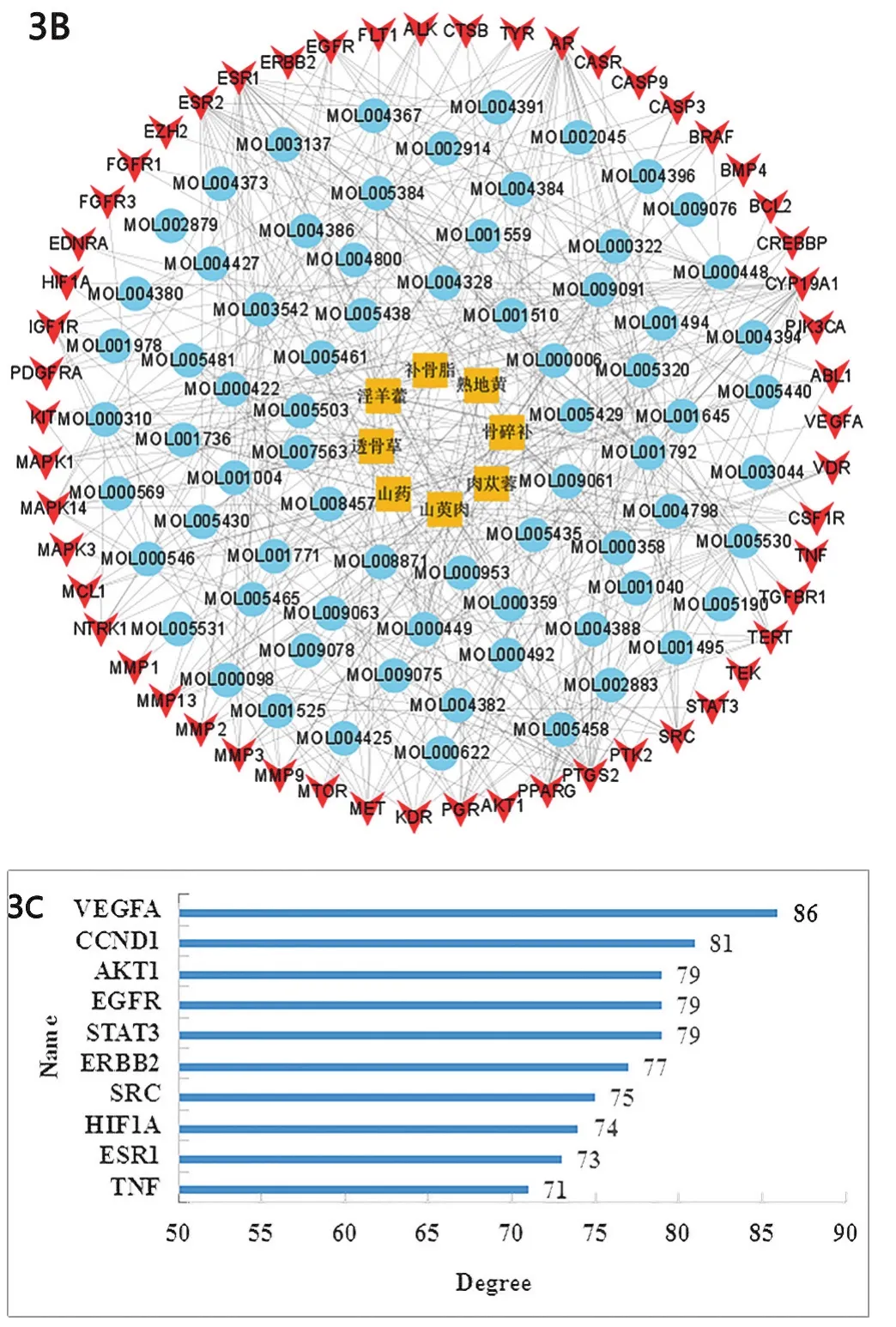
圖3 陰陽雙補方治療癌痛潛在靶點的PPI網絡(3A)、“中藥-化合物-潛在治療靶點”網絡圖(3B)及關鍵靶點(3C)
2.4 陰陽雙補方治療骨轉移癌痛潛在靶點的GO功能分析 根據“FDR<0.05”,得到100個符合條件的條目(BP 57個、CC 12個、MF 31個),主要涉及磷脂酰肌醇磷酸化、MAPK級聯、質膜、偽足及絲氨酸、蘇氨酸等各種激酶活性等,取各項排名前10的條目繪制氣泡圖,見圖4。
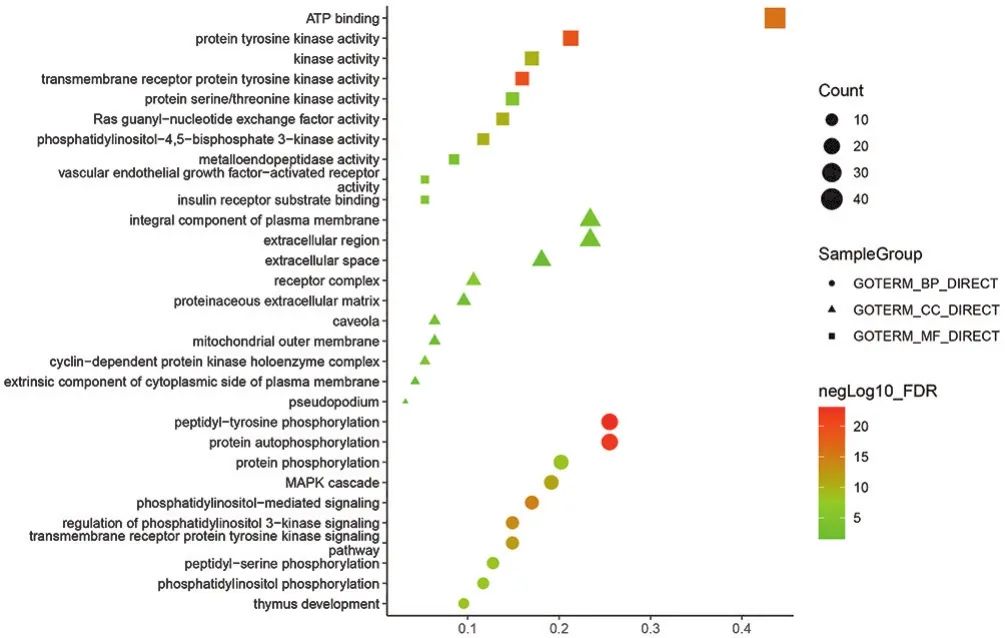
圖4 陰陽雙補方治療癌痛潛在靶點的GO功能富集分析
2.5 陰陽雙補方治療骨轉移癌痛潛在靶點的KEGG功能分析 根據“FDR<0.05”,得到70條符合條件的通路,主要包含PI3K-Akt、FoxO、ErbB及VEGF信號通路等,取排名前30的通路繪制氣泡圖,見圖5。
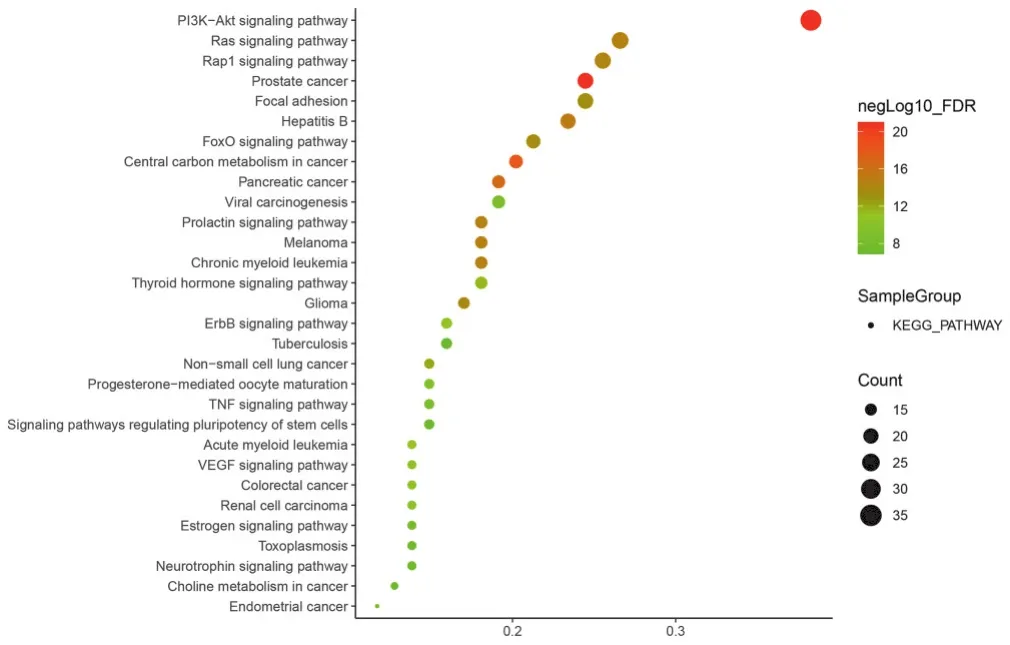
圖5 陰陽雙補方治療癌痛潛在靶點的KEGG通路富集分析
3 討 論
現代醫學認為骨轉移癌痛的機制比較復雜,它包括炎癥和神經病變等多個過程,涉及腫瘤微環境、骨細胞、激活的炎癥細胞和骨神經支配神經元之間的各種相互作用[6]。中醫學將癌痛的病機概括為“不通則痛”和“不榮則痛”:前者屬實證疼痛,包含痰、瘀、寒、毒等;后者屬虛證疼痛,病機多為正虛、陽虛。在臨床實踐中發現晚期惡性腫瘤骨轉移患者多以正虛為本,故治療上當注重扶正。根據李佩文教授經驗化裁組成的陰陽雙補方中以補骨脂、骨碎補補腎助陽,肉蓯蓉補腎溫陽,益精血,此外,骨碎補還可止痛,3藥相輔相成,補腎陽止痛,共為君藥;熟地黃滋補腎精,山茱萸肉、山藥養肝補脾,俱為臣藥;淫羊藿、透骨草益腎強骨,透骨草還兼有舒筋通絡、活血止痛之效,兩藥合用,助君藥溫壯腎陽止痛之功。諸藥合用,補腎之中兼顧養肝益脾,使腎精得充而虛損易復;溫陽之中參以滋陰填精,則陽得陰助而生化無窮,共奏補腎助陽、益精止痛之效。
本研究通過構建“中藥-化合物-潛在治療靶點”網絡圖發現,槲皮素、山柰酚及木樨草素等為其核心化合物。其中槲皮素不僅可通過調節RANKL/RANK/OPG信號通路和炎癥反應來抑制破骨細胞活化,減少骨癌疼痛模型中的骨質破壞,也可以通過調節PAR2/TRPV1信號通路來抑制骨癌疼痛中的外周/中樞致敏[7]。山柰酚可通過抑制白細胞介素-6(IL-6)、腫瘤壞死因子-α(TNF-α)等炎癥因子的聚集,降低對機械刺激和熱刺激的敏感性,從而有效緩解疼痛,這種鎮痛作用可能與MrgprD含量降低有關[8]。木樨草素可以通過抑制Lewis肺癌誘導的骨癌痛中的p38 MAPK磷酸化來抑制星形膠質細胞和小膠質細胞的活化以及NLRP3炎癥小體,進而緩解骨痛[9]。
通過Cytoscape軟件構建陰陽雙補方治療骨轉移癌痛的互作網絡圖,發現VEGFA、STAT3、ErbB2及Akt1等為其關鍵靶點。其中VEGFA可通過誘導感覺神經元軸突生長和存活作用于感覺神經元,其受體VEGFR2在有髓A纖維和無髓C纖維感覺神經元上都有表達[10],且在外周和中樞感覺神經系統中,當VEGFA外顯子8可變剪接產生的VEGF-Axxxa增加、VEGFAxxxb表達降低時,VEGFR2即可被激活[11-12]。有研究認為VEGF-Axxxa可使C纖維機械敏感的傷害感受器敏感,導致疼痛信號的傳遞增加和機械性異常性疼痛的發展[11]。STAT3磷酸化在骨癌疼痛中有重要作用,其抑制劑DR-1-55可延遲自發和誘導傷害性行為的發生和嚴重程度,降低促炎細胞因子IL-6和白細胞介素-1β(IL-1β)的水平,因此認為靶向磷酸化STAT3可能是治療癌痛的一種可行手段[13]。ErbB2可被高水平的NRG1激活,促進脊髓中小膠質細胞的生長,這可能導致損傷后的神經性疼痛[14-15]。研究認為當鞘內施用外源性NRG1時可上調ErbB2、p-ErbB2 mRNA和蛋白質水平、促進Akt1的激活,進而引發熱痛覺過敏和機械異常性疼痛[16]。
通過富集分析發現,陰陽雙補方治療骨轉移癌痛的作用機制主要與抗炎、鎮痛、調節神經系統等有關。PI3K-Akt信號轉導通路是體內重要的信號通路之一,該通路激活后可以誘導和維持不同程度的痛敏反應。有研究發現,當向乳腺癌骨轉移疼痛模型大鼠鞘內注射Akt抑制劑GSK690693后,可降低脊髓中Akt磷酸化水平并抑制PI3K/Akt信號通路,進而緩解疼痛[17]。研究認為FoxO信號通路可以調節與疼痛或神經系統有關的凋亡活性[18]。VEGF可編碼基因VEGF-A、PLGF-2和VEGF-B,這些基因可以通過激活感覺神經元中的VEGFR1來增強疼痛敏感性,而在同一模型中,阻斷VEGFR1可以減輕癌痛[19];在疼痛模型中,周圍神經系統和脊髓中mTOR活化水平可上調[20],當鞘內注射mTOR抑制劑雷帕霉素時,可減輕神經性疼痛[21];同時,發現mTOR能夠通過使HIF失調來調節VEGF信號通路[22],故認為抑制mTOR/VEGF信號通路可以減輕神經性疼痛[23]。
綜上所述,本研究首次運用中藥網絡藥理學方法探索陰陽雙補方治療骨轉移癌痛的多層次復雜網絡結構,發現“陰陽雙補方”可能通過槲皮素、山柰酚及木樨草素等核心化合物作用于VEGFA、STAT3、ErbB2及Akt1等關鍵靶點,進而調控PI3K-Akt、FoxO、VEGF及mTOR等信號通路,從而發揮抗炎、鎮痛、調節神經系統等作用,對臨床應用提供了一定的參考依據,也為其分子機制研究提供了新的思路。

