芪參顆粒對血管緊張素Ⅱ誘導的大鼠心肌成纖維細胞基質代謝的影響
譚桂蘭 彭婧嬪 劉國維 鐘李璐 袁 敏
(深圳市龍華區人民醫院中醫科,深圳,518000)
心肌纖維化(Myocardial Fibrosis,MF)是全因死亡及心源性猝死發生的獨立危險因素,也是冠心病、心肌梗死、心力衰竭等多種心血管疾病發展到終末期的共同病理改變[1-2]。心肌成纖維細胞(Cardiac Fibroblasts,CFs)是MF的主要效應細胞,抑制CFs的增殖并減少膠原的沉積是預防和逆轉細胞外基質(Extracellular Matrix,ECM)重構的關鍵環節[3]。基質金屬蛋白酶(Matrix Metalloproteinases,MMPs)作為降解ECM成分的重要酶系[4],其基質金屬蛋白酶組織抑制因子-1(Tissue Inhibitor of Metalloproteinases-1,TIMP-1)可抑制MMPs的活性,是其特異性抑制劑[19]。二者比例失衡可使ECM代謝紊亂,促進心肌纖維化進程[5]。大量研究證實,芪參顆粒可改善MF[6-7],但其在細胞外基質代謝方面的作用機制尚不明確。基于此,本研究以大鼠原代CFs為研究對象,觀察芪參顆粒對血管緊張素Ⅱ(Angiotensin Ⅱ,AngⅡ)作用下CFs基質代謝的影響,同時分析其抗MF的作用機制。
1 材料與方法
1.1 材料
1.1.1 動物 選取30只健康3周齡無特定病原體(Specific Pathogen Free,SPF)級SD大鼠,飼養于SPF級動物房,飼養溫度保持在(25±2)℃,相對濕度保持在(40±2)%,12 h光照,12 h黑暗,自由給食水,總共進行適應性飼養7 d,選購自北京維通利華實驗動物技術有限公司,許可證號:SCXK(京)2016-0006。本研究經我院動物倫理委員會批準(倫理審批號:L201601009)。
1.1.2 藥物 芪參顆粒(北京同仁堂制藥有限公司,生產批號:040910)由黃芪30 g、玄參10 g、丹參15 g、黑順片9 g、金銀花10 g、炙甘草6 g等中藥組成。
1.1.3 試劑與儀器 胎牛血清(Fetal Bovine Serum,FBS)-(Gibco公司,美國,貨號:16140-089),波形蛋白(Vimentin)抗體(Santa Cruz公司,美國,貨號:sc-5565),α-平滑肌肌動蛋白(Smooth Muscle Actin,α-SMA)抗體(Abcam公司,美國,貨號:ab124964),AngⅡ(sigma公司,美國,貨號:A9525),Trizol核酸提取液(Ambion公司,美國,貨號:RK30129),SYBR Select Master Mix(美國Thermo公司,貨號:CFX 2X5ML)。超凈工作臺(蘇州凈化,型號:Sff-CJ-lFD),二氧化碳培養箱(德國Heraeus,型號:BB16UV/BB5060UV),實時熒光定量PCR儀(Applied-Biosystem公司,美國,型號:ABI Prism 7500),紫外分光光度計(Pharmacia Biotech公司,美國,型號:UV-2000),光學顯微鏡(Olympus公司,日本,型號:BB16UV/BB5060UV CKX31)。
1.2 方法
1.2.1 CFs的培養和鑒定 在無菌條件下取出SD大鼠心室,用預冷磷酸鹽緩沖液(Phosphate-Buffered Saline,PBS)沖洗,切成糊狀,用0.25%胰蛋白酶消化液反復消化(37 ℃恒溫振蕩10~15 min),至組織塊消失,消化后收集上清液,加入杜爾貝科改良伊格爾培養基(Dulbecco′s modified Eagle Medium,DMEM)(含20%血清)混勻后離心,取沉淀用后DMEM培養基(含10%胎牛血清)混勻制成單細胞懸液。接種在培養瓶中,然后在孵育箱中培養。差速貼壁法分離心肌細胞,待CFs生長接近融合時獲得CFs,用胰蛋白酶消化傳代。實驗用3~4代CFs,鏡下觀察CFs形態,采用免疫法鑒定CFs。
1.2.2 分組與干預方法 調節細胞濃度至5×104個細胞/mL,每孔200 μL接種于96孔培養板上。細胞生長至70%~60%后,更換無血清DMEM同步化24 h。將細胞分為5組:空白對照加入2% FBS-DMEM、二甲基亞砜(Dimethyl Sulfoxide,DMSO)對照組加入0.1% DMSO、AngⅡ組加入10-7mol/L AngⅡ、卡托普利組加入10-7mol/L AngⅡ+22 mg/L卡托普利,芪參顆粒組加入10-7mol/L AngⅡ+1 mg/mL芪參顆粒,處理48 h。進行后續實驗。
1.2.3 CCK-8法檢測細胞增殖活力 按照說明書操作,每孔加入CCK-8溶液10 μL孵育2 h,于酶標儀450 nm處測定光密度(Optical Density,OD)值。
1.2.4 Ⅰ型膠原蛋白(CollagenⅠ,Col Ⅰ)、Ⅲ型膠原蛋白(CollagenⅢ,Col Ⅲ)、基質金屬蛋白酶(Matrix Metallopeptidase MMP)-2、MMP-9、基質金屬蛋白酶組織抑制因子(Tissue Inhibitor of Metalloproteinases,TIMP)-1和TIMP-2含量的檢測 取上清按試劑盒說明書操作,采用酶聯免疫吸附試驗檢測,于酶標儀450 nm處測定每個孔的OD值,根據標準曲線計算樣品濃度。
1.2.5 Col Ⅰ和Col Ⅲ mRNA的表達 采用實時熒光定量PCR法檢測Col Ⅰ和Col Ⅲ mRNA的表達,用Trizol提取細胞總RNA,采用酶標儀對RNA的純度和濃度進行測定。再根據反轉錄試劑盒說明書對提取的RNA進行反轉。以cDNA為模板,以GAPDH為內參。引物序列為GAPDH,上游:5′-AGTTCAACGGCACAGTCAAG-3′,下游:5′-TACTCAGCACCAGCATCACC-3′;Col Ⅰ,上游:5′-TGACCAGCCTCGCTCACAG-3′,下游:5′-ATCCAGTAGTAATCGCTCTTCCA-3′;Col Ⅲ,上游:5′-CGGAGGAATGGGTGGCTATC-3′,下游:5′-CAGTCCACGCTCTCCAGGTC-3′。PCR工作條件:預變性95 ℃,10 min,變性95 ℃,30 s,退火55 ℃,30 s,延伸72 ℃,20 s,循環40個。所得CT值按照2-△△Ct的方法均一化后行統計分析。
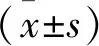
2 結果
2.1 CFs的鑒定 CFs細胞鏡下狀態較好,生長迅速,達融合狀態僅需要1~2 d,大部分呈梭形或三角形,無自發性搏動。免疫染色顯示細胞波形蛋白染色陽性,α-SMA染色陰性,表明細胞純度>95%。
2.2 各組CFs增殖比較 各組OD值比較差異有統計學意義(P<0.01),空白對照組與DMSO對照組OD值比較差異無統計學意義(P>0.05);與空白對照組比較,AngⅡ組CFs OD值明顯升高(P<0.01);與AngⅡ組比較,卡托普利組與芪參顆粒組CFs OD值明顯降低(P<0.01);與卡托普利組比較,芪參顆粒組CFs OD值明顯降低(P<0.05)。見表1。
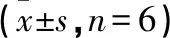
表1 各組Fs增殖比較
2.2 各組CFs Col Ⅰ、Col Ⅲ含量比較 AngⅡ組較空白對照組Col Ⅰ、Col Ⅲ含量明顯增加(P<0.01);與AngⅡ比較,卡托普利組和芪參顆粒組Col Ⅰ、Col Ⅲ含量減少(P<0.01或P<0.05);與卡托普利組比較,芪參顆粒組Col Ⅰ、Col Ⅲ含量有減少趨勢,但差異無統計學意義(P>0.05)。見表2。
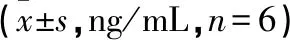
表2 各組Col Ⅰ、Col Ⅲ含量比較
2.3 各組CFs Col Ⅰ、Col Ⅲ mRNA表達比較 AngⅡ組較空白對照組Col Ⅰ、Col Ⅲ mRNA表達水平均明顯升高(P<0.01);與AngⅡ比較,卡托普利組和芪參顆粒組Col Ⅰ、Col Ⅲ mRNA表達水平明顯下降(P<0.05);與卡托普利組比較,芪參顆粒組Col Ⅰ、Col Ⅲ mRNA表達有下降趨勢,但差異無統計學意義(P>0.05)。見表3。
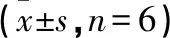
表3 各組Col Ⅰ、Col Ⅲ mRNA表達比較
2.4 各組MMP-2、MMP-9、TIMP-1和TIMP-2比較 AngⅡ組較空白對照組MMP-2、MMP-9、TIMP-1和TIMP-2含量均明顯增加,差異有統計學意義(P<0.01),MMP-2/TIMP-2和MMP-9/TIMP-1有下降趨勢;與AngⅡ比較,卡托普利組與芪參顆粒組細胞培養上清中的MMP-2、MMP-9、TIMP-1、TIMP-2含量減少,差異有統計學意義(P<0.05或P<0.01),MMP-2/TIMP-2和MMP-9/TIMP-1有降低趨勢但差異無統計學意義(P>0.05);與卡托普利組比較,芪參顆粒組MMP-2、MMP-9表達明顯下降(P<0.05),TIMP-1、TIMP-2、MMP-2/TIMP-2和MMP-9/TIMP-1有降低趨勢但差異無統計學意義(P>0.05)。見表4。
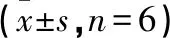
表4 各組MMP-2、MMP-9、TIMP-1和TIMP-2比較
3 討論
芪參顆粒化裁自經典名方真武湯及四妙勇安湯,由黃芪、丹參、玄參、金銀花、附子、炙甘草組成[8]。功效為活血解毒、溫陽益氣。研究證實,芪參顆粒可以改善心功能并逆轉心肌梗死后的心室重構[9],但其作用的具體分子機制尚待完善,本研究在細胞水平進一步從基質代謝角度探討了芪參顆粒抗MF的分子機制。
細胞外基質主要由Col Ⅰ、Col Ⅲ組成,其合成增多或降解減少均會導致MF的發生[10]。Col Ⅰ主要是粗纖維,約占心肌膠原的80%,以其強大的僵硬度和抗牽拉性,確保了室壁的強度;Col Ⅲ為細網狀,膠原約占15%,以其較強的伸展性和彈性,保證了室壁的順應性[11]。Col Ⅰ和Col Ⅲ的比例決定了心肌僵硬度,與舒張功能不全密切相關。CFs大量地散布于膠原蛋白網絡系統中,是Col Ⅰ、Col Ⅲ的主要分泌細胞。它在病理因素刺激下,過度增殖并大量分泌Col Ⅰ、Col Ⅲ,可增加心肌僵硬度,加重纖維化[12]。AngⅡ主要通過與AngⅠ受體結合,促發多條信號轉導途徑,導致心肌細胞肥大和心臟間質纖維化[13],故實驗采用AngⅡ刺激CFs建立MF細胞模型。結果顯示,AngⅡ組Col Ⅰ、Col Ⅲ的含量和mRNA的表達上調,卡托普利組的Col Ⅰ、Col Ⅲ的含量和mRNA的表達與AngⅡ比較均出現明顯的下調,而芪參顆粒組的Col Ⅰ、Col Ⅲ的含量和mRNA的表達與AngⅡ和卡托普利組比較均出現明顯的下調,提示芪參顆粒可以通過下調心肌膠原蛋白的含量,減輕MF的程度,并且效果優于卡托普利。
MMPs是一種鋅離子依賴性蛋白水解酶家族,它不僅能有效降解ECM成分的,還能對膠原蛋白的合成有一定調節作用[13]。心肌損傷后,受損細胞釋放出趨化因子、生長因子等引發免疫反應,而后心肌細胞、成纖維細胞和內皮細胞在此刺激下大量釋放有活性的MMPs[14]。MMPs可以直接降解某一種或幾種ECM,也可以通過激活其他類型的MMPs形成瀑布效應,進一步加強降解作用[15]。此外,MMPs還能調節膠原蛋白的合成,其表達及活性增高可促使ECM大量降解,使正常的膠原網絡降解并被缺乏連接結構的纖維間質所取代,導致正常間質結構消失,心肌細胞排列紊亂,促進纖維化發展[16-17]。其中,MMP-2和MMP-9屬于明膠酶類,是纖維化早期ECM的主要分解酶[18]。
TIMPs是MMPs的特異性抑制劑,通過其N端功能區的半胱氨酸殘基與MMPs鋅離子活性中心結合形成復合物,從而影響MMPs酶原的活化;或通過阻斷MMPs與底物結合,而抑制MMPs的活性[19]。TIMPs與MMPs共同參與調節ECM的代謝,二者比例失衡可導致心肌纖維化[20]。本研究發現,AngⅡ組MMP-2、MMP9、TIMP-1、TIMP-2表達明顯上調,MMP-2/TIMP-2、MMP-9/TIMP-1比值有升高趨勢,提示MMP-2、MMP-9表達相對增加,細胞外基質代謝紊亂,AngⅡ促進了纖維化的發展。卡托普利組MMP-2、MMP-9、TIMP-1、TIMP-2表達及MMP-2/TIMP-2、MMP-9/TIMP-1比值下調,芪參顆粒組上述指標較卡托普利組進一步下調,提示芪參顆粒可能通過降低MMP-2/TIMP-2、MMP-9/TIMP-1來調節細胞外基質代謝,具有改善MF的作用,且效果優于卡托普利。
綜上所述,本研究在細胞學水平證實了芪參顆粒可能通過調控MMPs和TIMPs以及二者比例平衡從而調控基質代謝,減少Col Ⅰ、Col Ⅲ的沉積,達到改善MF的作用,并且證實芪參顆粒對MF的治療效果優于西藥卡托普利。MF的作用機制復雜,今后我們將繼續對芪參顆粒抗MF的分子機制作進一步的探索。

