姜黃素通過抗氧化應激保護成骨細胞功能的作用機制研究
趙容山,梁偉堅,鄧煒聰,林正江,曾昕明,洪永昌
東莞市人民醫院手外科,東莞 523000
骨質疏松癥是最常見的骨退行性疾病之一,其主要特點是骨量低、骨微結構改變和骨折風險增加,嚴重影響了老年人尤其是絕經后婦女的生活[1-3]。成骨細胞負責骨形成,破骨細胞參與骨吸收。骨質疏松癥的病理生理學基礎是破骨細胞吸收增加,而成骨細胞功能障礙,導致骨形成減少和凈骨丟失[4,5]。研究表明,氧化應激是骨質疏松癥的關鍵致病因素,過度氧化引起的成骨細胞功能障礙進而導致成骨不足是骨質疏松癥發生發展過程中凈骨丟失的重要原因[6,7]。氧化應激不僅抑制成骨細胞分化和增殖還誘導細胞死亡[8-10]。因此,通過藥物干預減輕氧化應激有助于保護成骨細胞的功能并減少其死亡,對改善骨質疏松癥有一定作用。
姜黃素(curcumin,Cur)是姜黃根莖中的一種黃色物質,具有抗炎、抗氧化、抗菌和抗癌的作用,常被用作香料和強效草藥[11]。據Li等[12]報道,Cur預處理通過消除活性氧(reactive oxygen species,ROS)對GSK3β-Nrf2信號通路的抑制作用減少成骨細胞凋亡并維持其分化功能。此外,3D打印支架釋放的脂質體Cur對體外骨肉瘤(骨癌)細胞具有明顯的細胞毒性,但促進成骨細胞(健康骨細胞)的存活和增殖[13]。然而,目前關于Cur對氧化應激狀態下成骨細胞增殖的影響及其對成骨細胞氧化-還原系統的調節機制尚未明確。因此,本研究采用過氧化氫(H2O2)誘導氧化應激構建成骨細胞功能障礙模型,并通過觀察Cur對細胞活性、增殖、分化及氧化-還原系統的調節作用,闡明Cur保護氧化應激狀態下成骨細胞功能的作用機制。
1 材料與方法
1.1 儀器
生物安全柜(Thermo Fisher公司,1384 A2型);CO2細胞培養箱(Thermo Fisher公司,371型);倒置顯微鏡(Nikon公司,LV150N型);高速冷凍離心機(Thermo Fisher公司,X1R型);電熱恒溫鼓風干燥箱(上海精宏實驗設備有限公司,DHG-9030A型);電熱恒溫震蕩水槽(上海精宏實驗設備有限公司,DKZ-2型);酶標儀(Thermo Fisher公司,Multiskan FC型);成像系統(上海天能生命科學有限公司,Tanon-5200Multi型)。
1.2 藥品與試劑
成骨細胞完全培養基(上海賽百慷生物技術股份有限公司,Lot:2020032501)。胎牛血清(美國Gibco公司,Lot:2176404);β-甘油磷酸酯(上海阿拉丁生化科技股份有限公司,Lot:D1809035);抗壞血酸(德國默克公司,Lot:SLBN3833V);堿性磷酸酶染液(南京建成生物工程研究所,Lot:20200112);CCK-8細胞活力檢測試劑盒(南京建成生物工程研究所,Lot:20200328);總抗氧化能力檢測試劑盒(ABTS法,Lot:20200716)(南京建成生物工程研究所,Lot:20200724);丙二醛測定試劑盒(TBA法)(南京建成生物工程研究所,Lot:20200502);總超氧化物歧化酶測定試劑盒(WST-1 法)(南京建成生物工程研究所,Lot:20201025);過氧化氫酶測定試劑盒(南京建成生物工程研究所,Lot:20211127);堿性磷酸酶測定試劑盒(南京建成生物工程研究所,Lot:20200315);茜素紅S染色液(0.2%)(北京索萊寶科技有限公司,Lot:20200423);β-actin抗體(澳大利亞Affinity公司,Lot:67c9910);p-p38 MAPK抗體(澳大利亞Affinity公司,Lot:40s1057);Wnt5a抗體(澳大利亞Affinity公司,Lot:56a9800);β-catenin抗體(澳大利亞Affinity公司,Lot:52i2198)。
1.3 細胞
將新生SD大鼠置于75%的酒精中浸泡2 min,用眼科剪及鑷子分離顱骨,用眼科剪將其剪碎,然后轉移至離心管中,分別加入0.1%的Ⅰ型、Ⅱ型、Ⅳ型膠原酶和中性蛋白酶,于4 ℃消化過夜;次日將組織過100目篩網,收集濾液,1 000 r/min,離心5 min,棄上清,用完全培養基重懸細胞沉淀,接種至25 cm2細胞培養瓶,在37 ℃,5% CO2條件下培養,每3天換液1次;細胞生長至90%融合時,用含EDTA的0.25%胰酶消化傳代。細胞接種于細胞爬片,生長至80%~90%匯合時取出爬片進行ALP染色,用冷丙酮固定10 min,然后分別用孵育液在37 ℃孵育5 h,2%硝酸鈷浸泡5 min,1%硫酸銨浸泡2 min,最后沖洗、干燥、封固。在顯微鏡下觀察ALP染色情況,胞質呈現灰黑色顆粒或塊狀沉積則為成骨細胞。
1.4 方法
1.4.1 氧化應激模型構建與藥物處理
依照文獻中構建成骨細胞氧化應激模型的方法處理體外培養的大鼠成骨細胞[14],分為6個實驗組:(1)正常對照組(normal control,NC),在正常條件下培養;(2)H2O2處理組(H2O2),用50 μmol/L終濃度的H2O2處理細胞;(3)1.25 μmol/L Cur預處理組(H2O2+1.25 μmol/L Cur),用1.25 μmol/L的Cur預處理12 h后,再用50 μmol/L終濃度的H2O2處理細胞;(4)2.5 μmol/L Cur預處理組(H2O2+2.5 μmol/L Cur),用2.5 μmol/L的Cur預處理12 h后,再用50 μmol/L終濃度的H2O2處理細胞;(5)5 μmol/L Cur預處理組(H2O2+5 μmol/L Cur),用5 μmol/L的Cur預處理12 h后,再用50 μmol/L終濃度的H2O2處理細胞;(6)10 μmol/L Cur預處理組(H2O2+10 μmol/L Cur),用10 μmol/L的Cur預處理12 h后,再用50 μmol/L終濃度的H2O2處理細胞。
1.4.2 成骨細胞增殖檢測
通過檢測H2O2處理后24、48和72 h大鼠成骨細胞的活力評估各組細胞的增殖情況。按照CCK-8細胞活力檢測試劑盒的步驟,在相應的時間點往96孔細胞培養板的每孔加入10 μL CCK-8溶液,37 ℃孵育2 h后,用酶標儀檢測450 nm波長的吸光度值(OD450 nm)。
1.4.3 總抗氧化能力(total antioxidant capacity,T-AOC)檢測
按照總抗氧化能力(T-AOC)檢測試劑盒的說明書步驟配制反應液,室溫反應6 min后,檢測405 nm波長的OD值。根據標準曲線計算各樣品的T-AOC。
1.4.4 丙二醛(malondialdehyde,MDA)含量測定
按照MDA測定試劑盒的說明書步驟配制反應液,95 ℃水浴40 min,取出后流水冷卻,4 000 r/min,離心10 min,取上清,檢測532 nm波長的OD值,根據以下公式計算MDA含量:
MDA含量(nmol/mL)=[(OD測定-OD對照)/
(OD標準-OD空白)]×標準品濃度×稀釋倍數
1.4.5 過氧化物歧化酶(superoxide dismutase,SOD)活性測定
按照總SOD測定試劑盒的說明書步驟配制反應液,37 ℃孵育20 min,檢測405 nm波長的OD值。先計算出SOD抑制率(IRSOD),然后根據IRSOD計算出SOD活性,計算公式如下:
IRSOD=[(OD對照-OD對照空白)-(OD測定-
OD測定空白)]/(OD對照-OD對照空白)×100%
SOD活性(U/mL)=(IRSOD/50%)×
反應體系稀釋倍數×樣品稀釋倍數
1.4.6 過氧化氫酶(catalase,CAT)活性測定
按照CAT測定試劑盒的說明書步驟配置相關試劑,與樣本混勻后在37 ℃反應1 min,在405 nm處測定OD值,然后根據以下公式計算CAT活性:
CAT活性(U/mL)=[(OD對照-OD測定)/
(60×樣品量)]×271×稀釋倍數
1.4.7 堿性磷酸酶(alkaline phosphatase,ALP)活性測定
按照ALP測定試劑盒的說明書步驟配制反應液,37 ℃水浴15 min后加入顯色劑,檢測520 nm波長的OD值,然后根據以下公式計算ALP活性:
ALP活性(U/mL)=
[(OD測定-OD空白)/(OD標準-
OD空白)]×標準品濃度×100 mL×樣品稀釋倍數
1.4.8 誘導成骨分化及茜素紅染色
大鼠成骨細胞接種于細胞培養六孔板中,70%匯合時添加5 mmol/L的β-甘油磷酸酯和100 mg/mL抗壞血酸誘導成骨分化,每天更換1次分化培養基,持續1周。六孔板中的細胞用PBS洗3次后,4%多聚甲醛固定20 min;用雙蒸水洗3次;將水完全吸干凈后慢慢加入茜素紅S染色液,常溫下染色30 min;棄去染料,用雙蒸水洗5次。
1.4.9 免疫印跡(Western blotting)
提取成骨細胞的總蛋白進行SDS-PAGE,然后轉PVDF膜,封閉后,用1∶500稀釋的β-actin、p38 MAPK、Wnt5a和β-catenin抗體在4 ℃孵育18 h;次日用TBST洗膜3次,用HRP標記的二抗在室溫孵育1 h;TBST清洗3次后,加入ECL顯影。
1.4.10 統計學分析
2 結果
2.1 大鼠成骨細胞鑒定
ALP為一類磷酸酯酶,是成熟成骨細胞的標志性酶。本實驗采用金屬沉淀法顯示ALP的分布,此法以天然存在的β-甘油磷酸鈉為底物,經ALP水解釋放出磷酸,立即被鈣離子沉淀為磷酸鈣,再次被置換為磷酸鈷,最終被硫化液置換為灰黑色沉淀。如圖1所示,ALP存在于95%以上的細胞被染成灰黑色,說明本實驗分離和培養的細胞即為成骨細胞。

圖1 成骨細胞鑒定
2.2 Cur對大鼠成骨細胞活力和增殖的影響
NC組的成骨細胞活力隨著培養時間的延長逐漸增強,說明細胞處于良好的增殖狀態,用H2O2處理后,細胞活力顯著降低(P< 0.001)(見圖2),而且隨著培養時間的延長細胞活性逐漸降低,提示由H2O2介導的氧化應激不僅抑制成骨細胞增殖,還誘導其死亡。與H2O2組相比,除了1.25 μmol/L的Cur在48 h開始起作用,其它濃度的Cur(2.5~10 μmol/L)在24、48和72 h均顯增加細胞活性(P< 0.05)(見圖2),而且胞活性也隨著培養時間的延長而增加,說明Cur除了保護成骨細胞抵御氧化損傷,還可以促進氧化應激狀態下的成骨細胞增殖。
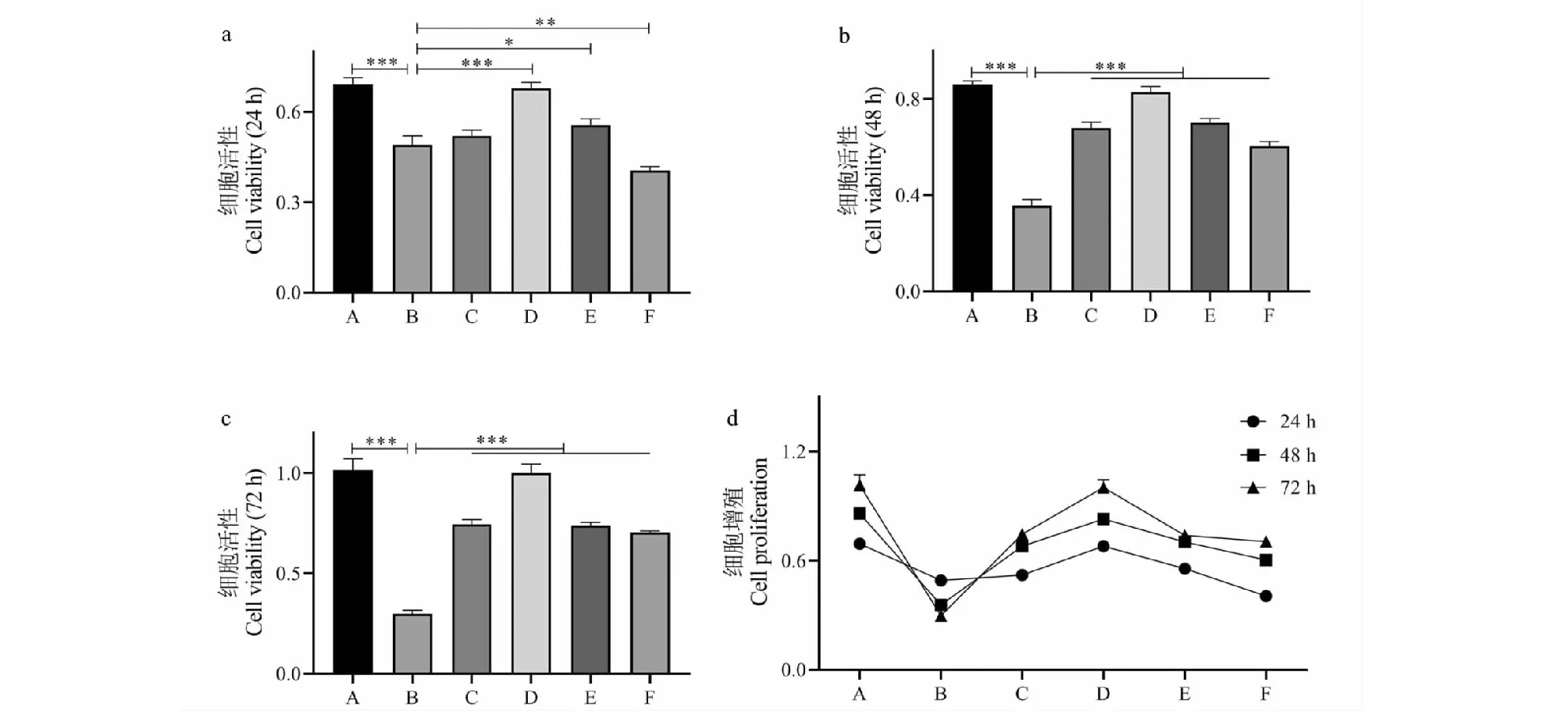
圖2 成骨細胞活性及增殖檢測
2.3 Cur對氧化應激的影響
SOD和CAT是內源性抗氧化酶,對機體和細胞的氧化-還原平衡維持起重要作用,過度氧化應激則可促進脂質發生氧化,生成MDA。與NC組比較,H2O2組的T-AOC、SOD和CAT水平顯著降低,而MDA水平顯著升高(P<0.001)(見圖3),說明50 μoml/L終濃度的H2O2可以刺激成骨細胞發生過度氧化應激。各濃度的Cur(1.25~10 μmol/L)預處理均可以抑制氧化應激,表現為T-AOC、SOD和CAT水平顯著升高,MDA水平顯著降低(P<0.01)(見圖3),而且對MDA生成的抑制作用具有劑量依賴性,說明該藥物具有良好的抗氧化活性。
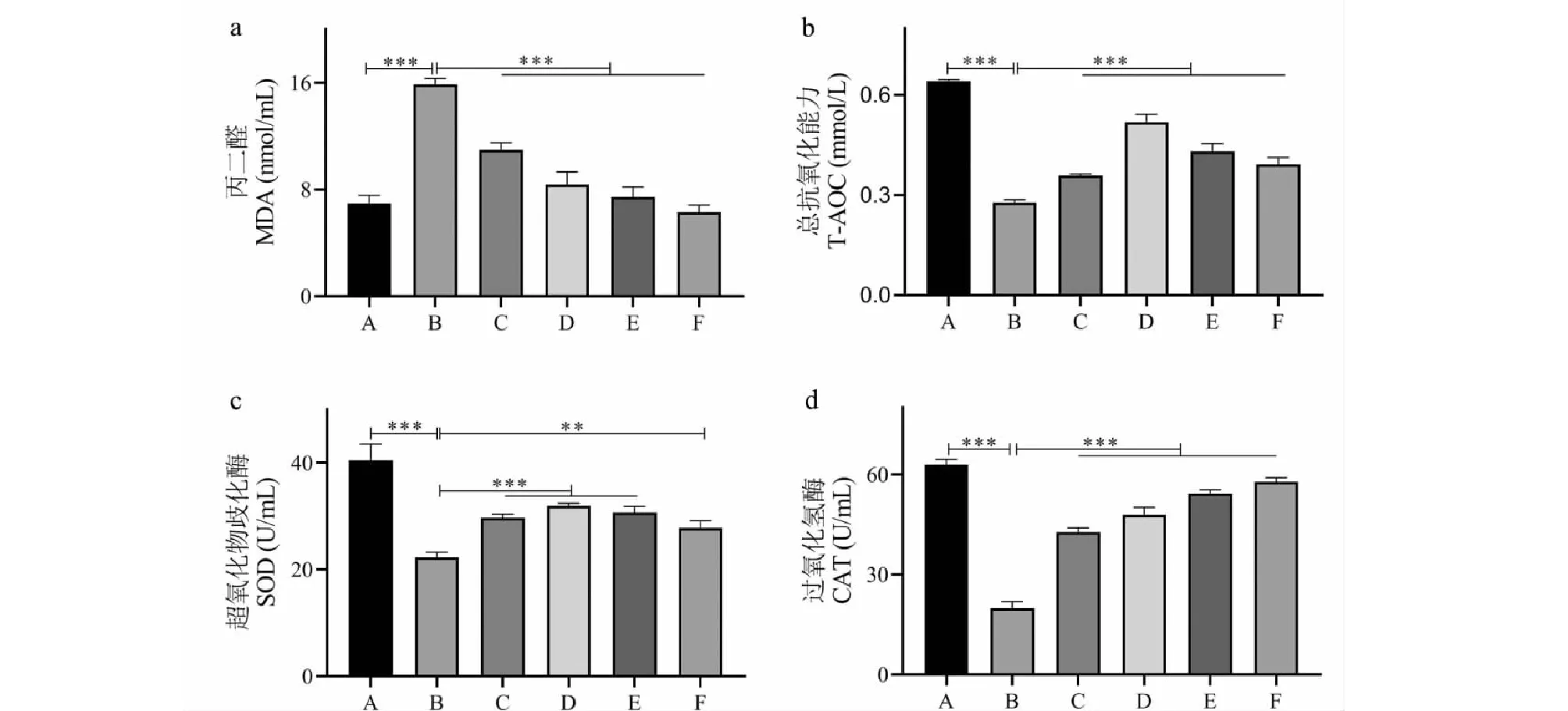
圖3 成骨細胞的氧化還原指標檢測
2.4 Cur對成骨細胞分化功能的影響
通過比較各組細胞的ALP活性及誘導分化后礦化鈣結節的形成情況評估Cur對成骨細胞分化功能的影響。如圖4所示,H2O2處理后成骨細胞的ALP活性顯著降低(P< 0.001),而且礦化鈣結節(茜素紅S染色陽性)明顯減少;1.25~5 μmol/L的Cur均可以顯著上調ALP的活性(P< 0.05),并促進礦化鈣結節形成,提示Cur可以保護氧化應激狀態下的成骨細胞分化功能。
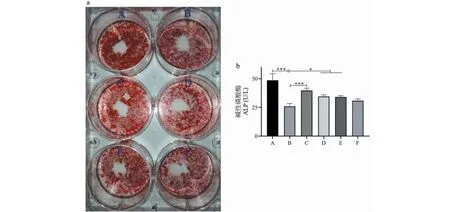
圖4 成骨細胞的分化功能評估
2.5 Cur對p-p38 MAPK和Wnt信號通路的影響
通過Western blotting檢測各組p-p38 MAPK和Wnt信號通路的表達,分析Cur保護氧化應激狀態下成骨細胞功能的可能機制。如圖5所示,H2O2處理后成骨細胞的p-p38 MAPK蛋白表達水平顯著升高,而Wnt5a和β-catenin顯著降低(P< 0.001);不同濃度的Cur則可以下調p-p38 MAPK并上調Wnt5a和β-catenin的水平(P< 0.05),提示Cur可能通過調節p38 MAPK和Wnt信號通路保護成骨細胞功能。
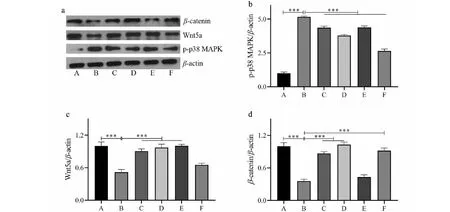
圖5 各組p-p38 MAPK、Wnt5a和β-catenin的蛋白表達水平比較
3 討論與結論
氧化應激損傷是骨質疏松癥和/或骨壞死的主要病理之一,在培養液中加入H2O2誘導成骨細胞功能障礙是一種已建立的模擬骨質疏松癥的細胞模型[12,15,16]。H2O2是一種常見的活性氧(ROS),其半衰期長且容易穿透各種質膜,因此可誘發明顯的脂質氧化、蛋白質損傷和DNA斷裂,最終導致細胞死亡和功能障礙[17]。本研究采用H2O2處理大鼠原代成骨細胞,致使細胞活性降低,增殖率和分化率減少,同時伴隨氧化還原失衡,說明成骨細胞氧化應激損傷模型構建成功。
目前治療骨質疏松癥的藥物主要包括雙膦酸鹽、激素療法、選擇性雌激素受體調節劑、降鈣素、地諾單抗、鈣和維生素D補充劑[18]。最近,合成代謝藥物如特立帕肽,雷奈酸鍶,羅莫昔單抗已經上市[17]。一項網絡薈萃分析研究表明,不同的藥物對不同部位的骨質疏松具有不同療效[18]。此外,一些藥物的安全性問題和不良副作用也需要引起重視[19,20]。因此,研究人員通過篩選天然藥物的藥效以期尋找有效且副作用小的骨質疏松治療方法。目前研究發現,天然抗氧化劑(如Cur、白藜蘆醇、山茶等)可以提供更安全有效的替代性治療策略[17]。但是Cur改善骨質疏松的作用機制尚未完全明確。因此,本研究旨在從氧化還原和信號通路方面探討Cur保護成骨細胞抗氧化應激損傷的機制。我們的實驗數據表明,各濃度的Cur均可抑制H2O2介導的過度氧化并促進應激狀態下的成骨細胞增殖,說明其安全且有效發揮藥理效應的濃度范圍較廣。
細胞組織的抗氧化能力有賴于其內源性抗氧化系統對ROS的清除,但在病理狀態下,細胞組織的清除能力減弱導致細胞的成分發生氧化損傷進而引起功能障礙[21,22]。在成骨細胞氧化損傷模型中,T-AOC和SOD水平降低代表細胞的抗氧化能力減弱,而MDA水平升高則提示細胞的脂質成分發生過度氧化。用梯度濃度的Cur干預后,氧化還原失衡有所改善。這些發現說明,Cur可能一方面通過自身的還原基團直接中和ROS,另一方面通過上調內源性抗氧化酶如SOD的活性間接清除ROS。氧化應激還通過激活p38 MAPK引起組織和細胞損傷[22],p38 MAPK的磷酸化水平代表其激活狀態。Western blotting結果顯示,不同濃度的Cur均可以抑制H2O2介導的p38 MAPK磷酸化,提示Cur對p38 MAPK激活的抑制作用可能參與其保護成骨細胞抗氧化損傷的機制。然而,由于不同類型的內源性抗氧化系統失衡導致產生的ROS種類不同,因而對細胞存活、死亡和功能的影響存在差異,我們將在今后的研究中進一步深入探究骨質疏松癥的氧化還原調控機制。
本研究還發現,Cur可以改善H2O2對成骨細胞分化功能的抑制,表現為礦化鈣結節增多且ALP活性升高,這與Li等[12]的研究報道一致。Cur預處理后的成骨分化能力增強可能與細胞增殖及ALP活性升高有關。然而,10 μoml/L的Cur并未表現出顯著的促成骨分化作用,提示維持良好的細胞活性與增殖能力可能更有利于成骨細胞的分化功能。此外,ROS作為一種信號分子也發揮其生理學功能,過度抗氧化可能反而不利于細胞的正常功能[23]。10 μoml/L的Cur預處理雖然能很好地抑制脂質過度氧化,但對內源性抗氧化系統的保護作用不及低濃度Cur明顯,因此,當Cur在動物和人體水平應用時應掌握適當的劑量。Wnt信號通路已被證實在成骨分化過程中起正性調控作用[24]。過多的ROS可促進Wnt/β-catenin通路中的關鍵基因轉錄轉變為受FoxO調控,最終抑制成骨細胞增殖、分化和礦化,從而形成骨質疏松癥[25]。我們通過Western blotting進一步探討了Cur保護成骨細胞分化功能的可能機制,發現Cur可以逆轉H2O2介導的Wnt5a和β-catenin表達下調,說明Cur可能通過調節Wnt/β-catenin信號通路促進氧化應激狀態下成骨細胞的增殖、分化和礦化。
綜上所述,本研究采用梯度濃度的Cur預處理大鼠成骨細胞,觀察其對氧化應激導致成骨細胞功能障礙的改善作用,并初步闡明其作用機理。今后,尚需要對Cur等天然化合物進行更深入的應用基礎及臨床研究,才能為研發安全且有效的抗骨質疏松治療策略提供理論依據。另外,Cur的用藥劑量、給藥方式、藥物代謝、藥效評價等也是值得探討的科學問題。

