UAS-Mlp84B-GFP轉基因果蠅制備及其表達分析
姜婷婷,張佳偉,劉小玲,聶宏運,唐 旻,佘美華,曾 群*
(1.南華大學衡陽醫學院附屬南華醫院檢驗科,中國湖南 衡陽 421001;2.南華大學衡陽醫學院生物化學與分子生物學教研室生態健康與人類重要疾病防控湖南省高校重點實驗室,中國湖南 衡陽 421001)
黑腹果蠅作為經典遺傳學和分子遺傳學模式生物,已經成為研究基因調控器官發育以及各種疾病發生的一個強有力的模型。果蠅心臟系統發生學的研究對確定心臟區域生成、心肌細胞分化和功能性心管形成的主要信號傳遞事件具有重要意義[1]。果蠅同源域轉錄因子Tinman及其脊椎動物同源基因NKX2.5在心管形態發生和心臟功能上的作用以及表達模式非常相似,提示無脊椎動物和脊椎動物的心臟發育有可能是由保守的同源通路控制的[2~6]。
LIM結構域蛋白被認為是高度保守的鋅指基序,目前已經有近30年的研究歷史。起初,LIM來源于3種調節同源結構域轉錄因子的首字母:Lin-1(一種細胞系蛋白質)、Isl1(胰島素增強結合蛋白質)和Mec3(一種機械感覺神經元分化蛋白質),表明LIM結構域在胚胎發育、基因表達以及作為壓力/應變傳感器中發揮作用[7]。由于鋅指基序與GATA型鋅指非常相似,人們認為它們可能參與結合特定的DNA序列,但目前尚不清楚LIM結構域與哪一類DNA元件結合[8]。Isl1和Mec3的LIM結構域抑制同型結構域與其DNA靶標的結合,一些LIM結構域蛋白是參與細胞譜系確定和模式形成的轉錄因子,還有一些LIM結構域蛋白則與細胞骨架有關,并在黏著斑和肌動蛋白微絲組織中發揮作用[9~11]。LIM結構域蛋白家族可在細胞關鍵生命進程中作為適配體或支架支持蛋白質復合物的組裝,尤其是介導多蛋白質復合體組裝,從而參與調控多種細胞信號轉導途徑[12]。LIM的蛋白質序列還包括額外的蛋白質結合模塊(如PDZ、PET、激酶結構域),它們賦予LIM蛋白特定功能并影響其亞細胞定位[13]。現有研究發現,人類有數百個LIM結構域蛋白,絕大多數在細胞質定位并發揮功能,但少數含有核定位或核輸出序列,使它們能夠在細胞核內外發揮作用[14]。
果蠅的心臟祖細胞對稱分布在背側中胚層。在心臟發生過程中,這些祖細胞遷移到背側中線并形成可收縮的線狀心管,這一過程與脊椎動物早期心臟發育極為相似。果蠅的心臟由兩種不同類型的細胞組成,即內層可收縮的心肌細胞和外層不可收縮的副心肌細胞[15]。目前研究發現,果蠅中的36個基因可編碼出75個不同的LIM結構蛋白,其中41.7%的LIM結構基因在果蠅心臟肌肉組織中表達,并在果蠅肌肉結構、心臟發育、心臟功能以及造血系統發揮重要作用[15]。
Mlp84B是一種肌肉LIM蛋白(MLP),屬于LIM-only家族,其表達定位于肌節Z盤[16~17]。有研究表明,人類MLP基因在肌肉拉伸感知反應中起著關鍵作用,其突變與肥厚和擴張型心肌病有關[18]。小鼠LIM結構域蛋白CRP2是果蠅Mlp84B的同系物,在血管系統,尤其是在平滑肌細胞中表達。CRP2基因敲除小鼠心臟超微結構表現出輕微的肥大表型[19]。在胚胎發育后期至整個成體階段,果蠅Mlp84B與α-actinin、D-titin在心臟組織中共定位。其突變純合子在蛹期致死,雜合子顯示心動過緩和心律異常表型,并影響果蠅的壽命[20~21]。
目前,由于缺乏Mlp84B抗體,人們無法在果蠅體內進行大規模Mlp84B互作蛋白質的篩選,因此本研究旨在給Mlp84B基因帶上一個內源融合表達的綠色熒光蛋白(green fluorescent protein,GFP)標簽,以應用GFP標簽抗體更好地指示Mlp-84B的表達以及篩選互作蛋白質。本研究以黑腹果蠅為材料,首先將果蠅含有內源啟動子元件的Mlp84B基因組融合GFP序列克隆至pUAST表達載體中,利用胚胎顯微注射技術將構建好的重組質粒注射到果蠅早期受精卵;其次通過雜交獲得紅眼果蠅,經單果蠅建系、平衡子定位后獲得穩定遺傳的轉基因果蠅;再次通過檢測GFP的表達定位以及Mlp84B的mRNA表達水平,驗證UASMlp84B-GFP轉基因果蠅是否構建成功;最后應用文中構建的轉基因果蠅,在體內證實果蠅Mlp84B與Act57B蛋白互作。我們成功構建的Mlp84B-GFP轉基因果蠅可以作為肌肉的標記品系,便于在體內大規模篩選和建立肌肉系統的Mlp84B互作蛋白質網絡,為探究肌肉細胞形成奠定了基礎。
1 材料與方法
1.1 果蠅品系
W1118(野生型果蠅,顯微注射背景果蠅)、Sp/Cyo;MKRS/TM6B(2.3號雙平衡子果蠅)和Act5C-Gal4(廣泛表達啟動子果蠅)均為本實驗室保種品系;Hand-Gal4(心臟組織表達啟動子果蠅)由湖南師范大學吳秀山教授贈送。
1.2 質粒
轉座酶質粒pΔ2-3用于輔助顯微注射;質粒pUAST-GFP含UAS元件和GFP片段,用于制備轉基因果蠅。以上質粒均為本實驗室保種。
1.3 試劑
本研究使用的試劑主要包括:gDNA Mini kit(CS11204,美國Invitrogen公司),反轉錄試劑盒、ClonExpress?Ultra One Step Cloning Kit和 Phanta Flash Master Mix(上海諾唯贊生物科技有限公司),QIAGEN質粒抽提試劑盒(德國QIAGEN公司),anti-GAPDH抗體(武漢博士德生物工程有限公司),anti-GFP抗體(英國Abcam公司),anti-Act57B抗體(本實驗室制備),限制性核酸內切酶(上海生工生物工程股份有限公司),DNA分子量標準(碧云天生物技術有限公司)。
1.4 pUAST-Mlp84B-GFP質粒構建
以W1118果蠅幼蟲基因組為模板,利用PCR方法擴增Mlp84B基因組片段(含3 613 bp上游啟動子序列、1 445 bp不含終止密碼子的基因組序列;F 引物 5'-AAACAAATGGGACTGTGT-3',R引物 5'-GAACGTTGTCAAAGCGCC-3'),并在其兩端加上pUAST-GFP載體同源臂序列,左同源臂序列為 5'-TGAATAGGGAATTGGGAATTC-3',右同源臂序列為 5'-TCGAGCGCGGCCGCAAGATCT-3'。使用2×Phanta Flash Master Mix和含有同源臂序列的引物對目的基因進行PCR擴增,并經PCR產物回收試劑盒純化Mlp84B基因組片段,同時用EcoRⅠ和BglⅡ將pUAST-GFP載體線性化,最后采用ClonExpress?Ultra One Step Cloning Kit將線性化的pUAST-GFP載體和Mlp84B片段進行同源重組連接,獲得pUAST-Mlp84B-GFP重組表達質粒。
1.5 轉基因果蠅制備及鑒定
1)采用QIAGEN質粒抽提試劑盒獲取高純度的pUAST-Mlp84B-GFP重組質粒和pΔ2-3轉座酶質粒。2)準備注射用DNA:首先,吸取25 μg pUAST-Mlp84B-GFP 重組質粒和 5 μg pΔ2-3輔助質粒(含轉位酶基因),加入1/10倍體積3 mol/L的NaOAc后,3倍體積無水乙醇混勻;其次,-80℃冷凍沉淀60 min,4℃、12 000 r/min離心15 min后去除上清;再次,用70%乙醇對沉淀物進行漂洗,4℃、12 000 r/min離心5 min后去除上清;最后,37℃干燥沉淀物,并吸取50 μL注射緩沖液[5 mmol/L 的 KCl、0.1 mmol/L 的 NaH2PO4(pH 6.8)]溶解沉淀物。3)胚胎顯微注射:收集發育30 min的W1118果蠅胚胎,30%次氯酸鈉處理2 min后,將脫去絨毛膜的胚胎頭尾一致地排列在雙面透明膠上,待胚胎干燥1~2 min后,滴1滴halocarbon oil覆蓋胚胎,通過顯微操作儀將DNA注射到胚胎后端略微偏離中心的位置,即極細胞的位置;在注射完的胚胎附近涂一層酵母糊,將胚胎置于18℃、60%濕度的環境下繼續培養2~3 d。4)轉基因果蠅的篩選鑒定:將注射后羽化的果蠅單個與W1118果蠅雜交,挑選出F1紅眼果蠅,并將其單個與雙平衡系雜交,最終通過雜交確定轉基因插入在哪一條染色體上。5)采用Western-blot和熒光顯微鏡檢測紅眼果蠅GFP的表達及定位。
1.6 基因克隆相關PCR反應混合液配制及反應程序
在PCR反應管中依次加入16 μL的RNasefree water、2.5 μL 的 2× Ex Taq buffer、2.5 μL 的dNTPs、2.6 μL 的上下游引物(10 μmol/L)、1 μL 的DNA模板和0.4 μL的Ex Taq DNA聚合酶,充分混勻。PCR反應程序:95℃預變性5 min;95℃變性5 min,55℃退火30 s,72℃延伸1 min,30個循環;72℃終延伸5 min;4℃保存產物。
1.7 實時熒光定量PCR反應混合液配制及反應程序
在96孔PCR反應管中依次加入4.9 μL的RNase-free water、10 μL 的 2× SYBR Premix Ex TaqⅡ、2.5 μL 的 dNTPs、1.6 μL 的上下游引物(10 μmol/L)和 1 μL 的 cDNA 模板,充分混勻。PCR反應程序:95℃預變性10 min;95℃變性15 s,60℃退火30 s,72℃延伸30 s(收集熒光),40個循環;緊接著做溶解曲線分析。
1.8 免疫共沉淀
提取轉基因果蠅幼蟲總蛋白質,測定濃度;將總蛋白質分成兩份,1份作為Input(不加抗體),1份作為實驗組(加入GFP抗體);取150 μL的總蛋白質和1 μg的GFP抗體,4℃孵育4 h,隨后加入50 μL預先封閉好的免疫沉淀(immunoprecipitation,IP)用的磁珠,4℃孵育過夜;將樣品放在磁力架上靜置10 s,吸走上清;加入500 μL的RIPA搖洗10 min,重復5次;加入50 μL的RIPA重懸磁珠,然后加等體積的上樣緩沖液,沸水煮5 min;進行Western-blot實驗,選擇Act57B抗體進行顯影。
2 結果
2.1 成功構建pUAST-Mlp84B-GFP質粒
為了制備Mlp84B-GFP轉基因果蠅,首先要獲得pUAST-Mlp84B-GFP重組質粒(質粒示意圖見圖1A)。我們以W1118果蠅3齡幼蟲基因組為PCR模板,擴增帶有和線性化pUAST-GFP載體同源末端的Mlp84B基因組序列,通過同源重組酶獲得pUAST-Mlp84B-GFP質粒,并用EcoRⅠ和BglⅡ對3個候選陽性重組質粒進行雙酶切鑒定,分別得到約5 kb的Mlp84B片段和13 kb的pUAST-GFP片段(圖1B,泳道1~3)。泳道1~2的質粒可能是濃度太高,酶切消化不完全,因此最后將泳道3的質粒進行DNA測序,并進行比對。測序結果證實,Mlp84B片段連入pUAST-GFP正確的位置(圖1C)。以上結果表明,我們成功構建了pUAST-Mlp84B-GFP重組質粒。
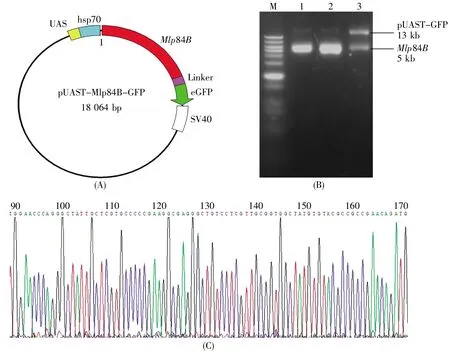
圖1 pUAST-Mlp84B-GFP重組質粒構建(A)pUAST-Mlp84B-GFP重組質粒載體示意圖;(B)pUAST-Mlp84B-GFP重組質粒的酶切電泳圖。用EcoRⅠ和BglⅡ雙酶切3個候選陽性質粒(泳道1~3),分別獲得13 kb pUAST-GFP和5 kb Mlp84B兩個片段(M:D0110 DNA分子量標準);(C)泳道3質粒的DNA測序部分波峰圖。Fig.1 Construction of recombinant plasmid pUAST-Mlp84B-GFP(A)Schematic diagram of recombinant plasmid pUAST-Mlp84B-GFP;(B)Gel electrophoresis of pUAST-Mlp84B-GFP recombinant plasmid with restriction enzyme digestion.EcoRⅠand BglⅡwere used to digest 3 candidate positive plasmids(lanes 1~3),and two fragments of 13 kb pUAST-GFP and 5 kb Mlp84B were obtained.M:D0110 DNA ladder;(C)Partial DNA sequence chromatogram of the Lane 3 plasmid.
2.2 成功構建UAS-Mlp84B-GFP轉基因果蠅
為了鑒定顯微注射技術獲得的果蠅是否是目的轉基因果蠅,我們首先將F0果蠅與W1118果蠅雜交,保留F1紅眼果蠅;接著將F1紅眼果蠅與Sp/Cyo;MKRS/TM6B平衡子果蠅雜交,分別獲得了定位在1號(Tg1)和2號(Tg2)染色體的穩定遺傳的F2轉基因果蠅。為了進一步鑒定該轉基因果蠅中的目的基因是否表達,我們首先利用熒光顯微鏡對F1轉基因果蠅進行觀察,發現F1轉基因果蠅幼蟲可見綠色熒光,且熒光主要集中在肌肉系統(圖2A)。其次,我們利用UAS/GAL4二元表達系統,將UAS-Mlp84B-GFP果蠅(F2)與Hand-Gal4果蠅雜交,在熒光顯微鏡下我們觀察到Hand-Gal4>UAS-Mlp84B-GFP果蠅心肌細胞發綠色熒光(圖2B),說明Hand-Gal4啟動子成功驅動Mlp-84B-GFP在心臟組織中高表達,為后續Mlp84B在心臟組織中的功能研究奠定了基礎;同時,將UAS-Mlp84B-GFP果蠅(F2)與Act5C-Gal4果蠅雜交,顯微觀察結果顯示,Act5C-Gal4>UASMlp84B-GFP果蠅全身可見綠色熒光(圖2C),說明Act5C-Gal4啟動子成功驅動Mlp84B-GFP在全身組織中高表達。最后,我們提取轉基因果蠅幼蟲總RNA進行qRT-PCR,以檢測Mlp84B的表達,結果顯示,與野生型果蠅相比,Tg1和Tg2轉基因果蠅的Mlp84B的表達分別升高2.85和2.80倍(圖2D);同時,對獲得的紅眼轉基因果蠅以及W1118果蠅進行蛋白質提取,并利用GFP抗體進行免疫印跡實驗,結果顯示,轉基因果蠅有GFP表達,而W1118果蠅檢測不到GFP蛋白(圖2E)。以上結果表明,pUAST-Mlp84B-GFP成功定位到果蠅基因組上,并且能夠在Mlp84B自身啟動子元件的作用下啟動GFP在肌肉組織表達,同時也能利用UAS增強子元件驅動Mlp84B異位表達。
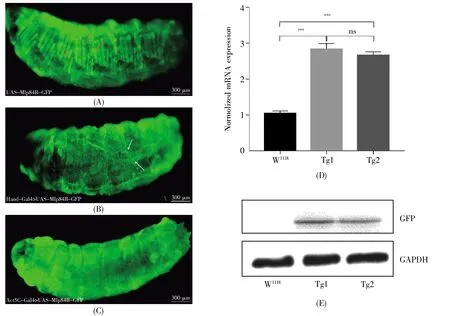
圖2 UAS-Mlp84B-GFP轉基因果蠅的鑒定(A)F1果蠅幼蟲肌肉系統發綠色熒光,紅色箭頭指示肌原纖維;(B)Hand-Gal4啟動子驅動UAS-Mlp84B-GFP,綠色熒光除了在肌肉系統表達之外,還在幼蟲心管表達(白色箭頭);(C)Act5C-Gal4啟動子驅動Mlp84B-GFP,綠色熒光在全身各組織廣泛高表達;(D)Tg1和Tg2轉基因果蠅Mlp84B的mRNA表達水平相對于野生型W1118果蠅分別上升了2.85和2.80倍。***P<0.01,ns表示無顯著性差異,n=3,數據用平均值±標準誤(±s)表示,兩組間比較采用t檢驗;(E)通過免疫印跡實驗能夠在Tg1和Tg2轉基因果蠅體內檢測到GFP蛋白的表達,而W1118果蠅中無GFP蛋白的表達。Fig.2 Identification of UAS-Mlp84B-GFP transgenic Drosophila(A)Green fluorescence appearing in the muscular system of F1 Drosophila larva.Red arrows indicate myofibrils;(B)Green fluorescence appearing in larval cardiac(white arrow)in addition to the muscular system.UAS-Mlp84B-GFP was driven by Hand-Gal4 promoter;(C)Green fluorescence protein widely and highly expressed in all tissues of the larval.Mlp84B-GFP was driven by the promoter Act5C-Gal4;(D)The mRNA expression level of Mlp84B in Tg1 and Tg2 transgenic Drosophila was increased by 2.85 and 2.80 folds,respectively,compared with that of W1118.***P<0.01,ns means no significant difference(n=3).The data are expressed as mean ± standard error(±s)and t test was used for comparison between the two groups;(E)GFP protein could be detected in Tg1 and Tg2 transgenic Drosophila,but not in W1118by Western-blot.
2.3 UAS-Mlp84B-GFP在果蠅肌肉組織表達
從前述結果可知,我們成功構建了UASMlp84B-GFP轉基因果蠅,GFP能夠在Mlp84B啟動子元件的作用下啟動表達,因此我們可以通過GFP的表達來示蹤Mlp84B蛋白在果蠅體內的定位。在本研究中,我們以Tg1轉基因果蠅胚胎、幼蟲、蛹以及成蠅為材料,在熒光顯微鏡下觀察GFP的表達定位。結果顯示,內源性Mlp84B在果蠅生命周期都有表達,而且主要表達于肌肉系統,其中在胚胎和幼蟲階段的表達量最高(圖3)。
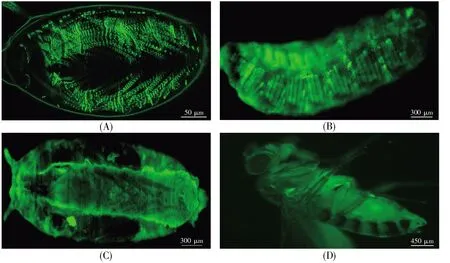
圖3 Mlp84B-GFP在果蠅肌肉組織中表達通過檢測GFP表達,示蹤Mlp84B在果蠅胚胎(A)、幼蟲(B)、蛹(C)和成蟲(D)的表達定位。Mlp84B強烈表達于果蠅肌肉系統。Fig.3 Mlp84b-GFP is expressed in Drosophila muscle tissueThe localization of Mlp84B in Drosophila embryo(A),larvae(B),pupa(C)and adult(D)was traced by detecting GFP expression.Mlp84B was strongly expressed in Drosophila muscular system.
2.4 Mlp84B與Act57B存在相互作用
Mlp84B與Act57B在胚胎肌肉和成體肌肉組織均有表達,并且都是作為Mef2(myocyte enhancer factor-2)的靶標調控肌肉系統的形成和功能[22~23]。為了探究Mlp84B、Act57B兩者的作用關系,我們首先利用STRING在線數據庫進行分析,發現Mlp84B與Actn、Tm2、Mlc2等多個肌肉蛋白的表達有共定位,這種共定位表達在其他物種中同樣存在(圖4A),同時,Mlp84B與Act57B存在強烈的物理性相互作用(圖4B);其次利用構建的UASMlp84B-GFP轉基因果蠅進行體內免疫共沉淀,結果表明Mlp84B與Act57B在果蠅體內存在物理性相互作用(圖4C、4D)。基于上述結果,我們推測Mlp84B與Act57B在肌肉組織中能夠形成復合體,共同調控肌肉系統的形成和功能。
3 討論
Mlp84B是一種肌肉LIM蛋白。人類MLP基因在肌肉拉伸感知反應中起著關鍵作用,其突變與肥厚和擴張型心肌病有關[18]。小鼠LIM結構域蛋白CRP2是果蠅Mlp84B的同系物,在血管系統,尤其是在平滑肌細胞中表達。CRP2基因敲除小鼠的心臟超微結構表現出輕微的肥大表型[19]。肌肉細胞轉錄因子Mef2通過對肌肉特異性靶基因的轉錄調控,確定和維持分化的肌肉表型。Mlp84B是已知的dMef2調控靶基因,在胚胎發育后期至整個成體階段,果蠅Mlp84B與α-actinin、D-titin在心臟組織中共定位,共同調控心臟功能,并影響果蠅的壽命[20]。目前的研究認為,Mlp84B在果蠅Z盤成分缺陷心臟與心肌病發展中發揮重要作用[21],但其在果蠅心臟發育中的作用尚不清楚。本研究將Mlp84B啟動子序列和編碼序列構建到pUAST-GFP表達載體中,利用胚胎顯微注射技術將pUAST-Mlp84B-GFP重組質粒注射到果蠅受精卵,雜交獲得穩定果蠅品系后,經qRT-PCR(圖2D)、Western-blot(圖 2E)驗證,獲得兩類 Mlp84BGFP轉基因果蠅,即Tg1和Tg2。我們構建的Mlp-84B-GFP轉基因果蠅包含Mef2轉錄因子結合位點,通過融合表達的GFP可對Mlp84B在果蠅體內的表達進行示蹤。本研究的檢測結果顯示,Mlp-84B-GFP在肌肉組織/肌原纖維高表達(圖2A、圖3),表明Mlp84B-GFP轉基因果蠅可作為果蠅肌肉系統的熒光報告品系。為了探究Mlp84B在肌肉系統中的互作蛋白質,本文通過生物信息學分析篩選了Mlp84B候選互作蛋白質,發現Mlp84B與多個肌肉蛋白質共定位表達且存在相互作用(圖4A、4B)。基于此,本研究利用構建的UAS-Mlp84B-GFP轉基因果蠅,通過免疫共沉淀實驗,在體內證實Mlp-84B與另一個肌肉蛋白質Act57B存在物理學互作(圖4C、4D)。我們推測Mlp84B與Act57B在肌肉組織中形成復合體,共同受到肌肉組織轉錄因子Mef2的靶向調控,最終影響肌肉組織的形成和功能。

圖4 Mlp84B與Act57B的相互作用分析(A)生物信息學分析與Mlp84B共定位的蛋白質。左圖為在果蠅中與Mlp84B共定位的蛋白質,右圖為在其他物種中與Mlp84B共定位的蛋白質;(B)生物信息學分析果蠅Mlp84B的相互作用蛋白質網絡;(C~D)Mlp84B與Act57B存在物理相互作用。Fig.4 Mlp84B interacted with Act57B(A)Bioinformatics analysis of the co-localization proteins of Mlp84B in Drosophila(left)and other species(right);(B)Bioinformatics analysis of protein interaction network with the Drosophila Mlp84B;(C~D)Mlp84B interacts with Act57B physically.
此外,生物信息學分析發現,Mlp84B與多個蛋白質有共定位和互作,這些蛋白質大多數在肌肉組織高表達(圖4A、4B),并且在果蠅和人類等高等生物中高度保守。我們推測,肌肉LIM蛋白Mlp-84B能夠在肌肉組織中建立一個蛋白質互作網絡,共同影響肌肉細胞的形成、分化和結構穩定。我們期待利用UAS-Mlp84B-GFP轉基因果蠅,通過GFP抗體在蛋白質組學上大規模篩選Mlp84B內源性互作蛋白質,建立一個完善的肌肉蛋白質互作網絡,為揭示人類肌肉系統的發生和穩態奠定基礎。
總的來講,本文構建的UAS-Mlp84B-GFP轉基因果蠅既可以在Mef2轉錄因子的作用下啟動Mlp84B在所有類型的肌肉細胞中表達,又可以通過UAS-Gal4二元表達系統在Hand-Gal4心臟特異啟動子的作用下啟動Mlp84B在心臟組織中過表達,為后續研究Mlp84B在心臟組織中的作用奠定了基礎。由于構建的UAS-Mlp84B-GFP轉基因果蠅只包括上游3 kb的調控序列,并不能完全反映Mlp84B的內源表達情況,所以后續我們還將制備果蠅Mlp84B抗體以及通過CRISPR/Cas9系統構建Mlp84B原位敲入的GFP果蠅,以更加全面地探索Mlp84B的表達及功能。

