溶血磷脂酶PNPLA7的研究進展
王 宇,常平安*,黃飛飛
(1.重慶郵電大學生物信息學院,中國重慶 400065;2.重慶市大數據生物智能重點實驗室,中國重慶 400065)
含patatin樣磷脂酶結構域蛋白(patatin-like phospholipase domain containing protein,PNPLA)在哺乳動物脂質代謝和信號轉導中發揮重要作用,近年日益受到廣泛關注[1~3]。PNPLA蛋白家族包含9種蛋白質,分為3個亞群,其中第2亞群包括PNPLA6和PNPLA7。PNPLA6和PNPLA7通常分別被稱作神經病靶標酯酶(neuropathy target esterase,NTE)和NTE相關酯酶(NTE-related esterase,NRE)[1]。與其他亞群PNPLA成員相比,PNPLA6和PNPLA7除了含有patatin樣磷脂酶結構域,還具有明顯不同的跨膜結構域(transmembrane domain,TMD)和預測的環核苷酸結合結構域(cyclic nucleotide binding domain,CNBD)[1,4]。
NTE是在研究有機磷酸酯引起的遲發性神經病(organophosphate-induced delayed neuropathy,OPIDN)的機理過程中被發現的[5]。其作為內質網上的一種跨膜蛋白,具有磷脂酶B的活性,催化卵磷脂和溶血卵磷脂的脫酰基反應,調節細胞磷脂代謝,是胚胎發育、神經發育和軸突維持所必需的蛋白質[6~7]。盡管人們對NTE的結構功能與表達特性的認識已經比較清楚,然而有關PNPLA7的研究較少。本文就PNPLA7近年來的研究進展進行了綜述,對其酶學特性、表達調控、結構與功能等進行全面介紹,為進一步闡明其生理功能和作用機制奠定基礎。
1 PNPLA7是一種內質網上的溶血磷脂酶
PNPLA7是一種在小鼠、人和大鼠等哺乳動物中進化保守的蛋白質[8~9]。小鼠PNPLA7與PNPLA6具有較高的序列相似性和相同的蛋白質結構域(圖1):N末端是1個跨膜結構域(TMD)(10~32氨基酸);N端為其調節域,包含3個環核苷酸結合結構域(CNBD)(162~259、473~564、590~680 氨基酸);C端是其催化域,包含1個patatin結構域(924~1 090 氨基酸)[10]。
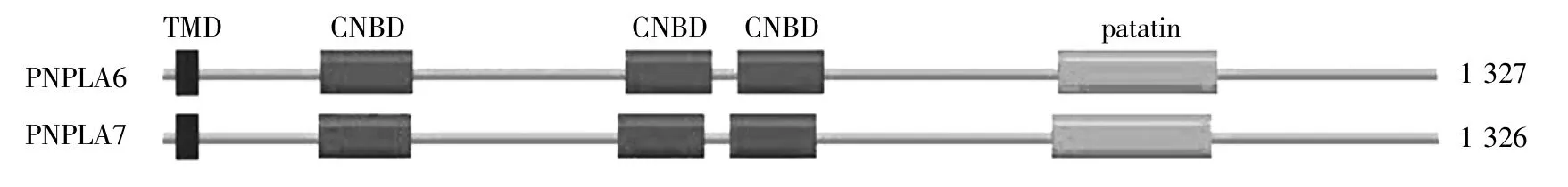
圖1 小鼠PNPLA6和PNPLA7的蛋白質結構域[6,10]Fig.1 Protein domains of mouse PNPLA6 and PNPLA7[6,10]
PNPLA7的外源性和內源性表達結果均顯示,其為內質網上的一種膜整合蛋白[8~9,11~12]。PNPLA7通過N末端TMD定位于內質網上,其N末端位于內質網的基質腔中,N末端的TMD鑲嵌在內質網上,其余大部分結構(包括調節域和催化域)位于內質網膜的細胞質側,其中,C-末端面向內質網的細胞質側,催化域附著在內質網的細胞質側膜上(圖2A)[12]。除了N末端的TMD對PNPLA7的內質網定位起關鍵作用外,調節域對PNPLA7在內質網上的正常分布也有一定作用,研究報道,缺失調節域的PNPLA7在內質網上呈點狀聚集狀態[12]。此外,有研究發現,PNPLA7在內質網和線粒體相關膜(mitochondria-associated membrane,MAM)均有表達,并且免疫熒光檢測顯示PNPLA7部分包裹線粒體[13]。
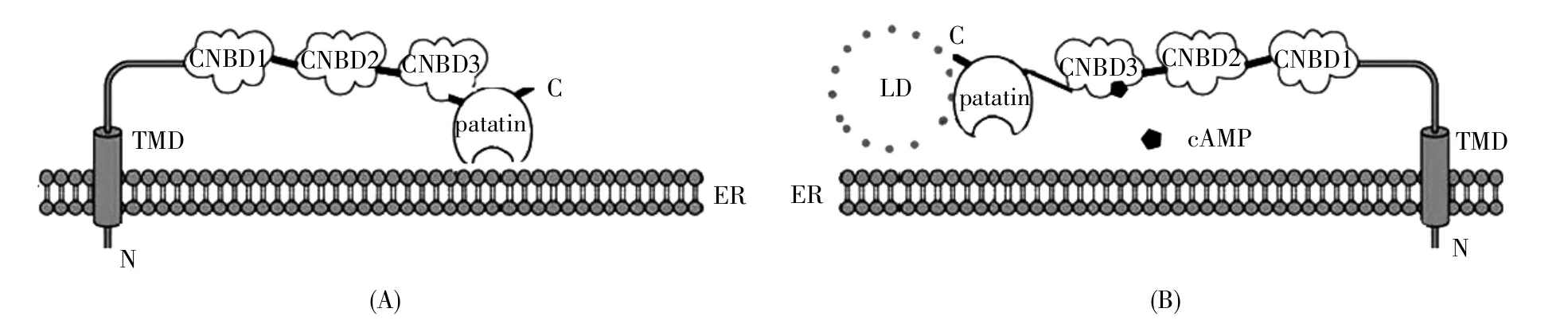
圖2 PNPLA7與內質網和脂滴互作的分子模型(A)正常情況下,PNPLA7通過N末端的跨膜結構域(TMD)鑲嵌在內質網(ER)上,調節域和催化域位于內質網膜的細胞質側,催化域附著在內質網的細胞質側的膜上;(B)當細胞中cAMP水平升高時,cAMP結合CNBD3,影響調節域的結構,促使催化域結合脂滴(LD)。Fig.2 Molecular model of the interactions of PNPLA7 with the endoplasmic reticulum and lipid droplets(A)Normally,PNPLA7 is anchored on the endoplasmic reticulum(ER)through the N-terminal TMD,the regulatory and catalytic domains are exposed on the cytoplasmic face of the ER membrane,and the catalytic domain is attached to the ER cytoplasmic membrane;(B)When cAMP levels are elevated in cells,cAMP binds to CNBD3 to induce the binding of the catalytic domain with lipid droplets(LDs)through affecting the structure of the regulatory domain.
體外檢測發現,PNPLA7具有溶血卵磷脂酶的催化活性,可以水解溶血磷脂酰膽堿(lysophosphatidylcholine,LPC)等溶血磷脂[9]。進一步研究證實,PNPLA7在體外對多種溶血磷脂具有水解活性,并在體內僅對LPC,特別是含有不飽和脂肪酸的LPC,具有強烈的催化活性,釋放出脂肪酸和甘油磷酸膽堿[12]。穩定表達PNPLA7顯著降低細胞內的含有不飽和脂肪酸(如C16:1、C18:1和C18:2)的LPC含量,而不改變其他溶血磷脂的水平[12]。相反,在細胞內敲除PNPLA7,細胞內的LPC溶血磷脂酶活性顯著降低[12]。因此,PNPLA7是一種內質網上的溶血卵磷脂水解酶,催化LPC脫酰基代謝。無論是以人工底物戊酸苯酯,還是以生理底物LPC進行活性測定,研究都發現:PNPLA7的酶活性依賴其催化結構域,而并不依賴其調節結構域[11~12]。位于催化域patatin結構域中的GXSXG模體的絲氨酸(serine,S)是其活性位點氨基酸,能與有機磷酸化合物二異丙基氟磷酸(diisopropylfluo-rophosphate,DFP)結合,抑制酶活性[8]。以戊酸苯酯為底物進行測試,結果顯示,在底物濃度為1 mmol/L的弱堿性(pH 8.0~8.5)溶液中,PNPLA7的催化活性最強[9]。
2 PNPLA7的表達受營養狀態調控
PNPLA7在脂肪組織、骨骼肌、心肌和脂質代謝活躍的睪丸等組織中具有相對豐富的表達[8~11]。作為一種在脂肪組織中高表達的溶血磷脂酶,PNPLA7的表達受到營養狀態的調節。在喂食狀態下,小鼠各個組織中的PNPLA7的表達相對較低;禁食則增強PNPLA7在脂肪組織、心肌、骨骼肌、睪丸和肝臟等組織中的表達[9,11];饑餓后再喂食則又降低PNPLA7的表達[14]。定量PCR分析發現,禁食調控PNPLA7的轉錄剪接,增加有活性的PNPLA7的表達,降低無活性的剪接突變體的表達[11]。相對喂食正常食物的小鼠,喂食高脂肪食物的小鼠肝臟的PNPLA7表達明顯增加;并且相對正常小鼠,PNPLA7在db/db肥胖小鼠肝臟中的表達也明顯增加[14~15]。
研究報道,在小鼠3T3-L1前脂肪細胞分化為成熟脂肪細胞的過程中,PNPLA7的表達在早期明顯下降,而在中后期顯著升高;在已分化的小鼠3T3-L1脂肪細胞中,胰島素劑量相關性地抑制PNPLA7的表達[9,14]。另外,單不飽和脂肪酸油酸增加脂肪細胞中PNPLA7的表達,飽和脂肪酸棕櫚酸則不影響PNPLA7的表達[14]。因此,無論是在動物機體上還是在脂肪細胞中,PNPLA7的表達都受營養狀況的調節;而且,PNPLA7可能在脂肪代謝和能量穩態維持中起一定作用。此外,PNPLA7蛋白受泛素-蛋白酶體途徑和自噬降解,并且調節域中的破壞盒(destruction box)和N-末端的TMD分別是泛素-蛋白酶體途徑和自噬降解PNPLA7所必需的結構[16~17]。
3 PNPLA7調控肝臟脂肪代謝與脂肪肝發展進程
PNPLA7的組織分布、催化活性、細胞定位以及表達特性等提示,它可能在脂質代謝和能量代謝中起一定作用。在COS-7細胞中穩定表達小鼠PNPLA7,能顯著降低細胞內的含有不飽和脂肪酸的LPC含量,而不改變其他溶血磷脂的水平[12]。此外,在肝癌細胞Huh7中表達PNPLA7明顯降低脂肪積累[18],而敲減PNPLA7的表達,小鼠肝臟中的脂肪積累增加[19]。有研究報道,在敲減PNPLA7的肝細胞中回補表達PNPLA7及其無活性的突變體,肝細胞中的脂肪水平恢復正常[15],這表明PNPLA7調控肝臟脂肪代謝與其活性無關。分子機制研究表明,PNPLA7通過與載脂蛋白E(apolipoprotein E,ApoE)的直接相互作用(這種互作不依賴PNPLA7的催化活性),抑制ApoE經泛素-蛋白酶體途徑的降解,從而增強其穩定性,促進極低密度脂蛋白(very-low-density lipoprotein,VLDL)的分泌,降低脂肪在肝細胞中的積累[15]。在敲減肝臟PNPLA7的小鼠中,肝臟VLDL的分泌減少,促進脂肪在肝臟中的積累,導致脂肪肝的發生[15]。這種作用只發生在饑餓狀態下,而不發生在正常喂食和高脂肪喂食狀態下[15],進一步表明PNPLA7在能量代謝中的調節功能受營養狀態的調控。綜上可知,PNPLA7在肝臟中通過與ApoE互作,影響其穩定性,并通過調節VLDL的分泌,調控脂肪在其中的積累。
肝臟PNPLA7的表達水平與血漿中脂肪和ApoE的含量呈正相關[15]。PNPLA7的表達升高可增強肝臟脂肪以VLDL的形式分泌到循環系統中,促進外周組織對脂肪的攝取,這表明PNPLA7在肝臟和血漿脂質穩態協調中發揮一定的作用。雖然相關研究發現,在喂食高脂肪、肥胖小鼠和脂肪肝病人的肝臟中PNPLA7的表達上調[14],但是當PNPLA7敲減后,肥胖小鼠肝臟中脂肪積累并沒有逆轉反而加劇[15]。因此,PNPLA7的表達增高可能不是肝硬化的驅動力,而更可能是削弱肝硬化的一種潛在反饋調控機制。在非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)患者中,PNPLA7表達較高的患者的脂肪肝病情一般較輕,并且肝臟中的PNPLA7 mRNA表達隨著脂肪肝嚴重程度的增加而逐漸降低[15]。有研究發現,在肝癌細胞系和組織中,PNPLA7的表達下調[20]。這提示,PNPLA7表達可能是脂肪肝的良好預后標志物,PNPLA7表達較低的脂肪肝患者可能發展到諸如肝癌等嚴重狀態。因此,PNPLA7可能在NAFLD演變為非酒精性脂肪變性(nonalcoholic steatosis,NAS)的過程中發揮一定作用。
4 環核苷酸調控PNPLA7與脂滴的結合
脂滴(lipid droplet,LD)作為中性脂(脂肪和固醇酯)儲存的細胞器,是成熟脂肪細胞的顯著特征結構。內質網是脂滴形成的場所,脂滴外周單層磷脂的成分從高到低依次為磷脂酰膽堿、磷脂酰乙醇胺和磷脂酰肌醇[21]。此外,脂滴外周的單層磷脂膜還含有溶血乙醇胺和LPC等溶血磷脂,這些溶血磷脂含有大量的不飽和脂肪酸[22~23]。
亞細胞定位研究發現,融合綠色熒光蛋白(green fluorescence protein,GFP)的PNPLA7除了定位在內質網,還有極少部分附著在脂滴上[9]。我們結合亞細胞定位和細胞器蛋白質的免疫印跡檢測發現:獨立的C端催化域完全包裹在脂滴上并導致脂滴聚集,其中4個假定的疏水TMD為脂滴靶向模體(LD targeting motif),PNPLA7與脂滴的結合依賴于C端催化域;刪除N末端TMD的僅含有調節域和催化域的PNPLA7并不能結合脂滴;而刪去調節域的PNPLA7雖然可借助其N末端的TMD鑲嵌在內質網上,借助C端催化域與脂滴結合,但并沒有導致脂滴成簇聚集[12,24]。這表明,PNPLA7憑借催化域結合脂滴,調節域阻礙催化域與脂滴的結合,N末端的TMD阻止脂滴成簇聚集[24]。
PNPLA7的調節域中存在3個預測的CNBD。環核苷酸,如環腺苷酸(cAMP),可能與CNBD結合,改變調節域的結構,進而影響催化域的結構和功能。在表達PNPLA7的細胞中,加入cAMP類似物8-CPT-cAMP之后,PNPLA7與脂滴的結合明顯增加[12]。進一步研究發現,缺失第1個或第2個CNBD后,增加cAMP仍然可以促進PNPLA7與脂滴的結合;而缺失第3個CNBD(CNBD3)后,提高cAMP水平并不能促進PNPLA7與脂滴的結合[12]。這表明,cAMP調節PNPLA7與脂滴的結合依賴第3個CNBD的存在。
相關研究分析了與PNPLA7具有高度相似序列的PNPLA6,發現PNPLA6的3個CNBD中只有CNBD3含有脯氨酸-精氨酸-丙氨酸-蘇氨酸(PRAT)模體,推測其極可能是cAMP結合的結構域[25]。另有研究發現,增加細胞內的cAMP可以促進PNPLA7與脂滴的結合,但并沒有改變其催化活性[12]。因此,cAMP很可能通過直接結合PNPLA7調節域中的CNBD3改變調節域的結構,進而影響催化域的構象,調節催化域與脂滴的相互作用,使其在特定細胞器(內質網和脂滴)之間發揮作用(圖 2B)。
5 展望
作為內質網膜上的一種溶血磷脂酶,PNPLA7水解溶血卵磷脂,調控磷脂代謝,然而PNPLA7介導的磷脂代謝的生理作用并不完全清楚。PNPLA7主要在脂肪組織、心肌、骨骼肌等脂肪代謝和能量轉換活躍的組織中高表達,并且其表達受到營養狀態的調控。研究發現,肝臟中PNPLA7通過與ApoE互作調節ApoE經泛素-蛋白酶體途徑的降解,影響VLDL的分泌,從而調控肝臟脂肪的代謝,并且PNPLA7與ApoE的互作與其催化活性無關[15]。但是,PNPLA7與ApoE互作調控ApoE穩定性的分子機制,以及PNPLA7的溶血磷脂酶活性在肝臟脂肪代謝中的作用,至今尚不清楚。PNPLA7對小鼠肝臟脂肪代謝的調控發生在禁食狀態。禁食狀態下,PNPLA7的表達增強,抑制ApoE經泛素-蛋白酶體途徑的降解,促進脂肪以VLDL的形式分泌,降低脂肪在肝細胞中的積累,維持脂肪代謝穩態和能量平衡。那么,禁食狀態下PNPLA7在肝臟中調控脂肪代謝的作用機制是否同樣存在于其他組織或器官?這也有待進一步的研究證實。
研究表明,cAMP水平調控PNPLA7與脂滴的相互作用[12]。在禁食狀態下,兒茶酚胺類激素,如去甲腎上腺素和異丙腎上腺素等,結合脂肪細胞質膜上偶聯著鳥苷酸結合蛋白Gαs的β-腎上腺素受體,激活腺苷酸環化酶,增加cAMP水平[26]。這樣禁食不僅增強PNPLA7的表達,而且可能通過增加cAMP,促進PNPLA7從內質網到脂滴的轉位從而結合脂滴,PNPLA7水解脂滴表面的LPC,改變脂滴表面的單層磷脂膜結構,促進脂肪分解。胰島素是負調控脂肪分解的主要激素。胰島素結合其受體,通過胰島素受體底物1和2,激活磷脂酰肌醇3激酶,增加3-磷酸肌醇,激活蛋白激酶B,蛋白激酶B通過穩定其底物含α/β水解酶結構域蛋白15和直接磷酸化激活磷酸二酯酶3B(phosphodiesterase 3B,PDE3B),分解降低cAMP水平[26]。胰島素在脂肪細胞中不僅抑制PNPLA7的表達,而且可能通過降低cAMP水平,促進PNPLA7與脂滴的分離,抑制脂肪分解,促進脂肪合成。因此,進一步探究在各種營養狀態下,PNPLA7介導的溶血磷脂代謝在肝臟以外的其他組織(如脂肪和肌肉組織等)中的作用,包括調控脂肪和能量代謝等,將更加深刻地揭示PNPLA7的生理功能。在這其中,PNPLA7與內質網、脂滴等細胞器的相互作用及其對特定細胞器脂質代謝的調控,無疑是在分子和亞細胞水平上更加深入地闡釋其作用機制。

