miR-383和PRDX3在結腸癌組織中的表達水平及意義
楊學麗,姜琳娜,安 欣,吳倩嵐,江現麗,魏 娉,李智峰
邯鄲市第一醫院:1.病理科;2.普外科,河北邯鄲 056002
結腸癌是一種常見的消化系統惡性腫瘤,手術切除輔以放化療是主要的治療方式,但術后易轉移復發,病死率高,嚴重危害人類的生命健康[1]。因此研究結腸癌的發生、發展機制,尋找可早期提示預后的分子標志物具有重要意義。微小RNA-383(miR-383)與多種腫瘤的發生、發展相關,研究表明,膠質瘤內皮細胞中miR-383表達明顯下調,miR-383過表達能顯著抑制內皮細胞的增殖、遷移,以及小管形成和球狀血管生成[2]。崔盈等[3]研究表明,miR-383在結腸癌組織中表達降低,上調miR-383表達對結腸癌細胞具有抑制增殖和降低侵襲及遷移能力的作用。硫氧還蛋白依賴的過氧化物還原酶3(PRDX3)為一類存在于細胞線粒體中的過氧化物酶,通過調節細胞內活性氧化物水平,參與細胞增殖、分化與凋亡,對腫瘤的發生、發展起著重要作用。丁妍等[4]研究表明,PRDX3在食管鱗狀細胞癌中表達水平升高,且與腫瘤的分期分級、淋巴結轉移呈正相關。然而,目前miR-383與PRDX3同時在結腸癌中的研究報道不多。本研究通過檢測miR-383與PRDX3在結腸癌組織中的表達情況,探討miR-383和PRDX3在結腸癌中的表達水平及臨床意義,現報道如下。
1 資料與方法
1.1一般資料 選擇2016年5月至2018年6月在本院確診為結腸癌患者的結腸癌組織標本85份,其中男44例,女41例;年齡32~88歲,平均(58.50±12.60)歲;<60歲38例,≥60歲47例;腫瘤最大徑<50 mm者40例,≥50 mm者45例;腫瘤分化程度:低分化35例,中、高分化50例;TNM分期[5]:Ⅰ~Ⅱ期者37例,Ⅲ~Ⅳ期者48例;浸潤深度:T1/T2 39例,T3/T4 46例;有淋巴結轉移47例,無淋巴結轉移38例。納入標準:(1)符合結腸癌診斷標準[5],且病理學檢查確診;(2)每份標本臨床、病理資料完整;(3)所有患者均為初次診斷,術前均未行任何抗腫瘤治療。排除標準:(1)合并嚴重心、肝、肺、腎功能不全;(2)合并其他系統的惡性腫瘤者;(3)臨床資料不全者。另選取同期88例行腸鏡檢查人員的正常結腸黏膜組織標本作為對照,其中男45例,女43例;年齡31~86歲,平均(57.97±12.27)歲。研究標本采集均經過醫院倫理委員會批準,患者及其家屬均簽署知情同意書。
1.2主要試劑與儀器 RNA提取試劑盒(批號76205)購自德國Qiagen公司;逆轉錄試劑盒(批號K5076)和聚合酶鏈式反應(PCR)試劑盒(批號K7009)購自美國Thermo Fisher公司;免疫組織化學試劑盒(批號ab30556)、PRDX3鼠抗人單克隆抗體(批號ab70224)購自美國Abcam公司;實時熒光定量PCR(qRT-PCR)儀(型號LightCycler480)購自羅氏診斷產品(上海)有限公司;顯微鏡(型號DMI8)購自德國徠卡公司。
1.3研究方法
1.3.1標本采集及保存 采用RNA提取試劑盒從冰凍的結腸癌組織及正常結腸黏膜組織標本中提取總RNA,用DNA酶去除DNA,檢測RNA濃度與純度,反轉錄得到cDNA,置于-20 ℃保存備用。將另外一部分結腸癌組織及正常結腸黏膜組織標本做成石蠟切片,用于免疫組織化學染色。
1.3.2qRT-PCR檢測miR-383、PRDX3信使核糖核酸(mRNA)的表達水平 采用qRT-PCR檢測miR-383、PRDX3 mRNA的表達水平,miR-383、PRDX3 mRNA及內參基因U6、β-actin引物序列由上海吉瑪公司設計與合成,引物序列見表1。反應體系20 μL,反應條件:95 ℃,75 s;95 ℃,15 s;60 ℃,75 s;95 ℃,15 s;40個循環。每個樣品設置3個復孔。反應結束后,采用2-ΔΔCt分析法計算相對表達水平。

表1 qRT-PCR引物序列
1.3.3免疫組織化學染色 將石蠟切片后,經過脫蠟、抗原修復和去除內源性過氧化物酶活性后,加10%山羊血清封閉,PRDX3鼠抗人單克隆抗體(工作濃度1∶100),于4 ℃過夜,DAB染色,蘇木精復染細胞核,封片,顯微鏡觀察。染色結果判斷:PRDX3抗體定位于細胞胞質或出現于細胞膜上,出現棕黃色或棕褐色顆粒為陽性細胞。陽性細胞數:<5%,記為0分;5%~<25%,染色淡黃色,記1分;25%~<50%,染色黃色,記2分;50%~75%,染色棕黃色,記3分;>75%,染色棕褐色,記4分;根據陽性細胞染色強度判定,細胞無著色為0分,淡黃色為1分,棕黃色為2分,棕褐色為3分。將兩者積分的乘積作為評判標準[6]:得分0分為陰性(-),1~4分為弱陽性(+),6和8分為陽性(++),9分及以上為強陽性(+++)。統計時將弱陽性、陽性、強陽性計算為陽性結果。
1.4預后隨訪 術后對所有患者進行電話或門診隨訪,隨訪期限是3年,隨訪起始時間為術后第1天,隨訪截止日期為2021年6月30日,觀察患者生存情況,患者無失訪。

2 結 果
2.1結腸癌組織與正常結腸黏膜組織中miR-383及PRDX3 mRNA表達水平比較 與正常結腸黏膜組織比較,結腸癌組織中miR-383表達水平顯著降低,PRDX3 mRNA表達水平顯著升高,差異均有統計學意義(P<0.05),見表2。
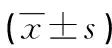
表2 結腸癌組織與正常結腸黏膜組織中miR-383及PRDX3 mRNA表達水平比較
2.2結腸癌組織與正常結腸黏膜組織中PRDX3蛋白陽性表達率比較 免疫組織化學染色結果顯示,PRDX3蛋白主要定位于細胞膜與細胞質,結腸癌組織中PRDX3蛋白陽性表達率顯著高于正常結腸黏膜組織,差異有統計學意義(P<0.05),見圖1、表3。

表3 結腸癌組織與正常結腸黏膜組織中PRDX3蛋白陽性表達率比較

圖1 結腸癌組織與正常結腸黏膜組織中PRDX3表達(×200)
2.3結腸癌組織中miR-383和PRDX3 mRNA表達水平的相關性 結腸癌組織中miR-383表達水平和PRDX3 mRNA呈負相關(r=-0.616,P<0.001),見圖2。通過TargetScanHuman軟件預測顯示,miR-383和PRDX3存在靶向結合位點,見圖3。

圖2 結腸癌組織中miR-383和PRDX3 mRNA關系的散點圖

圖3 miR-383和PRDX3靶向關系預測
2.4miR-383和PRDX3表達水平與結腸癌臨床病理特征的關系 以結腸癌組織中miR-383表達水平的平均值(0.67)為界,將結腸癌患者分為miR-383高表達組(≥0.67)42例和miR-383低表達組(<0.67)43例;以PRDX3蛋白免疫組織化學染色結果將結腸癌患者分為PRDX3高表達組(染色結果為++和+++)43例和PRDX3低表達組(染色結果為-和+)42例;分析發現,miR-383、PRDX3表達水平與患者性別、年齡、腫瘤最大徑、浸潤深度無關(P>0.05),與腫瘤分化程度、TNM分期和淋巴結轉移有關(P<0.05),見表4。

表4 miR-383和PRDX3表達水平與結腸癌臨床病理特征的關系[n(%)]
2.5miR-383和PRDX3表達與結腸癌患者生存率的關系 隨訪3年,患者生存44例,死亡41例;通過Kaplan-Meier生存分析可知,miR-383高表達組結腸癌患者3年累積生存率28/42(66.67%)顯著高于miR-383低表達組16/43(37.21%)(χ2=5.903,P=0.015);PRDX3高表達組結腸癌患者3年累積生存率17/43(39.53%)顯著低于PRDX3低表達組27/42(64.29%)(χ2=5.213,P=0.022),見圖4。

圖4 Kaplan-Meier生存分析注:A為不同miRNA-383表達水平結腸癌患者生存曲線;B為不同PRDX3表達水平結腸癌患者生存曲線。
2.6結腸癌患者預后影響因素分析 Cox回歸模型單因素分析結果顯示,影響結腸癌患者不良預后危險因素為低分化、淋巴結轉移、miR-383低表達、PRDX3高表達(P<0.05),而性別、年齡、腫瘤最大徑、TNM分期、浸潤深度與結腸癌患者預后無關(P>0.05);多因素分析結果顯示,結腸癌低分化、淋巴結轉移、miR-383低表達、PRDX3高表達是結腸癌患者不良預后的獨立危險因素(P<0.05),見表5。

表5 影響結腸癌患者不良預后的危險因素分析
3 討 論
結腸癌是我國常見的惡性腫瘤,發病率呈逐年升高趨勢,尤以中老年人發病居多,是影響生命安全的主要惡性腫瘤之一[7]。研究結腸癌的發病機制,對尋找其有效治療手段和預后評估方法具有重要意義。miRNAs在細胞增殖、分化、生長、發育等多種過程中發揮重要作用,其表達異常與多種腫瘤發生發展有關[8-9]。研究表明,miR-383在多種腫瘤組織或細胞中表達下調,可影響腫瘤細胞增殖、侵襲和遷移[10-12]。WAN等[13]研究結果表明,miR-383通過干擾素調節因子1,參與調節膽管癌細胞的增殖、遷移和侵襲。ZHU等[14]研究表明,miR-383在胃癌組織中表達顯著降低,且與胃癌患者的晚期進展相關,功能分析表明,miR-383過表達可抑制胃癌細胞增殖并促進其凋亡。研究結果顯示,miR-383在結腸癌組織與細胞中低表達,發揮抑癌基因的作用,上調miR-383表達可抑制結腸癌細胞的增殖、遷移與侵襲[15-16]。最新研究結果顯示,miR-383表達與結腸癌TNM分期和淋巴結轉移有關[17]。本研究結果顯示,在結腸癌組織中miR-383表達水平低于正常結腸黏膜組織,與以往報道結果類似[15-16]。本研究分析發現,miR-383表達與TNM分期及淋巴結轉移有關,與趙亮等[17]研究結果一致,本研究還發現,miR-383表達與結腸癌分化程度有關,提示miR-383可能與結腸癌發生、發展有關,miR-383可能通過參與調控結腸癌細胞的增殖、遷移與侵襲而參與結腸癌的發生、發展。
PRDX3作為PRDXs家族成員之一,在細胞抗氧化及細胞增殖分化等生理病理過程中具有重要作用,有研究表明,PRDX3在多種腫瘤組織中存在高表達[18-19]。陳錫彬等[6]研究表明,PRDX3在前列腺癌組織中表達比良性前腺增生組織中高,有可能成為鑒別前列腺癌與良性前列腺增生的新型腫瘤標記物。SHI等[20]研究表明,PRDX3在肝細胞癌患者血清中表達水平升高,血清PRDX3表達水平與甲胎蛋白水平、腫瘤直徑、TNM分期和門靜脈侵犯密切相關,與患者生存率呈負相關。BYUN等[21]研究表明,與正常子宮內膜組織比較,PRDX3在子宮內膜癌中高表達,可能與預后不良有關。張大偉等[22]研究顯示,PRDX3在結腸癌組織中陽性表達率為63.16%,且與腫瘤最大徑、浸潤深度、脈管內瘤栓密切相關。本研究結果顯示,結腸癌組織中PRDX3 mRNA表達水平顯著高于正常結腸黏膜組織,且結腸癌組織中PRDX3蛋白陽性表達率為64.71%,高于正常結腸黏膜組織的29.55%,這與張大偉等[22]研究結果一致。本研究分析了PRDX3與臨床病理特征的關系,結果顯示,PRDX3表達水平與腫瘤分化程度、TNM分期和淋巴結轉移有關,提示PRDX3可能促進結腸癌的發生、發展。
王少增等[23]研究表明PRDX3在人髓母細胞瘤組織、人髓母瘤細胞系中存在過表達情況,而miR-383可能通過下調PRDX3表達水平來抑制人髓母瘤細胞系的增殖,并促進其凋亡。本研究結果顯示,結腸癌組織中miR-383表達水平和PRDX3 mRNA呈負相關,經TargetScanHuman軟件預測顯示,miR-383和PRDX3存在靶向結合位點,提示miR-383靶向調控PRDX3促進結腸癌的發生、發展。本研究還發現,miR-383高表達組結腸癌患者3年累積生存率顯著高于miR-383低表達組患者;PRDX3高表達組結腸癌患者3年累積生存率顯著低于PRDX3低表達組患者,提示miR-383、PRDX3可能通過調控腫瘤發展影響患者預后情況。進一步研究發現,結腸癌低分化、淋巴結轉移、miR-383低表達、PRDX3高表達是結腸癌患者不良預后的獨立危險因素,提示miR-383、PRDX3可能作為評估結腸癌患者不良預后的生物標志物。
綜上所述,結腸癌組織中miR-383低表達、PRDX3高表達,且與患者腫瘤分化程度、TNM分期、淋巴結轉移及生存情況有關,可能作為結腸癌患者預后評估的分子標志物。

