腎癌中COL1A1的表達對臨床預后的價值及其與免疫浸潤的相關性分析
李 媛 孫景芬 張 玲 王 揚 李 妍
腎癌是泌尿系統常見的腫瘤之一,近二十年來其發病率呈上升趨勢,占所有新發腫瘤病例的2%~3%。腎細胞癌是最常見的腎癌,大約包括85%的腎癌病例[1-2]。盡管腎細胞癌在診斷、篩查、手術和藥物治療方面取得了一定進展,但其臨床結果仍令人不滿意[3]。因此,尋找有效的生物標記物,特別是目前的免疫療法,將有助于提高腎細胞癌的臨床治療效果。
COL1A1是膠原蛋白家族成員之一,參與I型膠原蛋白的編碼,主要調節細胞間的黏附和分化[4]。在成骨、骨質疏松及骨疾病中發揮一定作用。研究發現,COL1A1在多種腫瘤中呈高表達狀態,包括乳腺癌和胃癌等[5],然而,COL1A1在腎癌中的研究還不是很清楚。本研究通過在線數據庫挖掘COL1A1在腎癌中的表達,并評估其對腎癌患者預后的生存價值。
材料及方法
1.腎透明細胞癌患者臨床數據的收集
UALCAN(http://ualcan.path.uab.edu/)[6]數據庫應用于癌癥轉錄組數據的分析,提供基于基因表達和已發布的生存信息的描述。本實驗利用UALCAN數據獲得泛癌中COL1A1的表達水平。通過在線TCGA數據庫(https://portal.gdc.cancer.gov/)[7]獲取腎透明細胞癌患者基因表達及生存預后的數據。所有明確診斷為腎透明細胞癌的患者均被納入統計分析,腎透明細胞癌患者癌組織標本539例,癌旁組織標本72例。
2.COL1A1與免疫浸潤的關系
從TIMER2.0數據庫獲得腎透明細胞癌中COL1A1的表達與免疫細胞浸潤的關系數據。TIMER2.0是分析不同類型癌癥免疫浸潤的綜合數據庫(https://cistrome.shinyapps.io/timer/)[8-9]。從基因表達譜推斷腫瘤浸潤免疫細胞(TIICs)的峰度值。TIMER數據庫包括來自癌癥基因組圖譜(TCGA)的32種癌癥類型的10897個樣本,以估計免疫浸潤的峰度。我們利用基因模塊分析了COL1A1在KIRC中的表達,并分析了COL1A1表達與免疫浸潤(包括B細胞、CD4+T細胞、CD8+T細胞、中性粒細胞、巨噬細胞、樹突狀細胞、單核細胞及NK細胞)峰度的關系。抗腫瘤純度的基因表達水平借鑒已有文獻[10-11]。
3.統計學分析
在R語言安裝ggplot2包的條件下,分析COL1A1在腎透明細胞癌患者中的表達情況,survival包用于生存資料的統計分析[7]。log-rank檢驗[12]分析各組的生存時間分布差異;卡方檢驗分析COL1A1與腎透明細胞癌患者臨床病理分組的關系。P<0.05視為結果具有統計學差異。
結 果
1.COL1A1在泛癌中的表達情況
從TCGA數據庫中獲得COL1A1在泛癌中的表達水平,結果顯示COL1A1在乳腺癌、膽管癌、胃癌、肺腺癌及腎癌等患者中高表達,在宮頸癌、胸腺瘤及子宮內膜癌中呈低表達狀態(圖1)。
2.COL1A1在腎透明細胞癌中的表達情況
為了探討COL1A1在腎透明細胞癌中的作用,利用TCGA數據庫獲得COL1A1在腎透明細胞癌中的表達情況,結果顯示,COL1A1在腎透明細胞癌中呈高表達狀態,相比健康對照組,差異具有統計學意義(P<0.001,圖2)。
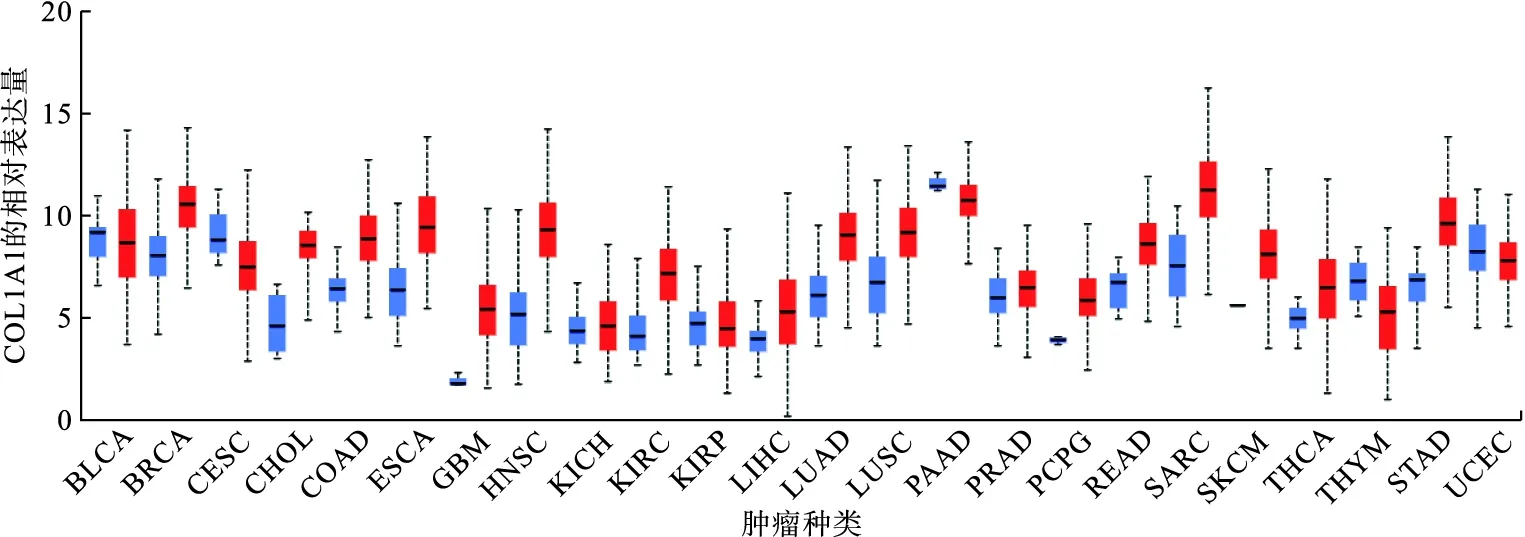
圖1 COL1A1在泛癌中的表達
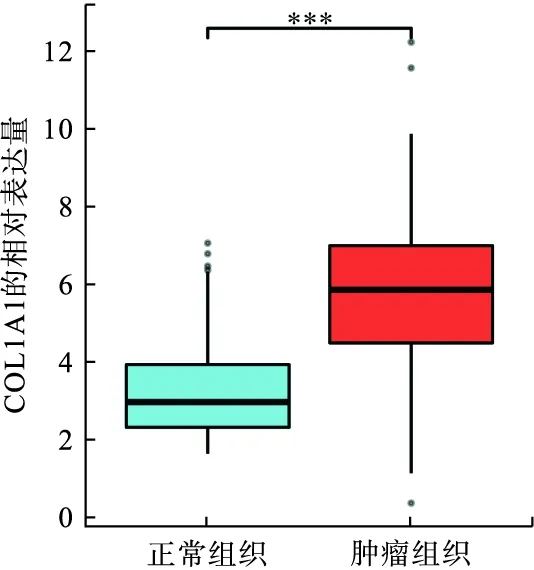
圖2 COL1A1在腎透明細胞癌中的表達
3.腎透明細胞癌患者COL1A1的表達對生存預后的影響
為探討腎透明細胞癌患者COL1A1的表達水平與生存預后的關系,本實驗選取了20年生存期的數據進行分析。結果顯示,高表達COL1A1腎透明細胞癌患者相比低表達COL1A1患者具有更好的臨床預后,即COL1A1的表達與腎透明細胞癌患者20年的預后生存率相關(P=0.001,圖3)。
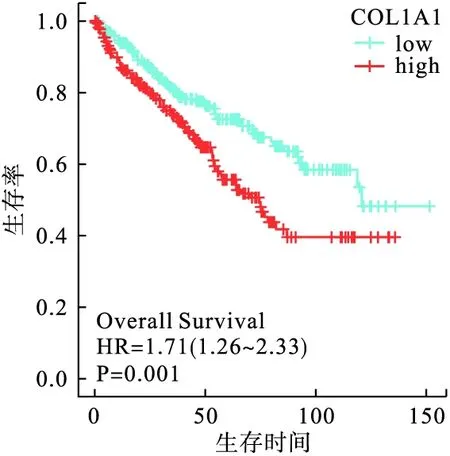
圖3 COL1A1的表達水平與總生存期的相關性
log-rank的檢驗結果顯示,腎透明細胞癌患者的生存時間分布和正常對照組相比,差異具有統計學意義(P<0.001,表1)。

表1 生存時間分布統計表
對于預后的單因素Cox回歸分析結果顯示,COL1A1對腎透明細胞癌的預后診斷具有一定的預測價值(表2)。
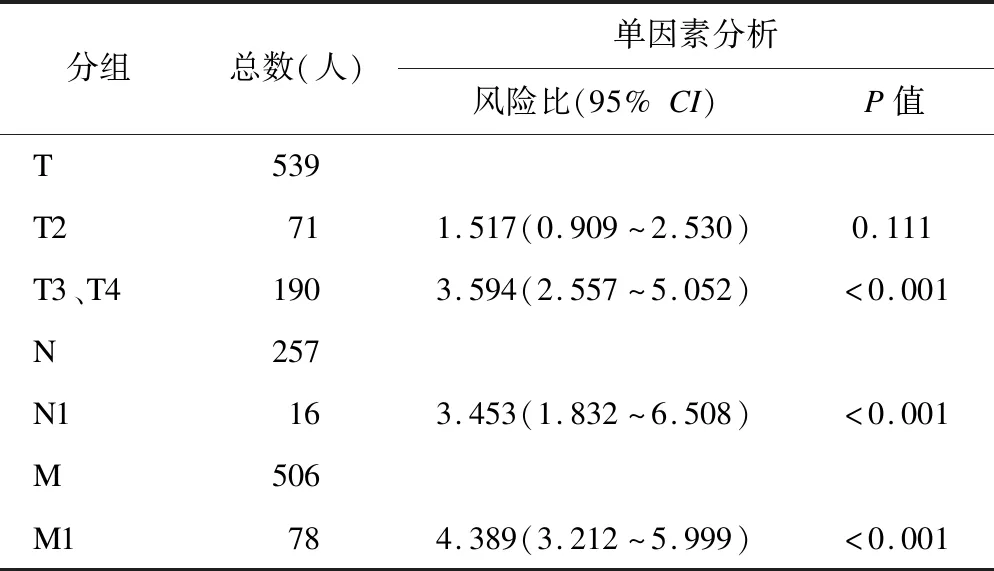
表2 單因素Cox回歸分析結果
4.COL1A1表達與臨床病理分組的相關性
從數據庫中獲得的臨床病理數據,其中高表達COL1A1患者270例,低表達COL1A1患者269例。數據統計結果顯示,COL1A1的表達水平與腎透明細胞癌的T分期、N分期及年齡存在一定的相關性(P<0.05),與腎透明細胞癌的M分期無明顯相關性(P>0.05,表3)。
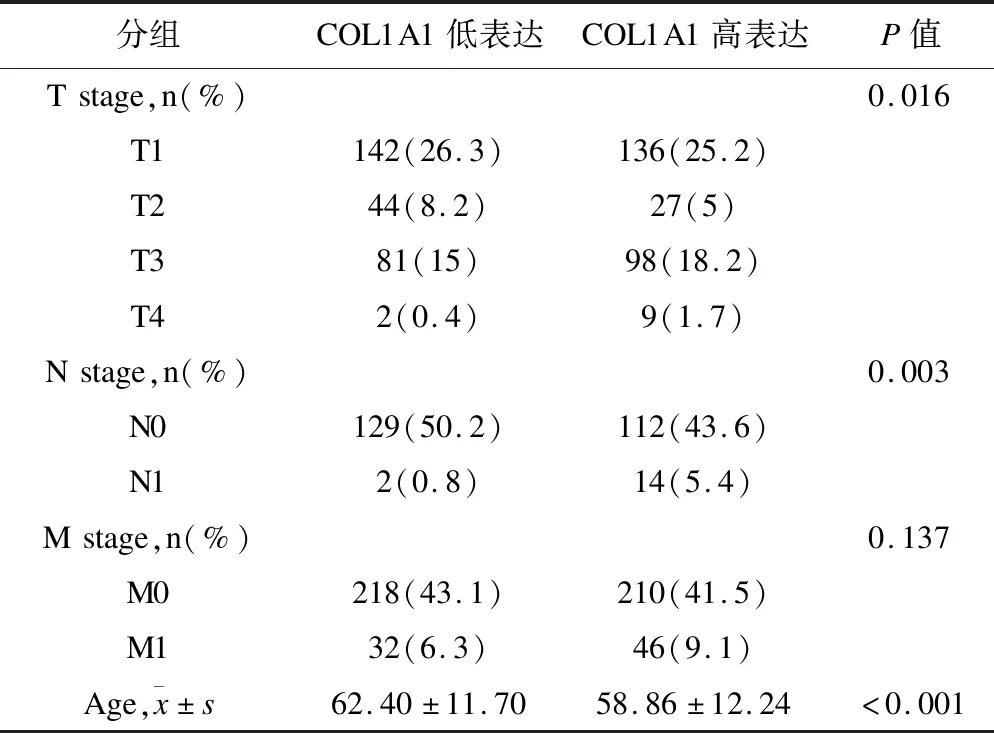
表3 COL1A1的表達與臨床病理參數的相關性
5.COL1A1對腎透明細胞癌的診斷價值
ROC曲線結果顯示,1年生存期AUC=0.631,2年生存期AUC=0.589,3年生存期AUC=0.570,表明COL1A1對腎透明細胞癌的診斷具有一定的臨床價值(圖4)。
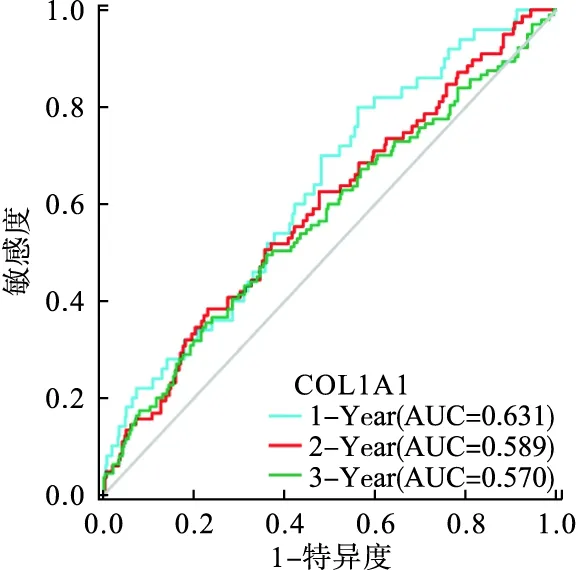
圖4 COL1A1的ROC曲線
6.腎透明細胞癌患者COL1A1的表達與免疫浸潤的關系
腫瘤浸潤免疫細胞作為腫瘤微環境的重要組成部分,與腫瘤的發生、進展及轉移密切相關。抗腫癌純度的基因表達水平如圖5所示。腎透明細胞癌中COL1A1與CD4細胞、DC細胞、NK細胞、巨噬細胞、單核細胞及中性粒細胞表達呈正相關(P<0.05),與B細胞表達呈負相關(P<0.05),與CD8表達無明顯相關性(P>0.05)(圖5)。
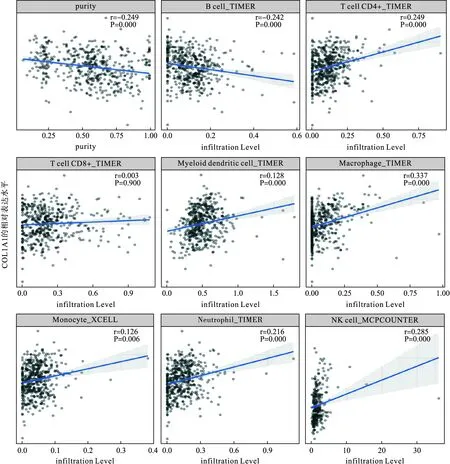
圖5 COL1A1的表達與免疫浸潤的關系
討 論
哺乳動物細胞中,Ⅰ型膠原蛋白含量豐富,是由2條COL1A1基因編碼的α1鏈和1條COL1A2基因編碼的α2鏈組成的三螺旋結構。I型膠原纖維主要參與形成細胞外基質,對細胞的粘附及分化有重要作用,由于腫瘤細胞間的粘附作用普遍降低,因此促進了腫瘤細胞的遷移[13]。研究發現,COL1A1參與了谷氨酰胺介導的胰腺癌與星狀細胞的相互作用[14]。沉默COL1A1的表達可以抑制小鼠結直腸腫瘤的原位生長[15]。另外,細胞學實驗發現,干擾COL1A1的表達抑制了肝癌的克隆、侵襲及轉移[16]。這些研究表明,COL1A1在多種腫瘤的形成及代謝中發揮重要作用。然而,COL1A1在腎癌中的研究甚少。
本研究通過TCGA數據庫獲得的數據分析結果顯示,在mRNA水平上,與癌旁組織相比,COL1A1在腎透明細胞癌中呈明顯高表達狀態(P<0.05),其表達水平與其預后呈負相關(P<0.05)。Cox回歸分析和ROC曲線結果提示,COL1A1對腎透明細胞癌的預后診斷具有預測價值。COL1A1的表達水平與腎透明細胞癌的T分期、N分期及年齡存在一定的相關性。表明COL1A1對腎透明細胞癌的臨床診斷及預后評估具有一定的臨床價值,是否能作為診斷標志物還有待進一步分析。
免疫反應與臨床預后密切相關,腫瘤浸潤免疫細胞(TIIC)形成一個生態系統,腫瘤微環境對腫瘤的進展有調節作用,TIIC對于腫瘤的預后研究具有一定的價值。細胞毒性CD8+T細胞和CD4+輔助T細胞可以靶向腫瘤抗原細胞抑制腫瘤生長。CD4+T細胞浸潤后可以通過TGFβ1/YBX1/HIF2α信號調節多種腫瘤細胞的增殖[17]。腫瘤浸潤淋巴細胞是腫瘤淋巴結狀態和生存的獨立預測因子[18]。微環境基質中的癌相關成纖維細胞參與了多種腫瘤浸潤免疫細胞的功能。本研究應用TIMER2.0評估了腎透明細胞癌中COL1A1表達與免疫浸潤水平之間的關系。通過分析發現,COL1A1表達與腫瘤純度呈顯著負相關,與CD4+T細胞、巨噬細胞、中性粒細胞、DC細胞、單核細胞及中性粒細胞浸潤水平呈顯著正相關,與B細胞浸潤水平呈負相關,但與CD8+T細胞浸潤水平無顯著相關性。
因此,本研究得出結論,低表達COL1A1的腎透明細胞癌患者具有較好的臨床預后。COL1A1的表達與免疫細胞浸潤水平有關。這一結果為尋找腎透明細胞癌的診斷標志物、治療靶點及預后評估的指標確定提供一定的理論依據。

