堿蓬根際和內生細菌菌株對鹽堿脅迫下苜蓿生長的影響
苗陽陽,張艷蕊,宋標,劉旭桐,張安琪,呂金澤,張浩,張小華,歐陽佳慧,李旺,曲善民
(黑龍江八一農墾大學動物科技學院草業科學系,黑龍江省寒區飼料資源高效利用與營養調控重點實驗室,黑龍江 大慶 163319)
土地鹽堿化治理已成為全球農業最重要的問題之一,鹽分會導致耕地面積、作物生產力和作物質量大幅度下降[1]。近年來,隨著氣候變化和人類生產活動的影響,土壤鹽堿化程度進一步加重。鹽堿化影響了全世界20%的耕地,嚴重威脅著農牧業生產和生態環境的建設[2-3]。大慶地處松嫩平原西部,黑龍江省西南部,其土壤主要為蘇打鹽堿化草甸土和沼澤化草甸土。近年來,由于油田開發和其他人為因素的影響,土壤鹽堿化逐漸加重[4]。堿蓬(Suaeda glauca)是藜科(Chenopodiaceae)堿蓬屬(Suaeda)植物,對鹽堿具有高度適應性,能保護和改良土壤、消除裸露鹽堿荒灘,防止水土流失,對保持和重建鹽堿地生態有重要作用,被譽為鹽堿地改造的“先鋒植物”[5-6]。堿蓬作為真鹽生植物,體內鹽含量相對較高,而絕大多數微生物生長在低鹽環境中,因此推測堿蓬內生菌屬于極端微生物之一的嗜鹽微生物,其內生細菌和根際細菌具有特殊的生理生化性質,具有較高的研究價值[7]。
在當前“綠水青山就是金山銀山”的生態理念下,資源節約和環境保護已成為我國發展的基本國策,綠色生態也成為現代農業發展的內在要求。鑒于此,人們一直在努力尋找新的生物治理途徑——在不投入巨資改變鹽堿地原有性狀的前提條件下,通過微生物與植物的相互作用來提高植物的耐鹽堿性,改善鹽堿土狀況,其有望成為利用鹽堿地的新措施。植物促生細菌(plant growth promoting bacteria,PGPB)包括植物根際促生細菌(plant rhizosphere growth promoting bacteria,PGPR)和定殖于植物體內的內生細菌,可促進植物生長及其對礦物質營養的吸收和利用,是一類可抑制有害生物的有益菌株[8-9],可有效減輕植物的鹽堿脅迫損傷。合理施用PGPB可促進植物生長,提高作物產量及通過誘導植物產生系統抗性來抵御生物和非生物脅迫[10]。由于鹽堿地土壤含鹽量和pH都較高,酸性和中性土壤中篩選得到的PGPB在鹽堿環境中很難存活定殖,在酸性、中性土壤中有很好促生效果的菌株在鹽堿土中很難發揮促生作用,所以普通促生細菌在鹽堿地應用困難。近年來耐鹽堿促生細菌促進鹽堿脅迫下植物生長的研究備受關注,研究發現接種含ACC脫氨酶(1-氨基環丙烷-1-羧酸脫氨酶)活性的根際促生菌可緩解鹽堿脅迫,減緩植物體內乙烯積累,增加作物產量[11-12]。向君亮等[13]發現在鹽堿脅迫條件下,將從大慶草原鹽堿土中分離出的耐鹽堿堀越氏芽孢桿菌(Bacillus horikoshii)S11浸種苜蓿(Medicago sativa)后,能顯著促進苜蓿種子的萌發及幼苗的生長。劉佳莉[14]從鹽堿土植物根際篩選的促生細菌可以增加鹽堿地大田中紫花苜蓿的生物量,提高紫花苜蓿的品質。
紫花苜蓿素有“牧草之王”的美譽,具有一定的耐鹽堿能力,適當的鹽堿脅迫不會對苜蓿的產量和營養品質造成影響,而中、重度鹽堿會抑制苜蓿生長[15]。隨著草原以及耕地土壤鹽堿化程度的加劇,可種植苜蓿的土地面積也逐漸減少[16]。因此提高苜蓿的耐鹽堿能力對我國畜牧業發展和鹽堿地改良具有重要意義。本試驗應用前期篩選的堿蓬根際促生細菌和內生細菌澆灌紫花苜蓿幼苗根部,并根據松嫩平原鹽堿地鹽堿成分情況,以中性鹽(NaCl、Na2SO4)和堿性鹽(NaHCO3、Na2CO3)按NaCl∶Na2SO4∶NaHCO3∶Na2CO3=9∶1∶1∶9混合,并設置0、100、150、200 mmol·L-1鹽堿濃度脅迫苜蓿幼苗,研究堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿幼苗生長及生理的影響,為提高苜蓿耐鹽堿性,改善鹽堿脅迫對苜蓿生長及生理影響提供依據,為研制和開發鹽堿土壤生物制劑奠定基礎。
1 材料與方法
1.1 材料
1.1.1 堿蓬采樣區概況 鹽堿樣地位于黑龍江省大慶市采油三廠第五礦區周圍草地,地理位置為46°41′-46°42′N,124°59′-124°60′E,試驗于2019年6月采樣。該地屬于大陸性半干旱溫帶草原氣候,降水量最大時期為7月。土壤為鹽堿土,pH為8.7~9.3,主要優勢植物有堿蓬、鵝觀草(Roegneria kamoji)、羊草(Leymus chinensis)、大籽蒿(Artemisia sieversiana)等。
1.1.2 供試菌株 分別為前期從上述鹽堿地采樣區采集的堿蓬根內、根際土壤及莖內分離的JG1、JT4和JJ5(表1),經鑒定后保存在黑龍江八一農墾大學草業科學實驗室。

表1 堿蓬根際細菌和內生細菌菌株Table 1 Rhizobacteria and endophytic bacteria of S.glauca
1.1.3 供試種子 紫花苜蓿種子龍牧801(M.sativaLongmu No.801)由黑龍江省畜牧研究所提供,保存于黑龍江八一農墾大學草業科學實驗室。
1.1.4 培養基 LB液體培養基[17]。
1.2 方法
1.2.1 菌懸液制備 將分離自堿蓬根際土壤及不同組織的細菌菌株JG1、JT4和JJ5接種于LB液體培養基,于28℃、180 r·min-1搖床培養,待菌體濃度達到106cfu·mL-1時終止培養。
1.2.2 苜蓿幼苗培養及處理 細沙洗凈150℃高溫持續烘干5 h后,121℃滅菌26 min,連續滅菌5次,待冷卻后裝入75%乙醇消毒且杯底扎有網眼的塑料杯(直徑5.0 cm,高11.5 cm),將其放入水培盒中(長24 cm,寬15 cm,高5 cm,350 g·杯-1)。選取顆粒飽滿且大小一致的苜蓿種子消毒(75%浸泡30 s,用無菌水每次1 min清洗4~5次)后于人工氣候培養箱內進行催芽后移栽至塑料杯中。每處理水培盒內加200 mL Hoagland有氮營養液,使其從杯底由下至上浸濕[18],幼苗生長過程中用無菌蒸餾水補充水分。
待苜蓿幼苗長出真葉后,每杯定苗15株,幼苗根部澆灌堿蓬根際促生細菌和內生細菌菌懸液,25 mL·杯-1,澆灌7 d后將NaCl、Na2SO4、NaHCO3、Na2CO3按照9∶1∶1∶9鹽堿比例混合,鹽堿溶液濃度為0、100、150、200 mmol·L-1,25 mL·杯-1澆灌苜蓿幼苗根部。每15 d澆灌200 mL Hoagland無氮營養液,自然光照45 d收獲幼苗測定相關指標。
1.3 測定指標
1.3.1 鹽堿脅迫下苜蓿生長指標和生物量的測定 隨機選5株紫花苜蓿用直尺測量絕對高度和分枝數。分別測量地上和根部鮮重[19-20]。各指標重復測定3次。
1.3.2 鹽堿脅迫下苜蓿根系耐鹽堿性生理指標的測定 采用愈創木酚法測定過氧化物酶(peroxidase,POD)活性;采用氮藍四唑(nitroblue tetrazolium,NBT)顯色法測定超氧化物歧化酶(superoxide dismutase,SOD)活性;采用硫代巴比妥酸(thiobarbituric acid,TBA)法測定丙二醛(malondialdehyde,MDA)含量;采用酸性茚三酮比色法測定脯氨酸含量,以上試驗方法參考《植物生理學實驗指導》[21]。
1.3.3 鹽堿脅迫下苜蓿葉片葉綠素含量的測定 采用SPAD-502Plus葉綠素儀(KONICA MINOLTA,INC公司)測定葉片葉綠素含量。
1.3.4 綜合耐鹽堿性評價指標 采用隸屬函數綜合評價法,對與抗性呈正相關參數的株高、分枝數、地上和根鮮重、脯氨酸、POD、SOD、葉綠素采用公式:Fi=(Xi-Xmin)/(Xmax-Xmin)計算;對與抗性呈負相關參數的MDA,采用公式:Fi=1-(Xi-Xmin)/(Xmax-Xmin)計算。式中:Xi為i個指標值;Xmin為i指標的最小值;Xmax為i指標的最大值。然后分別對細菌菌株處理的紫花苜蓿耐鹽堿隸屬函數值進行累加,求平均值后得到該處理的隸屬度值,隸屬度值越大,該細菌菌株對鹽堿脅迫下紫花苜蓿促生效果越好。
為篩選促生細菌對紫花苜蓿耐鹽堿性的主要對比指標,對鹽堿脅迫下紫花苜蓿各單項指標的耐鹽系數ω分別進行主成分分析,其計算公式如下:ω=不同鹽堿脅迫處理濃度下的單項指標平均測定值/對照組測定值。
1.4 數據分析
采用Excel 2020進行數據整理和作圖。采用SPSS 26.0軟件進行單因素方差分析(P<0.05),試驗數據以“平均值±標準誤”表示,采用Duncan’s法進行多重比較。
2 結果與分析
2.1 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿生長和生物量的影響
2.1.1 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿株高的影響 如圖1所示,鹽堿濃度為0 mmol·L-1時 ,經JT4處 理 后 苜 蓿 株 高 顯 著 高 于CK(P<0.05),提高26.83%;100 mmol·L-1時,經JG1、JT4和JJ5處理后苜蓿株高均升高,但與CK均無顯著差異(P>0.05);150 mmol·L-1時,經JG1和JT4處理后苜蓿株高顯著高于CK(P<0.05),分別提高122.64%和69.81%;200 mmol·L-1時,經JG1、JT4、JJ5處理后苜蓿株高顯著高于CK(P<0.05),分別提高130.30%、196.97%和139.39%。
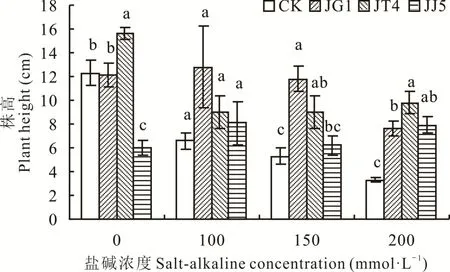
圖1 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿株高的影響Fig.1 Effects of S.glauca rhizosphere growth-promoting bacteria and endophytic bacteria on plant height of alfalfa under salt-alkaline stress
2.1.2 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿分枝數的影響 如圖2所示,鹽堿濃度為0 mmol·L-1時,經JG1、JT4、JJ5處理后苜蓿分枝數均高于CK,其中經JT4處理后分枝數顯著高于CK(P<0.05),提高50.00%;100和150 mmol·L-1時,經JG1、JT4和JJ5處理后苜蓿分枝數均高于CK,但無顯著差異(P>0.05);200 mmol·L-1時,經JG1、JT4、JJ5處理后苜蓿分枝數顯著高于CK(P<0.05),分別提高100.00%、50.00%和100.00%。
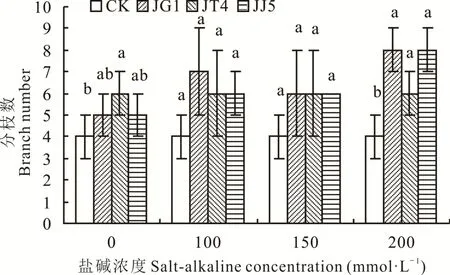
圖2 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿分枝數的影響Fig.2 Effects of S.glauca rhizosphere growth-promoting bacteria and endophytic bacteria on branches number of alfalfa under salt-alkaline stress
2.1.3 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿鮮重的影響 不同鹽堿濃度脅迫下,隨鹽堿濃度的升高苜蓿地上鮮重呈下降趨勢,經JG1、JT4和JJ5處理后苜蓿的地上鮮重均提高(表2)。在鹽堿濃度為0 mmol·L-1時,經JT4處理后苜蓿地上鮮重顯著高 于CK(P<0.05),提 高317.64%;100 mmol·L-1時,經JJ5處理后苜蓿地上鮮重顯著高于CK(P<0.05),提高149.93%;150 mmol·L-1時,經JG1、JT4、JJ5處理后,苜蓿地上鮮重均顯著高于CK(P<0.05),分別提高156.38%、86.11%和57.25%;200 mmol·L-1時,經JG1、JT4、JJ5處理后苜蓿地上鮮重均顯著高于CK(P<0.05),分別提高315.04%、136.58%和248.81%。

表2 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿地上鮮重的影響Table 2 Effects of S.glauca rhizosphere growth-promoting bacteria and endophytic bacteria on the aboveground fresh weight of alfalfa under salt-alkaline stress(g·5 plant-1)
隨鹽堿濃度的升高苜蓿根鮮重呈先上升后下降趨勢,經JG1、JT4和JJ5處理后苜蓿根鮮重均提高(表3)。在鹽堿濃度為0 mmol·L-1時,經JT4處理后根鮮重顯著高于CK(P<0.05),提高486.09%;100 mmol·L-1時,經JG1和JJ5處理后,根鮮重顯著高于CK(P<0.05),分別提高109.84%和263.66%;150 mmol·L-1時,經JG1、JT4、JJ5處理后苜蓿根鮮重均顯著高于CK(P<0.05),分別提高182.97%、251.29%和1070.63%;200 mmol·L-1時,經JG1和JJ5處理后根鮮重顯著高于CK(P<0.05),分別提高914.80%和778.75%。
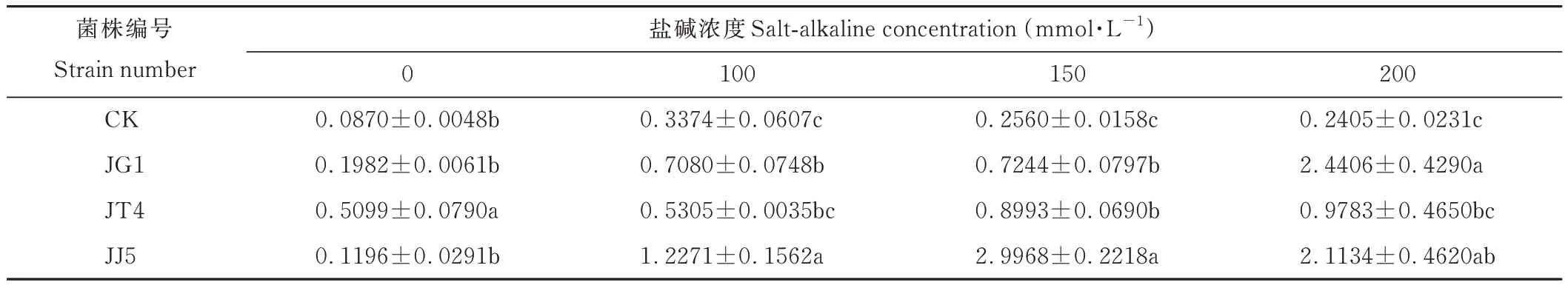
表3 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿根鮮重的影響Table 3 Effects of S.glauca rhizosphere growth-promoting bacteria and endophytic bacteria on root fresh weight of alfalfa under salt-alkaline stress(g·5 plant-1)
2.2 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿根系生理指標的影響
2.2.1 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿過氧化物酶(POD)活性的影響 隨鹽堿濃度的升高苜蓿POD活性呈先上升后下降趨勢,經JG1、JT4和JJ5處理后苜蓿的POD活性均提高(圖3)。在鹽堿濃度為0 mmol·L-1時,經JG1、JT4和JJ5處理后苜蓿POD活性均顯著高于CK(P<0.05),分別提高58.91%、93.46%和58.57%;100 mmol·L-1時,經JG1、JT4和JJ5處理后苜蓿POD活性均高于CK,但無 顯 著 差 異(P>0.05);150 mmol·L-1時 ,經JG1、JT4和JJ5處理后,苜蓿POD活性均顯著高于CK(P<0.05),分別提高51.21%、65.38%和71.15%;200 mmol·L-1時,經JG1、JT4和JJ5處理后,苜蓿POD活性均顯著高于CK(P<0.05),分別提高213.57%、162.51%和250.21%。

圖3 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿POD活性的影響Fig.3 Effects of S.glauca rhizosphere growth-promoting bacteria and endophytic bacteria on POD activity of alfalfa under salt-alkaline stress
2.2.2 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿超氧化物歧化酶(SOD)活性的影響 如圖4所示,鹽堿 濃 度 為0 mmol·L-1時 ,經JT4和JJ5處 理 后 苜 蓿SOD活 性 顯 著 高 于CK(P<0.05),分 別 提 高57.34%和70.36%;100 mmol·L-1時,經JT4處理后苜蓿SOD活性顯著高于CK(P<0.05),提高70.33%;150 mmol·L-1時,JG1、JT4和JJ5均能顯著提高苜蓿SOD活性(P<0.05),分別提高40.90%、132.75%和0.14%;200 mmol·L-1時 ,JG1和JT4處 理 后 苜 蓿SOD活 性 顯 著高于CK(P<0.05),分別提高54.40%和110.69%。
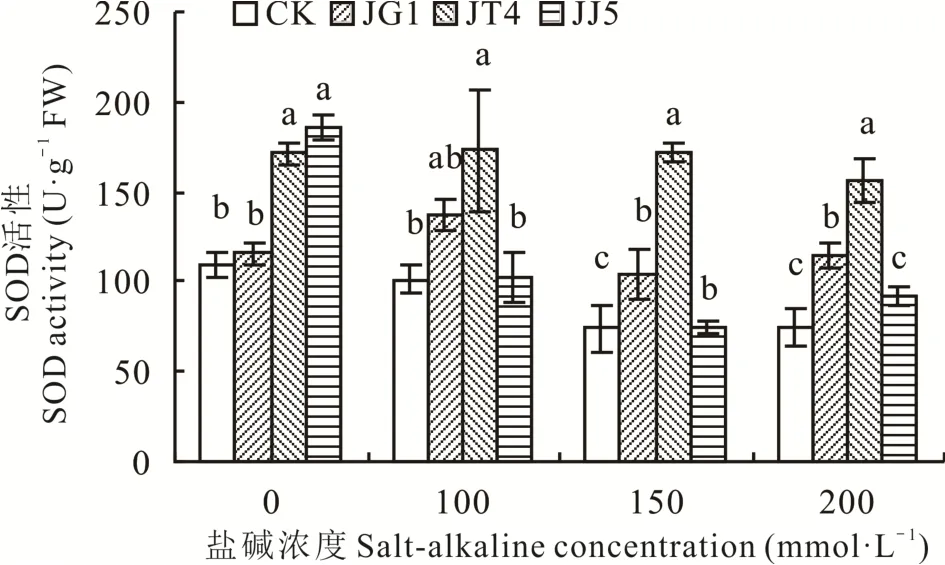
圖4 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿SOD活性的影響Fig.4 Effects of S.glauca rhizosphere growth-promoting bacteria and endophytic bacteria on SOD activity of alfalfa under salt-alkaline stress
2.2.3 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿丙二醛(MDA)含量的影響 如圖5所示,在鹽堿 濃 度 為0和100 mmol·L-1時 ,除 鹽 堿 濃 度 為0 mmol·L-1時接種JG1后苜蓿MDA含量顯著低于CK(17.35%)(P<0.05)外,其余處理的MDA含量均顯著高于CK(P<0.05)。150 mmol·L-1時,JT4處理后苜蓿MDA含量顯著低于CK(11.28%)(P<0.05)。200 mmol·L-1時,經JG1、JT4和JJ5處理后苜蓿MDA含量與CK均無顯著差異(P>0.05)。
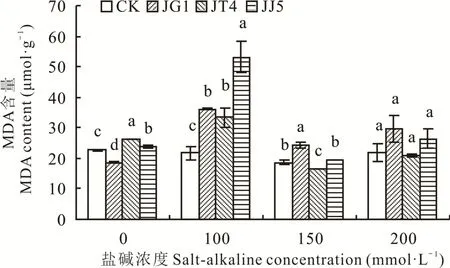
圖5 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿MDA含量的影響Fig.5 Effects of S.glauca rhizosphere growth-promoting bacteria and endophytic bacteria on MDA content of alfalfa under salt-alkaline stress
2.2.4 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿脯氨酸含量的影響 如圖6所示,在鹽堿脅迫下隨著濃度的升高苜蓿脯氨酸含量呈先升高后下降趨勢,經JG1、JT4和JJ5處理后苜蓿的脯氨酸含量均提高。鹽堿濃度為0 mmol·L-1時,經JG1、JT4和JJ5處理后脯氨酸含量顯著高于CK(P<0.05),分別提高了516.12%、686.86%和443.67%;100 mmol·L-1時,經JG1處理后脯氨酸含量顯著高于CK(P<0.05),提高了253.14%;150 mmol·L-1時,經JJ5處理后苜蓿脯氨酸含量顯著高于CK(P<0.05),提高了525.61%;200 mmol·L-1時,經JT4處理后苜蓿脯氨酸含量顯著高于CK(P<0.05),提高了528.38%。
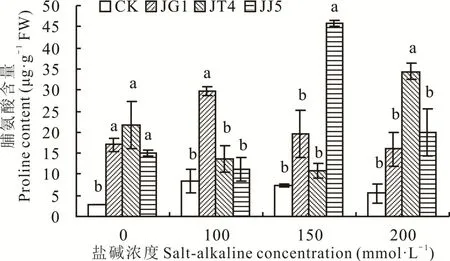
圖6 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿脯氨酸含量的影響Fig.6 Effects of S.glauca rhizosphere growth-promoting bacteria and endophytic bacteria on proline content of alfalfa under salt-alkaline stress
2.2.5 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿葉片葉綠素含量的影響 如圖7所示,鹽堿濃度為0 mmol·L-1時,JG1和JT4處理后苜蓿葉片葉綠素含量顯著高于CK(P<0.05),其含量分別提高45.24%和51.59%;100 mmol·L-1時,經JG1、JT4和JJ5處理后苜蓿葉片葉綠素含量均顯著高于CK(P<0.05);150 mmol·L-1時,JT4和JJ5處理后苜蓿 葉片葉綠素含量顯著高于CK(P<0.05),其含量分別提高51.64%和48.14%;200 mmol·L-1時 ,經JJ5處 理 后苜蓿葉片葉綠素含量顯著高于CK(P<0.05),含量提高67.68%。
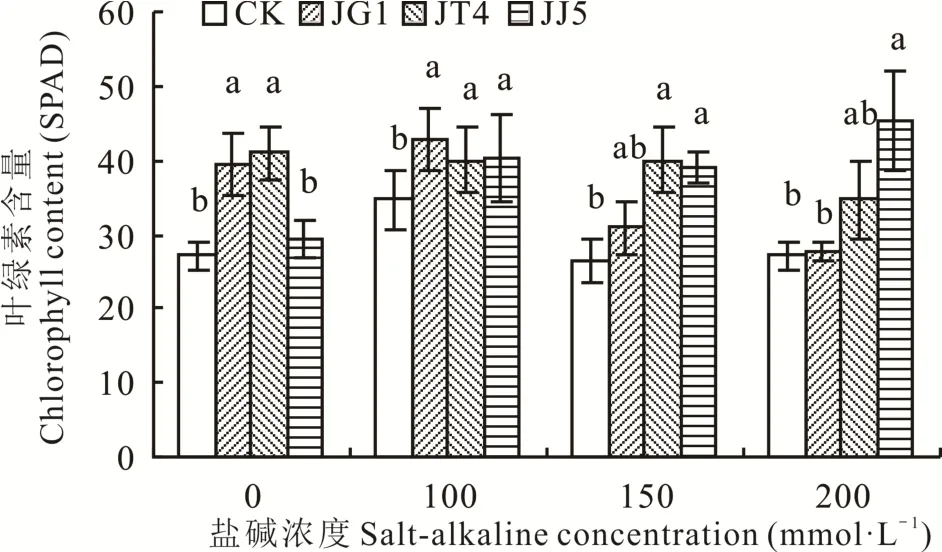
圖7 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿葉片葉綠素含量的影響Fig.7 Effects of S.glauca rhizosphere growth-promoting bacteria and endophytic bacteria on leaf chlorophyll content of alfalfa under salt-alkaline stress
2.3 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿生長影響的隸屬函數分析
如表4所示,通過隸屬函數法進行耐鹽堿性綜合評價,0 mmol·L-1鹽堿脅迫下隸屬函數值排序及耐鹽堿性從大到小依次為:JT4>JG1>CK>JJ5,在不同鹽堿脅迫下,隸屬函數值排序及耐鹽堿性從大到小均為:JT4>JG1>JJ5>CK。表明經堿蓬根際促生細菌和內生細菌處理后均能提高苜蓿的耐鹽堿能力。
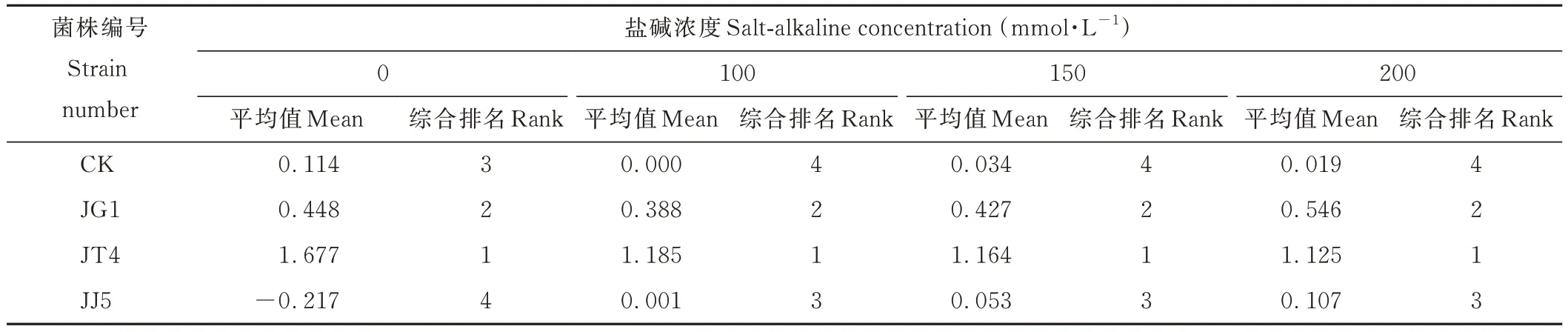
表4 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿耐鹽堿指標隸屬函數分析Table 4 Comprehensive analysis of membership function values of S.glauca rhizosphere growth-promoting bacteria and endophytic bacteria on alfalfa salt-alkaline tolerance indexes under salt-alkaline stress
2.4 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿生長影響的主成分分析
由表5可知,堿蓬根際促生細菌和內生細菌對0 mmol·L-1濃度下苜蓿耐鹽堿性指標主成分分析共獲得3個主成分,第Ⅰ主成分中指標所對應的特征向量中株高、分枝數、地上鮮重、地下鮮重數值較大,主要反映出鹽堿脅迫下促生細菌對苜蓿的生長具有促進作用。第Ⅱ主成分指標所對應的特征向量中MDA數值較大,為0.82,主要反映出鹽堿脅迫下堿蓬根際和內生細菌可減弱鹽堿脅迫下苜蓿細胞的損傷。第Ⅲ主成分中指標所對應的特征向量中葉綠素數值較大,主要反映出鹽堿脅迫下堿蓬根際和內生細菌具有促進生長的作用。

表5 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿耐鹽堿性指標主成分分析Table 5 Principal component analysis of salt-alkaline tolerance index of S.glauca rhizosphere growth-promoting bacteria and endophytic bacteria on alfalfa under salt-alkaline stress
堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿耐鹽堿性指標主成分分析中,第Ⅰ主成分中株高、分枝數、地上鮮重、地下鮮重數值較大,主要反映出鹽堿脅迫下促生細菌和內生細菌對苜蓿的生長具有促進作用。第Ⅱ主成分中,當鹽堿濃度為100 mmol·L-1時,POD數值較大,鹽堿濃度為150 mmol·L-1時,SOD數值較大,200 mmol·L-1時,MDA數值較大。主要反映出鹽堿脅迫下堿蓬根際促生細菌和內生細菌可提高滲透調節能力,減弱鹽堿脅迫下苜蓿細胞的損傷。第Ⅲ主成分中指標所對應的特征向量中脯氨酸數值較大,主要反映出鹽堿脅迫下堿蓬根際促生細菌和內生細菌可提高苜蓿滲透調節能力,提高其耐鹽堿脅迫能力。
3 討論
3.1 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿生產特性的影響
逆境對植物個體形態發育具有顯著影響,主要表現在植物組織和器官生長方面。生長抑制是植物對逆境脅迫最直接的表現,也是評價植物耐性最直觀的指標。本研究表明,接種3株促生細菌菌株后均促進苜蓿的生長,當鹽堿濃度增加時,促生細菌表現出的促生效果更好。與向君亮等[13]的研究結果類似,非鹽堿脅迫條件下接種耐鹽堿菌株S11后,苜蓿種子的發芽率、發芽勢、株高、根長和葉綠素含量與對照相比并沒有顯著差異,但鹽堿脅迫條件下,接種S11處理后促進了種子萌發和幼苗生長。本研究也發現在無鹽堿脅迫時,僅JT4對苜蓿株高、分枝數、鮮重有顯著促進作用,說明菌株在正常生長環境下對苜蓿的促生長作用不明顯,可能是因為3株菌株分離自鹽堿環境,而正常處理時的環境不適宜菌株的生長,沒有在幼苗根部定殖,從而未發揮促生長作用。當鹽堿濃度逐漸升高至200 mmol·L-1時,3株促生細菌對苜蓿的株高、分枝數和地上鮮重均有顯著促進作用,消除了鹽堿脅迫對苜蓿生長的抑制作用,擴寬了苜蓿在鹽堿脅迫下生長的生態幅,增加了鹽堿地種植苜蓿的可行性。本研究利用實驗室前期從大慶鹽堿土上生長的堿蓬根內(JG1)、莖內(JJ5)和根際土壤內(JT4)篩選出來的3株促生細菌處理鹽堿脅迫的紫花苜蓿,說明菌株對混合鹽堿具有良好的適應能力,具有一定的應用價值。
3.2 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿生理特性的影響
鹽堿脅迫下紫花苜蓿的SOD、POD活性和脯氨酸含量下降,MDA含量升高,對植株造成了嚴重傷害致使產量下降。植物的抗氧化酶系統可以有效清除植物體內代謝活動產生的活性氧以減少不同程度的氧化損傷。SOD是植物細胞清除氧自由基傷害的第一道防線,是生物體內一種很重要的抗氧化酶類,對于保護細胞免受氧化損傷有十分重要的作用,SOD活性可以不同程度地反映出植物對環境脅迫的抗逆情況[22-23]。POD是植物在逆境條件下酶促防御的關鍵酶之一,與SOD和過氧化氫酶(catalase,CAT)相互協調配合,以提高植物的抗逆性[24]。接種JG1、JT4、JJ5后苜蓿根系的SOD和POD活性均升高,減輕了鹽堿對紫花苜蓿生長的不利影響。說明3株促生細菌菌株誘導抗氧化酶(SOD和POD)活性,高活性的抗氧化酶與氧化應激耐受性有關,植物的耐受性與抗氧化劑的產生有關。MDA一般作為植物逆境指標,MDA含量的多少反映了膜損傷程度的大小,是常用的膜脂過氧化指標之一[25]。高于150 mmol·L-1鹽堿脅迫下,接種堿蓬根際促生細菌和內生細菌后可減弱根系MDA含量增加的趨勢,苜蓿損傷程度減小。脯氨酸含量被認為是研究植物抗逆性的重要指標,脯氨酸積累在逆境中對植物有保護作用[26],經堿蓬根際促生細菌和內生細菌處理后苜蓿脯氨酸的含量升高,可見堿蓬根際促生細菌和內生細菌可以提高苜蓿的耐鹽堿脅迫能力。鹽堿土種植的紫花苜蓿接種促生細菌后,紫花苜蓿的脯氨酸含量顯著增加,MDA含量降低,抗氧化酶SOD、POD活性顯著增強,與紫花苜蓿株高和生物量的增加相對應,表明促生細菌菌株可以通過增加保護物質的積累和提高抗氧化酶的活性來緩解鹽堿脅迫對紫花苜蓿造成的影響[14]。
葉綠素是植物進行光合作用的主要物質,苜蓿葉片光合特性、生理代謝和光合產物代謝的變化可共同影響植株生長發育。接種促生細菌可增加促進苜蓿幼苗光合色素和葉片葉綠素含量,導致光合能力增強,從而積累更多的有機物,同時運輸到地下部[27],故本研究中添加3株菌株后苜蓿幼苗地上部和地下部生物量顯著增加,進而提高紫花苜蓿的生產性能。說明選用的3株堿蓬根際促生細菌和內生細菌在促進植物適應逆境脅迫方面具有良好的應用潛力,但對鹽堿脅迫下苜蓿整個生長周期的生長和產量等的影響及其機理等方面還有待更進一步的研究。目前高通量測序技術比較普及,后續試驗應通過借助高通量測序技術探索3株菌株促進植物生長及增強植物抗鹽堿性的作用機理。
3.3 堿蓬根際促生細菌和內生細菌對鹽堿脅迫下苜蓿的隸屬函數值排序及耐鹽堿性綜合評價
植物耐鹽堿性是由多種因素間的交互影響及協同作用而決定的,選取單一指標進行耐鹽堿性評定具有一定的局限性。因此本研究采用模糊隸屬函數及主成分分析法綜合評價促生細菌對苜蓿的耐鹽堿性影響。通過生長指標和生理指標共9個成分進行主成分分析并結合隸屬函數值排序,表明不同促生細菌對鹽堿脅迫下苜蓿促生效果為JT4>JG1>JJ5。從堿蓬根內篩選的促生細菌JG1和從堿蓬根際土壤篩選的JT4對緩解苜蓿耐鹽堿性效果優于從莖內篩選的JJ5。由于土壤和植物根內微環境比莖內復雜,微生物通過復雜的環境選擇壓力而存活,因此根際細菌比植物內生細菌效果好。而高潔云[28]發現根際中的細菌其ACC脫氨酶活性高于植物體內的細菌,能提高植物的抗鹽性,本試驗結果與其基本一致。JG1和JJ5屬于沙雷氏桿菌,謝金宏[29]研究了水稻(Oryza sativa)根際微生物對改良鹽堿地的作用,發現在沙雷氏桿菌的作用下,鹽堿土地的pH有所降低,土壤有機質含量增加,是因為其分泌物幾丁質酶可以分解土壤中昆蟲骨骼的幾丁質,從而增加了土壤有機質含量和降低了土壤pH。促生細菌JT4屬于嗜麥芽寡養單胞菌,在農業生產領域有著巨大的應用前景,一些寡養單胞菌屬菌株可以分泌合成抵抗致病性的酶,降低植物患病的概率[30],單胞菌屬菌含有重金屬抗性基因,對重金屬有強耐受性和強還原力,以及對氯化農藥有強降解能力[31],因此可以提高植物的抗性。
4 結論
3株促生細菌均能緩解鹽堿脅迫對紫花苜蓿的抑制作用,促進紫花苜蓿生長,不同促生細菌對鹽堿脅迫下苜蓿促生效果為JT4>JG1>JJ5。

