基于芯片篩選螺原體感染中華絨螯蟹血細胞的免疫microRNAs
歐江濤, 蔣啟程, 周刻焱, 柳 巧, 欒筱琪, 王資生, 張啟煥
(鹽城工學院海洋與生物工程學院,江蘇鹽城 224051)
中華絨螯蟹()俗稱河蟹,是我國特有的優質淡水蝦蟹養殖品種之一,也是我國重要的水產經濟蟹種,具有較高的營養價值。隨著中華絨螯蟹水產養殖業的集約化大規模高速發展,導致水體環境狀況急速惡化,病害頻發且愈發嚴重。其中,由螺原體引起的“顫抖病”在中華絨螯蟹養殖中發生較為廣泛。中華絨螯蟹作為無脊椎動物主要依賴其先天免疫(包括細胞和體液免疫)發揮重要的免疫調控作用。目前,對于中華絨螯蟹細菌感染研究報道較多,相關研究發現,中華絨螯蟹應對副溶血性弧菌()、金黃色葡萄球菌()和嗜水氣單胞菌()等細菌侵染的免疫反應中,整合素(EsIntegrin)、C型凝集素(EsCTL1和EsCTL2)、L型凝集素(ERGIC-53和VIP36)等可作為識別受體參與宿主免疫防御;其中,、、等基因是重要的免疫調控因子,發揮重要調節功能。而關于它的分子調控機制,至今仍是研究熱點。
河蟹螺原體()屬于柔膜體綱(Mollicutes)蟲原體目(Entomoplasmatales)螺原體科(Spiroplasmataceae)螺原體屬()。螺原體是上世紀70年代被發現,可廣泛寄生于無脊椎動物中具有嚴重致病性的一類獨特微生物,其定植于宿主體內,在長期與宿主共存過程中,相互構成復雜網絡,通過不同精細調控細菌基因表達,以適應不同的生存環境,并對不同宿主發揮毒性作用。螺原體為中華絨螯蟹的主要病原體之一,被侵染后死亡率可達100%,近年中華絨螯蟹螺原體致使中華絨螯蟹、南美白對蝦()、日本沼蝦()和克氏原螯蝦()等甲殼經濟動物暴發疫病發生大面積死亡,對我國水產經濟動物養殖業造成巨大經濟損失。中華絨螯蟹螺原體通過鰓或外殼感染河蟹,并在1~5 d內增殖于其靶細胞-血淋巴細胞,5~10 d擴散至全身器官及結締組織,最后在 10~15 d引起中華絨螯蟹附肢顫抖直至死亡。
MicroRNA(miRNA)是一類非編碼RNA分子,廣泛存在于真核細胞中,它通過與靶mRNA的3′-非翻譯區(UTR)堿基配對調節基因表達,其長度為19~25 nt,miRNA雖不能直接編碼蛋白質,但miRNA在不同基因轉錄后的調控中具有重要作用。第一條miRNA被Lee等發現后,對于miRNA的研究引起了廣泛關注,miRNA在各種生命活動中起重要調控作用,如生長發育、生殖、免疫代謝等。目前,miRNA研究方法主要有基因芯片、RNA-seq、Northern blotting和莖環qRT-PCR等。其中,微流體芯片高通量可靠檢測miRNAs的存在和差異表達情況,在水產養殖動物研究中已廣泛應用。
當前,利用微流體芯片技術系統鑒定與分析中華絨螯蟹螺原體感染血細胞的miRNA及其表達情況,至今仍未見報道。前期,筆者所在實驗室以正常和感染螺原體中華絨螯蟹血細胞為研究對象,進行miRNA轉錄組測序分析,初步預測了血細胞免疫相關的miRNA。本研究在前期基礎上,通過構建中華絨螯蟹miRNA的特異微流體芯片,進一步系統鑒定血細胞免疫相關miRNA并檢測其表達情況,對差異表達的microRNA進行靶基因預測和功能聚類與通路分析,相關研究結果將為中華絨螯蟹該疫病的免疫防控和抗病育種提供分子信息。
1 材料與方法
1.1 螺原體感染中華絨螯蟹血細胞的樣品準備
中華絨螯蟹購于江蘇省南京市某養殖戶,(100±10) g共100只,在試驗前放置于10 L帶有循環水、紫外滅菌、充氧及控溫系統(26~28 ℃)中培育,通過PCR技術及負染技術證實研究所用中華絨螯蟹為螺原體陰性。試驗所用螺原體分離自患螺原體病的中華絨螯蟹,R2培養基中培育 48 h 備用。
2012年6月在南京師范大學將中華絨螯蟹分為對照組和試驗組,各50只,培養20 d備用;對照組注射100 μL R2培養基,試驗組注射100 μL含螺原體(培養至對數期)R2培養基。飼養溫度保持 28 ℃,間歇性供氧。抽取血液,采用Trizol提取法從血細胞中提取RNA,并對RNA進行質量檢測。
1.2 中華絨螯蟹微流體芯片構建及差異表達檢測
由表1可知,基于miRBase中收錄的中華絨螯蟹、淡水枝角水蚤()、日本對蝦()、克氏原螯蝦()4種動物共897條成熟miRNA序列作為本研究探針。采用Cy3染料標記RNA樣品,可通過檢測分析Cy3的熒光強度來尋找2組樣品差異表達的miRNAs。
在總RNA質檢通過后,進入芯片試驗階段,由LC Science參與完成。使用Array-Pro圖像分析軟件進行圖像數字化轉換。首先,減除背景值,再使用LOWESS過濾進行信號歸一化。衡量雜交結果可靠性的標準如下:(1)值<0.5;(2)探針信號值大于3倍背景值與標準偏差的和。滿足以上2點為表達檢測結果為陽性。

表1 中華絨螯蟹微流體芯片探針
1.3 差異miRNA靶基因預測及其GO和KEGG功能富集分析
通過微流體芯片檢測,可獲得正常和感染螺原體中華絨螯蟹共同表達miRNA及兩者差異表達miRNA。為了解2組中華絨螯蟹差異miRNA功能,選用分析軟件“miRanda,PITA和TargetScan”進行預測差異顯著miRNA的所有靶基因,結合三者預測結果,取交集,獲取共有靶基因。根據Gene Ontology數據庫對靶基因進行功能分析,根據KEGG(Kyoto Encyclopedia of Genes and Genomes)數據庫對靶基因進行Pathway分類,而得到Path way分類。
1.4 莖環RT-qPCR驗證
設計莖環引物,進行反轉錄、RT-qPCR試驗,反轉錄反應PCR程序為:42 ℃ 60 min,70 ℃ 15 min。RT-qPCR程序為:50 ℃ 2 min 95 ℃ 2 min;95 ℃ 15 s 60 ℃ 15 s,39次循環。每個樣品均為3復孔,-為內參基因,miRNA差異表達水平用2-ΔΔ方法計算。采用Primer 5.0 (ABI)進行引物設計,采用特異性引物進行反轉錄,共設計9對引物,引物序列見表2。

表2 miRNA的引物序列
2 結果與分析
2.1 中華絨螯蟹血細胞miRNA的芯片鑒定與表達分析
試驗組和對照組各使用3張芯片進行檢測,每張芯片都設計多重質控探針,保證了樣品標記和雜交試驗的質量控制。對于正常和感染中華絨螯蟹血細胞中不同miRNA,根據芯片所產生的不同反應信號,通過分析這些芯片雜交信號值,選取Signal>200及<0.05為分析基準,數據進行歸一化處理后進行-Test和Cluster分析。由圖1可知,6張芯片總共鑒定出中華絨螯蟹血細胞miRNA為303個,試驗組和對照組共表達miRNA有48個,其中,有27個表達miRNA差異顯著(<0.05),6個表達miRNA差異極顯著(<0.01);在這些差異表達的miRNA中,12個miRNA顯著下調,15個miRNA顯著上調(<0.05)。
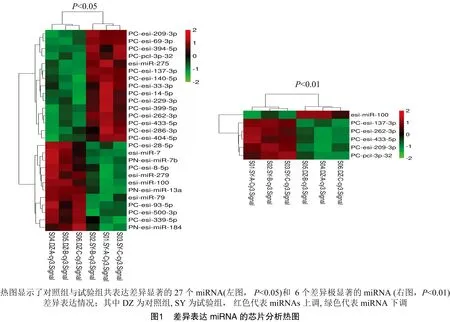
2.2 差異miRNA的靶基因預測、GO注釋和Pathway分類
由表3可知,通過利用3款分析軟件“miRanda、PITA和TargetScan”對差異顯著的27個miRNA靶基因進行預測,結合三者數據取交集,共得78個靶基因,預測靶基因大多數為各種蛋白和酶的基因,參與調節各種生命活動,尤其是在免疫調節中發揮作用的proPO、ALF-2、Peroxinectin、Relish免疫因子等。

表3 miRNA的預測靶基因
由圖2-A可知,對預測到的78個靶基因進行GO注釋,共有116個GO通路被注釋,明顯富集于24個GO,包括:蛋白水解、cAMP生物合成和鈣離子結合等;由圖2-B可知,通過KEGG注釋,發現63個通路被注釋,14個主要通路,包括:嘌呤代謝、趨化因子信號通路和GnRH信號通路等。
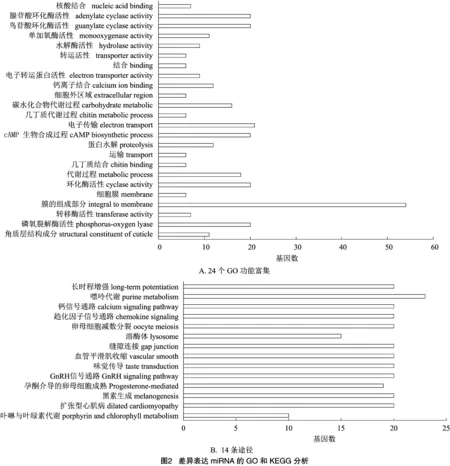
2.3 莖環RT-qPCR試驗結果
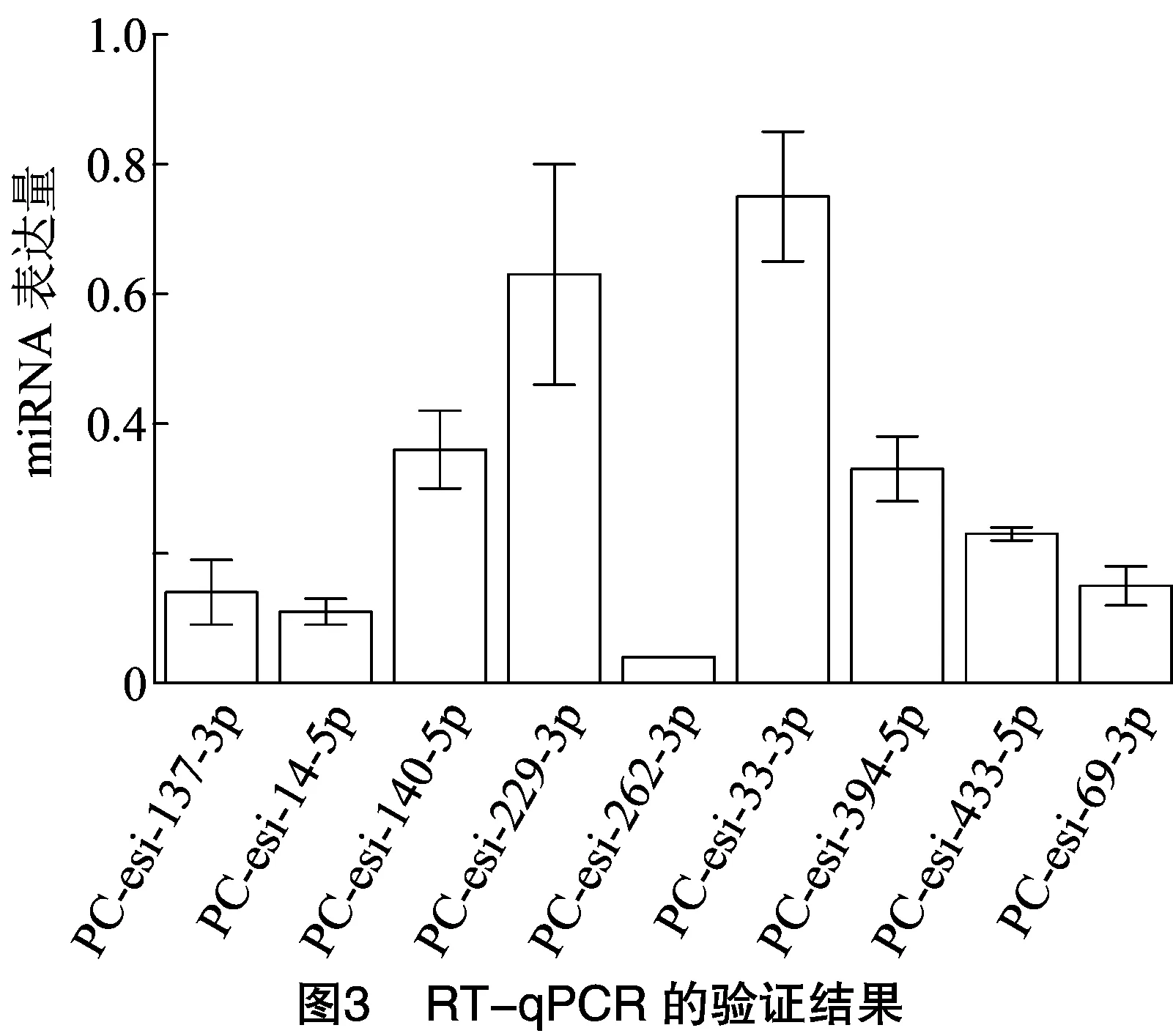
為驗證微流體芯片的檢測結果,由圖3可知,隨機選取PC-esi-137-3p、PC-esi-14-5p、PC-esi-140-5p、PC-esi-229-3p、PC-esi-262-3p、PC-esi-33-3p、PC-esi-394-5p、PC-esi-433-5p、PC-esi-69-3p這9個明顯差異表達的miRNA進行驗證,利用莖環RT-qPCR法檢測miRNA的差異表達情況。結果表明,這9個miRNA表達水平均上調,與微流體芯片結果一致。
3 討論
miRNA通過與靶標基因的3′-非翻譯區(3′-UTR)互補,抑制mRNA表達或直接裂解mRNA,調控各種生理和病理作用。miRNA也是至今研究最廣泛的一類非編碼RNA,已被證明在調節先天性和適應性免疫系統中發揮重要作用。因此,鑒定和篩選免疫相關的miRNA,解析其在宿主與病原體中的相互關系,將在疾病防控和抗病育種中發揮重要作用。在miRNA研究中,微流體芯片技術已被廣泛應用,微流體芯片技術是高通量、特異性和敏感性強的一種基因鑒定和差異檢測方法,在動物的生長、發育和免疫應答等方面運用較多。李升等選用不同月齡香豬的肝臟組織RNA,與微流體芯片雜交,結果表明不同月齡肝臟miRNA的表達水平存在差異。關于水產動物研究,何耀東等利用微流體芯片技術研究發現,在注射自噬誘導劑后對蝦血淋巴中有15個miRNA明顯上調,17個miRNA明顯下調,表明相關差異表達miRNA在白斑綜合癥病毒(WSSV)侵染對蝦的過程中發揮作用。現今,微流體芯片技術,因其具有微量化、快速、高通量等特點,近年來已被廣泛應用到癌癥、微生物和營養等多個領域研究中。隨著微流體芯片的進一步廣泛應用,將極大促進功能性調控miRNA的發現與鑒定,為進一步研究免疫調控機制奠定基礎。
中華絨螯蟹屬于無脊椎動物,完全依賴先天免疫(包括細胞和體液免疫),而缺乏適應性免疫來抵御細菌和病毒等。甲殼動物血細胞是主要的免疫細胞,在宿主的先天免疫活動中起著至關重要的作用,包括識別、吞噬、黑化、細胞毒性和細胞間信號傳遞等。因此,識別和鑒定參與先天免疫應答的調節因子(如非編碼RNA和轉錄因子)至關重要。前期研究通過對正常和感染螺原體的血細胞進行高通量測序分析,結合生物信息學分析,共鑒定出735個miRNA;在被螺原體侵染后,本研究發現228個miRNA表達量存在明顯差異,133個miRNA顯著上調,95個miRNA顯著下調。在此基礎上,本研究選擇微流體芯片和莖環RT-qPCR技術,對細胞免疫相關miRNAs進行了進一步的篩選鑒定與驗證。由于μParaflo?微流體芯片相比于傳統點樣芯片具有更可靠、準確和靈活特點,本研究利用該技術鑒定出中華絨螯蟹血細胞miRNA共303個;健康組和試驗組共表達miRNA有48個,其中,差異顯著miRNA為27個(占比56.25%);差異極顯著miRNA為6個(占比12.50%)。隨機選擇9個差異表達miRNA進行莖環RT-qPCR驗證,結果與芯片結果一致,說明芯片檢測結果準確可靠。
近年,隨著測序成本的下降和技術的不斷發展,miRNA在蝦蟹免疫調控中發揮作用的研究已較為廣泛。Ou等研究發現,pcl-miR-34、pcl-miR-7、PN-pcl-let-7、pcl-miR-1和pcl-miR-2b在克氏原螯蝦應對螺原體侵染過程中發揮著積極作用,且在脊椎動物和無脊椎動物中高度保守。Bao等研究發現,microRNA-589-5p在凡納濱對蝦可調節抗WSSV免疫應答中血藍蛋白的表達。Soo等發現,bta-miR-4286、dre-miR-107b 在斑節對蝦()應對副溶血弧菌侵染過程中與對肌蛋白基因表達、鈣濃度有調控作用。本研究通過利用3款分析軟件“miRanda、PITA和TargetScan”對差異顯著的27 個miRNA進行靶基因預測,取三者交集,共得到78個靶基因,涉及多個重要免疫通路,其中,()、()、和等多個靶基因是參與免疫調控的重要免疫因子。
酚氧化酶(proPO)系統是無脊椎動物先天免疫的重要組成部分之一,過氧化物酶可與proPO相關的細胞黏附因子相互作用來進行免疫調節。免疫缺陷同系物(immune deficiency homolog,IMD)信號通路是調節甲殼動物固有免疫的主要信號傳導途徑,而Relish是IMD信號通路中的關鍵因子,Bai等發現,Relish參與了中華絨螯蟹對革蘭氏陽性和革蘭氏陰性細菌的免疫防御過程;Zhang等發現,Relish在克氏原螯蝦中能誘導基因的表達;絲裂原激活的蛋白激酶途徑(MAPK)能夠通過調節胞內蛋白來發揮調控功能,如細胞分化、凋亡、增殖和免疫反應。筆者所在課題組前期運用RNA-seq測序技術,結合本研究的微流體芯片技術,全面分析了正常和感染螺原體的中華絨螯蟹血細胞mRNA和miRNA轉錄組。結果顯示,許多免疫相關miRNA及其靶基因均表達顯著差異。它們參與了一些典型免疫相關途徑,包括補體和凝血級聯途徑、VEGF信號途徑、Wnt信號途徑、NK細胞介導的細胞毒性、MAPK信號途徑、神經活性配體-受體相互作用途徑和溶酶體途徑。
本研究同時通過對差異表達miRNA的靶基因進行了GO和KEGG功能分析,共注釋到116個GO通路和63個KEGG通路,主要集中于宿主的多種酶活性、代謝和免疫通路等,包括細胞免疫涉及的包囊、結節形成和吞噬作用,與體液免疫涉及的酚氧化酶激活系統(proPO系統)、凝血級聯和抗菌肽(AMP)的合成等。以上研究結果可為進一步深入研究中華絨螯蟹免疫機制提供科學理論依據,為水產經濟動物蝦蟹該疫病的綜合防控奠定基礎。

