吐納麝香(6-乙酰基-1,1,2,4,4,7-六甲基四氫萘)對人永生化角質形成細胞HaCaT間隙連接通訊的影響
宿驚濤,劉雯,鄭美,肖雨蒙,杭曉明,*
1.大連海事大學環境科學與工程學院,大連 116026
2.中山大學生命科學學院,廣州 510275
6-乙酰基-1,1,2,4,4,7-六甲基四氫萘(CAS:1506-02-1),又稱吐納麝香(tonalide,AHTN),是一種人工合成的半揮發性環狀有機化合物,具有與天然麝香相似的氣味,被廣泛應用于個人護理品和空氣清新劑等產品中[1-2]。AHTN具有與持久性有機污染物(persistent organic pollutants,POPs)類似的化學結構(圖1),自然狀態下很難進行化學和生物降解。目前,在大氣[1-2]、室內灰塵[3]、水環境[4-7]、污泥和沉積物[5-6,8-9]等環境介質中均檢測到AHTN的存在。AHTN具有親脂性,很容易發生生物富集,目前已在魚類[6,10-11]、貝類[12-14]、人體的母乳[9,15-16]、脂肪組織[15,17-19]和血液[20-21]中發現AHTN的蓄積。根據Hu等[21]的研究,AHTN在中國11個城市人群血液的中位濃度為0.53 ng·g-1,換算后約為10-8mol·L-1濃度范圍。
對AHTN的毒性研究已有近30年的歷史,主要集中在基礎毒性[22]、內臟毒性[23]、酶活性毒性[24]、氧化損傷毒性[25]、神經毒性[26]以及內分泌干擾效應[27]等方面。研究顯示,AHTN具有弱雌激素活性,且由雌激素受體(estrogen receptor,ER)介導[27-28]。Schreurs等[29]利用體外報告基因檢測發現AHTN是弱的ERα激動劑和ERβ拮抗劑。Li等[30]對人體腎上腺皮質癌細胞H295R在AHTN暴露后類固醇激素及類固醇生成途徑相關基因的表達進行了定量分析,發現AHTN主要通過抑制3βHSD2和CYP21來抑制孕酮和皮質醇的產生。此外,Schreurs等[31]發現0.01、0.1和1 μmol·L-1AHTN暴露對斑馬魚的ER產生劑量依賴的拮抗作用,0.01 μmol·L-1AHTN暴露會產生抗孕激素效應[32]。
AHTN的暴露途徑為皮膚接觸、食物攝入和吸入吸收[33]。其中,皮膚接觸是AHTN進入人體最主要的途徑[33-34]。研究表明,AHTN的皮膚暴露量約為5.96 μg·kg-1·d-1[34]。目前AHTN對皮膚的毒性研究非常有限,據香料材料研究所(Research Institute for Fragrance Materials,RIFM)的報告顯示,AHTN對大鼠和家兔急性皮膚毒性的LD50分別為7.94 g·kg-1和>5 g·kg-1[35]。鑒于富含人工麝香的日化品引起皮膚過敏的案例時有報道,有必要開展其對人體皮膚效應的深入研究。
細胞間隙連接通訊(gap junction intercellular communication,GJIC)是調節細胞增殖、遷移、凋亡、致癌作用、信號轉導、炎癥及免疫反應的重要生物學機制,是近年來皮膚毒性的重要研究內容。GJIC通道由連接蛋白(Connexin,Cx)構成,Cx的表達或磷酸化狀態的改變,會引起多種皮膚疾病[36]。Cx26和Cx43是人角質形成細胞間隙連接的主要成分,Cx26表達的改變會增加皮膚癌的易感性,Cx43是一種預防皮膚癌發病的保護因子[36]。雌激素可以通過ER介導的基因組[37]和非基因組機制[38]調節Cx在細胞中的表達、分布和功能狀態,進而影響細胞的GJIC功能。其中,基因組機制主要調節Cx的基因轉錄和蛋白表達[37],非基因組機制(如MAPK/ERK和PI3K/AKT信號通路等)主要調節Cx的磷酸化狀態、空間結構及降解等[38]。
本研究采用人永生化角質形成細胞HaCaT,探究環境相關濃度AHTN對皮膚細胞GJIC功能的影響及可能的分子機制,為客觀評價AHTN的生物毒性和致癌風險提供依據。
1 材料與方法(Materials and methods)
1.1 化學藥品和試劑
分析純AHTN購自上海源葉,雌二醇(E2)、二甲基亞砜(DMSO)和熒光黃染料購自Sigma,ERα抑制劑ICI182780購自MCE。細胞培養用DMEM培養基購自Gibco;特級胎牛血清購自萬澤;青鏈霉素混合液和胰蛋白酶-EDTA消化液購自Solarbio。分子生物學試劑均購自博瑞德,IP裂解液、PMSF和BCA蛋白濃度試劑盒購自碧云天;氯仿、異丙醇等化學試劑均購自上海生工,所用抗體購于江蘇親科和武漢三鷹公司。
1.2 細胞培養
人永生化角質形成細胞HaCaT由大連海事大學環境系統生物學研究所提供,采用10% FBS、1%鏈霉素和青霉素及88% DMEM高糖培養基,置于37 ℃、5% CO2的Thermo 3110細胞培養箱(賽默飛,美國)進行培養。
1.3 暴露處理
采用0.1% DMSO為助溶劑,分別配制10-3mol·L-1AHTN和10-2mol·L-1E2母液,超凈臺中使用0.22 μm的濾膜過濾器抽濾,再用DMSO逐級稀釋為10-4~10-7mol·L-1AHTN和10-6mol·L-1E2工作液。工作液與細胞培養基按1∶1 000的比例稀釋后用于暴露處理,即AHTN的暴露濃度為10-7~10-10mol·L-1,10-9mol·L-1E2為陽性對照,0.1% DMSO為空白對照。每個處理組均6個平行重復。
1.4 細胞活性檢測
MTT法測定細胞存活率。吸出培養基,PBS溶液清洗3遍,加入150 μL配好的培養基和50 μL 1×MTT溶液,37 ℃培養箱中孵育4 h后,棄上清。加入150 μL DMSO溶液溶解甲瓚,用Molecular Devices SpectraMax M5酶標儀(Molecular Devices,美國)測定490 nm波長下各孔的光吸收,計算細胞存活率。細胞存活率=(暴露孔OD/對照孔OD)×100%。
1.5 GJIC功能檢測
細胞劃痕標記染料示蹤技術(scrape-loading and dye transfer,SLDT)檢測GJIC功能。吸出培養基,PBS溶液清洗3遍,加入質量濃度為0.05%熒光黃染料1 mL。用銳利手術刀片輕劃3次,放入37 ℃培養箱避光標記10 min。吸出熒光黃染料,PBS沖洗細胞3次,去除游離熒光染料及脫落的細胞。加入4%多聚甲醛溶液1 mL,室溫固定10 min,棄去固定液。每孔加入1 mL PBS溶液,倒置熒光顯微鏡(Nikon TE2000E)下觀察并拍照(藍色激發波長為470 nm,綠色發射波長為505 nm)。熒光圖片采用Photoshop軟件進行反相處理,Image J軟件進行熒光強度數字化。
1.6 實時熒光定量PCR檢測
Trizol法提取總RNA,反轉為cDNA,采用SYBR Green為DNA結合染料,實時熒光定量PCR(RT-qPCR)法檢測相關基因的表達。引物設計使用Primer Express(ABI)進行(表1),Gapdh為內參基因。預實驗確定引物特異性及擴增效率。RT-qPCR使用ABI7300進行,反應條件為95 ℃預變性10 min,95 ℃變性15 s,60 ℃退火延伸1 min,40個循環。獲得的Ct值采用2-△△Ct法進行分析。
1.7 蛋白質印跡法
蛋白定量分析采用蛋白質印跡(Western blot)法。提取總蛋白,Bradford法進行蛋白定量。Bio-Rad 164-5056電泳儀進行SDS-PAGE,分離膠濃度為10%。轉膜、封閉后,與一抗雜交過夜。一抗濃度分別:GAPDH(1∶000),PI3K和AKT(1∶2000),Cx43、p-AKT和p-Cx43(1∶1000),ERα、p-PI3K、MEK和ERK(1∶500),Cx26、p-MEK和p-ERK(1∶250)。TBST清洗后,分別與二抗(1∶2000)雜交1 h。清洗及發光顯色后,采用UVP GelDoc-It 310凝膠成像系統進行圖像采集,Image J軟件進行條帶的灰度分析。
1.8 統計學分析
所有實驗至少進行3次生物學重復,數據以mean±SD表示。統計分析采用T-TEST進行,*P≤0.05、**P≤0.01,具有“顯著性”差異。GraphPad Prism 8軟件繪制圖片。
2 結果(Results)
2.1 AHTN暴露對HaCaT細胞活性的影響
與DMSO對照組相比,10-8mol·L-1AHTN暴露24 h和10-9mol·L-1AHTN暴露48 h均可顯著促進HaCaT細胞的增殖(P≤0.01),細胞存活率分別增加12%和13%(圖2),增殖效率略遜于10-9mol·L-1E2陽性對照組。而10-6mol·L-1AHTN暴露48 h顯著抑制HaCaT細胞的增殖(P≤0.01),細胞存活率較對照組降低10%(圖2(b))。
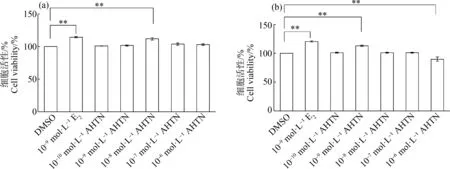
圖2 AHTN暴露對HaCaT細胞活性的影響注:DMSO表示二甲基亞砜,E2表示雌二醇,AHTN表示吐納麝香;(a)暴露24 h,(b)暴露48 h;**表示P≤0.01。Fig.2 Effects of AHTN exposure on cell viability in HaCaTNote:DMSO stands for dimethyl sulfoxide,E2 stands for estradiol,and AHTN stands for tonalide;(a) 24 h exposure,(b) 48 h exposure;**represents P≤0.01.
2.2 AHTN暴露對HaCaT細胞GJIC功能的影響
SLDT檢測結果顯示,10-8mol·L-1AHTN暴露24 h,熒光強度較DMSO對照組上調8%(圖3(a)和(b)),10-9mol·L-1和10-8mol·L-1AHTN暴露48 h,熒光強度較對照組分別減弱13%和9%(圖3(c)和(d));而10-9mol·L-1E2暴露均會導致熒光強度增強,24 h增強14%(圖3(a)和(b)),48 h增強6%(圖3(c)和(d))。由此可見,10-8mol·L-1AHTN對HaCaT細胞GJIC功能的影響與10-9mol·L-1E2類似,均隨著暴露時間的延長,熒光強度逐漸降低。
對熒光染料的傳輸范圍進行分析發現,與對照組相比,10-8mol·L-1AHTN暴露24 h熒光染料傳輸了一層細胞(圖3(a)),其余組均沒有明顯的傳輸現象;而10-9mol·L-1E2陽性對照組在24 h和48 h均發現熒光染料傳輸了一層細胞(圖3(a)和(c))。
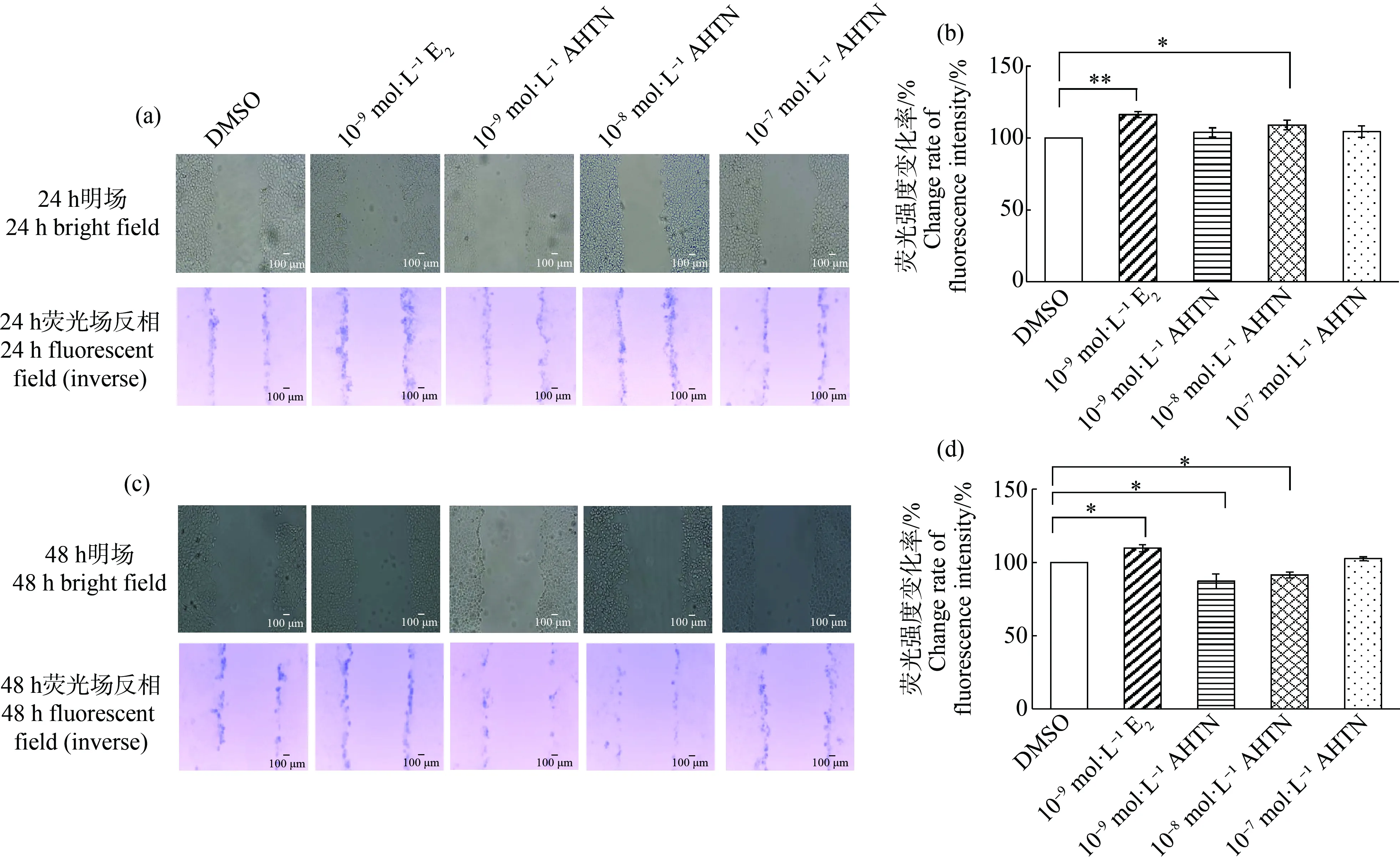
圖3 AHTN暴露對HaCaT細胞的細胞間隙連接通訊(GJIC)功能的影響注:(a) 暴露24 h后顯微成像圖(bar=100 μm),(b) 暴露24 h后熒光強度變化率,(c) 暴露48 h后顯微成像圖(bar=100 μm),(d) 暴露48 h后熒光強度變化率;*表示P≤0.05,**表示P≤0.01。Fig.3 Effects of AHTN exposure on gap junction intercellular communication (GJIC) function in HaCaTNote:(a) Microscopic images of 24 h exposure (bar=100 μm),(b) Change rate of fluorescence intensity after 24 h exposure,(c) Microscopic images of 48 h exposure (bar=100 μm),(d) Change rate of fluorescence intensity after 48 h exposure;*represents P≤0.05,and **represents P≤0.01.
2.3 AHTN通過ERα介導的基因組途徑影響HaCaT細胞的GJIC功能
分別采用RT-qPCR和Western blot,檢測10-8mol·L-1和10-9mol·L-1AHTN暴露對ERα及其下游連接蛋白(Cx26和Cx43)表達的影響。結果表明,10-8mol·L-1AHTN暴露24 h,ERα、Cx26和Cx43的基因和蛋白水平均發生顯著性上調(圖4(a)和(c))。但暴露時間延長至48 h后,10-9mol·L-1和10-8mol·L-1AHTN暴露僅顯著上調ERα的基因和蛋白水平(圖4(b)和(d)),而Cx26和Cx43的基因和蛋白水平均發生顯著性下調(圖4(b)和(d))。陽性對照10-9mol·L-1E2暴露則始終會導致ERα、Cx26和Cx43基因和蛋白水平的顯著上調(圖4)。
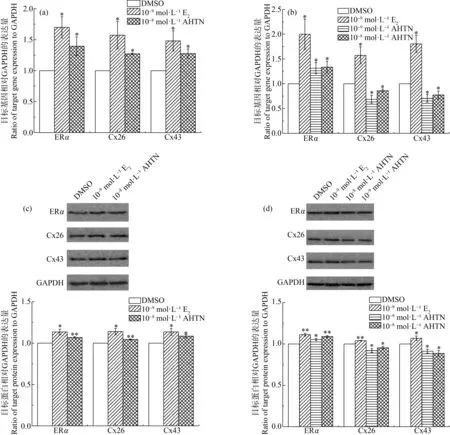
圖4 AHTN暴露對HaCaT細胞ERα及相關Cx表達的影響注:(a)暴露24 h基因表達情況,(b)暴露48 h基因表達情況,(c)暴露24 h蛋白表達情況,(d)暴露48 h蛋白表達情況;*表示P≤0.05,**表示P≤0.01。Fig.4 Expression of ERα and related connexins in HaCaT cells after exposure to AHTNNote:(a) Gene expression after 24 h exposure,(b) Gene expression after 48 h exposure,(c) Protein expression after 24 h exposure,(d) Protein expression after 48 h exposure;*represents P≤0.05,and **represents P≤0.01.
為驗證ERα在AHTN對HaCaT細胞GJIC功能影響中的作用,加入ERα抑制劑ICIl82780重新進行SLDT實驗。結果發現,10-8mol·L-1AHTN與抑制劑聯合暴露24 h,熒光強度較未加抑制劑組下降10%(圖5(a));10-9mol·L-1和10-8mol·L-1AHTN與抑制劑聯合暴露48 h,熒光強度較未加抑制劑組分別降低10%和16%(圖5(b))。而抑制劑的加入會導致10-9mol·L-1E2的熒光強度大幅降低,24 h下降10%(圖5(a)),48 h下降18%(圖5(b))。
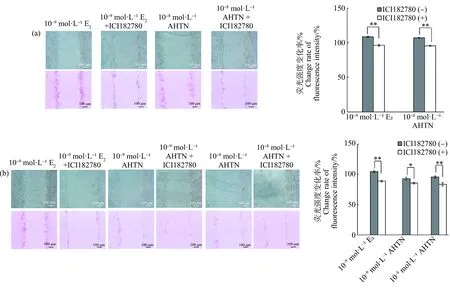
圖5 ERα抑制劑對HaCaT細胞GJIC功能的影響注:(a)暴露24 h,(b)暴露48 h;bar=100 μm;*表示P≤0.05,**表示P≤0.01。Fig.5 Effects of ERα inhibitor on GJIC function in HaCaTNote:(a) 24 h exposure,(b) 48 h exposure;bar=100 μm;*represents P≤0.05,and **represents P≤0.01.
2.4 AHTN通過激活MAPK/ERK和PI3K/AKT信號通路影響HaCaT細胞的GJIC功能
為探究AHTN對HaCaT細胞GJIC功能影響的其他分子機制,選取與GJIC調控相關的2條重要信號傳導通路,對其級聯分子進行定量分析。結果表明,10-8mol·L-1AHTN暴露24 h和48 h,以及10-9mol·L-1AHTN暴露48 h,對MAPK/ERK信號通路中級聯分子MEK和ERK的含量無顯著性影響,但均可導致其磷酸化水平(p-MEK和p-ERK)的顯著上調(圖6(a)和(b))。對PI3K/AKT信號通路的分析則表明,上述AHTN暴露既能導致級聯分子PI3K和AKT含量的增加,也會導致二者磷酸化水平(p-PI3K和p-AKT)的顯著上調(圖6(c)和(d))。Cx43作為2條通路下游的靶分子,其磷酸化水平(p-Cx43)在上述AHTN暴露后均發生顯著性上調(圖6)。
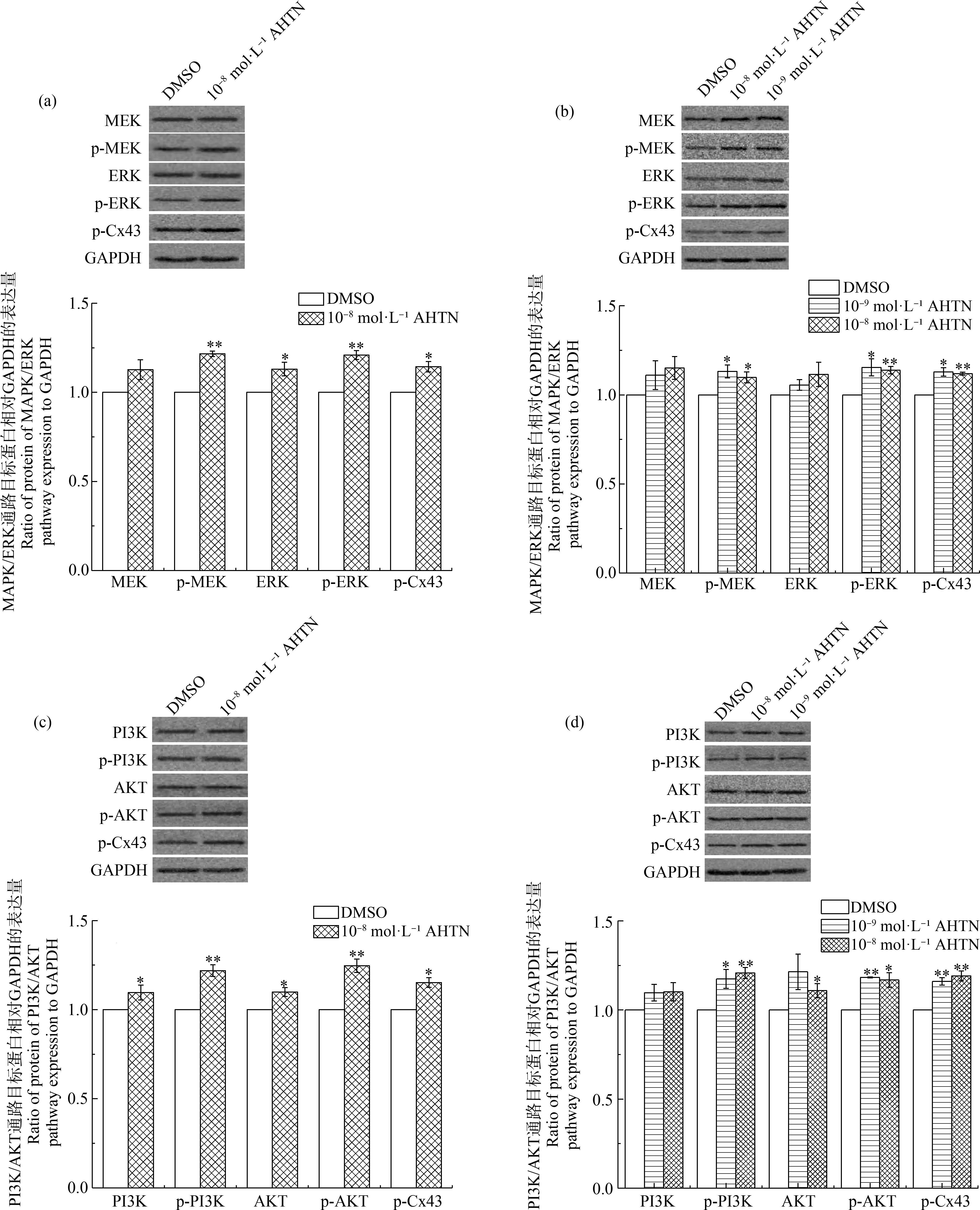
圖6 AHTN暴露對HaCaT細胞MAPK/ERK和PI3K/AKT信號通路的影響注:(a)暴露24 h對MAPK/ERK通路的檢測,(b)暴露48 h對MAPK/ERK通路的檢測,(c)暴露24 h對PI3K/AKT通路的檢測,(d)暴露48 h對PI3K/AKT通路的檢測;*表示P≤0.05,**表示P≤0.01。Fig.6 Effects of AHTN exposure on MAPK/ERK and PI3K/AKT pathways in HaCaTNote:(a) Analysis of MAPK/ERK pathway after 24 h exposure,(b) Analysis of MAPK/ERK pathway after 48 h exposure,(c) Analysis of PI3K/AKT pathway after 24 h exposure,(d) Analysis of PI3K/AKT pathway after 48 h exposure;*represents P≤0.05,and **represents P≤0.01.
3 討論(Discussion)
AHTN在中國城市人群血液的中位濃度為0.53 ng·g-1[21],中國臺灣地區AHTN的皮膚暴露量約為5.96 μg·kg-1·d-1[34],據此,我們推算AHTN在表皮中的暴露劑量在10-8mol·L-1數量級。本文探究了10-10~10-7mol·L-1AHTN對人永生化角質形成細胞HaCaT的影響。結果表明,與許多天然激素和環境內分泌干擾物類似[39],AHTN表現出低劑量刺激、高劑量抑制細胞活性的特點(圖2)。現有研究表明,AHTN對不同細胞內分泌干擾的濃度范圍與效應不同。10-5mol·L-1AHTN暴露可導致人乳腺癌MCF-7細胞增殖[27],0.25、2.5和25 μmol·L-1AHTN暴露會引起人腎上腺皮質癌細胞系H295R的增殖[30]。本研究使用的HaCaT細胞,與正常皮膚角質形成細胞特性類似,可無限傳代,不具有腫瘤特性[40]。本研究結果表明環境相關濃度的AHTN暴露可導致HaCaT細胞活性的改變,且具有復雜的劑量-效應關系。
GJIC功能對細胞具有重要的生理作用,其功能異常會誘發癌癥,皮膚瘢痕癌的發生發展與GJIC功能的變化相關[41]。SLDT是檢測GJIC功能最常用的方法之一,具有實驗周期短、設備需求少等特點,被廣泛應用于體外毒性研究中。在本研究中,環境相關濃度(10-8mol·L-1)AHTN暴露24 h和48 h出現相反的變化趨勢。為避免因誤差所致,我們進行了3次重復實驗,并分別采用熒光成像、熒光強度分析和熒光染料傳輸范圍3種不同的表征方法,均證明10-8mol·L-1AHTN暴露24 h,導致GJIC功能短暫性增強,暴露48 h后,GJIC功能逐漸受到抑制(圖3)。上述結果與AHTN對HaCaT細胞活性的影響趨勢(圖2)相同。與本研究結果類似,Zhang等[42]在雙酚A的研究中發現,暴露48 h可抑制HaCaT細胞的GJIC功能,而24 h未檢測到顯著性改變。
GJIC功能受多種因素調控。研究表明,雌激素可通過ER介導的基因組[37]和非基因組機制[38]調節Cx在細胞中的表達、分布和功能狀態,進而影響細胞的GJIC功能。
為探究AHTN對HaCaT細胞GJIC功能影響的分子機制,首先對10-8mol·L-1和10-9mol·L-1AHTN暴露后的ERα進行了定量分析,結果發現ERα基因和蛋白的表達均發生顯著上調(圖4),而加入ERα抑制劑后,GJIC功能受到不同程度的抑制(圖5),說明AHTN對HaCaT細胞GJIC功能的影響是由ERα介導的。對ERα介導基因組途徑中的下游分子(連接蛋白Cx26和Cx43)進行定量分析發現,10-8mol·L-1AHTN暴露48 h,二者的基因和蛋白水平均發生顯著性下調(圖4(b)和(d)),且與該濃度下GJIC功能受到抑制(圖3(b))的效應吻合。后續可以對加入ERα抑制劑后Cx26和Cx43的表達情況進行定量分析,為AHTN通過ERα介導的基因組途徑影響HaCaT細胞GJIC功能提供更可靠的科學證據。
另外,Cx26和Cx43作為人角質形成細胞間隙連接的主要成分,與GJIC功能直接相關,常被用作各類皮膚癌癥發生和發展的生物標志物。在皮膚瘢痕癌中,Cx26的mRNA表達下調,GJIC功能減弱[43];在黑色素瘤中,Cx26、Cx43表達下調導致GJIC功能減弱,誘發癌癥的發生[44]。本研究發現10-8mol·L-1AHTN暴露48 h,Cx26和Cx43表達下調(圖4(b)和(d)),提示AHTN暴露可能具有潛在誘發皮膚癌的風險。雖然目前尚缺乏AHTN暴露與皮膚癌發生相關性的流行病學調查數據,但有學者采用實驗與理論計算相結合的研究發現,AHTN可以作為光敏化劑,誘導人體氨基酸發生光敏化氧化,并且猜測其可能像其他光敏化劑一樣,導致生物分子損傷,引起細胞凋亡或壞死,影響信號通路,甚至誘發皮膚癌的發生[45]。
在GJIC功能調控的非基因組機制中,MAPK/ERK和PI3K/AKT信號通路可通過調節下游Cx的磷酸化狀態、空間結構及降解等發揮作用。Rivedal和Opsahl[46]發現12-O-十四烷酰佛波醇-13-醋酸酯(12-O-tetradecanoylphorbol-13-acetate,TPA)暴露處理大鼠肝上皮細胞WB-F344,可激活ERK,提高Cx43的磷酸化水平,降低GJIC功能。Klotz等[47]發現維生素K3(甲萘醌)可通過激活MAPK激酶,導致Cx43磷酸化增加,從而降低WB-F344細胞的GJIC。Lee等[48]發現褪黑素可顯著增加Cx26和Cx43的表達,下調ERK的磷酸化水平,促進H2O2處理后HaCaT細胞的GJIC功能。本研究發現10-8mol·L-1和10-9mol·L-1AHTN暴露可上調級聯分子MEK、ERK、PI3K和AKT的磷酸化水平(圖6),激活MAPK/ERK和PI3K/AKT信號通路,進而上調Cx43磷酸化水平,抑制GJIC功能。
綜上所述,本研究通過體外實驗,證明了環境相關濃度AHTN對人皮膚細胞活性及GJIC的影響,并對其可能的分子機制進行了分析。本研究發現AHTN一方面可以上調ERα的表達,通過ERα介導的基因組途徑,改變下游GJIC標志物Cx26和Cx43的表達,發揮弱的類雌激素效應;另一方面,AHTN可通過上調級聯分子MEK、ERK、PI3K和AKT的磷酸化水平,激活MAPK/ERK和PI3K/AKT信號通路,提高下游Cx43的磷酸化水平,進而導致HaCaT細胞的GJIC功能受到抑制(圖7)。本研究的結果將為客觀評價AHTN的生物毒性和致癌風險提供了科學依據。
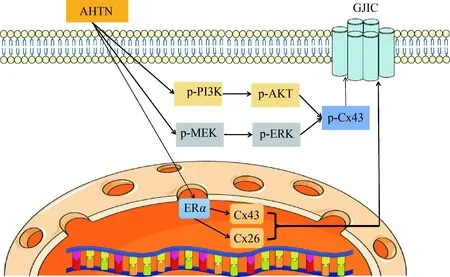
圖7 AHTN對HaCaT細胞GJIC功能可能分子機制推測Fig. 7 Putative mechanism of AHTN on GJIC function in HaCaT

