PM2.5急性暴露致運動大鼠BALF和心臟氧化損傷的相關性研究
李峰,何立
西安建筑科技大學體育學院,西安 710055
隨著對大氣顆粒物的深入研究和人們健康意識的增強,關于細顆粒物(fine particular matter,PM2.5)對運動人體健康風險評價的研究也日趨增多。流行病學研究發現,作為一類主要的污染物,PM2.5可以通過多種途徑進入生物體內,在體內產生含氧自由基等活性氧物質[1],并通過多種信號通路及酶反應引起氧化應激,造成生物體內的脂質過氧化[2]、蛋白質損傷和酶失活等[3],引起機體發生氧化應激。尤其是在運動的狀態下,由于呼吸加深加快,會使機體吸入更多的PM2.5,并且隨著血液循環進入到身體各組織中,誘導產生心肺功能障礙,造成機體的系統性損傷。目前,我國國內從多器官水平上研究不同濃度PM2.5對運動狀態下機體氧化-抗氧化網絡的影響尚處在探索階段。因此,本研究通過收集體育場館內PM2.5,研究其對運動狀態大鼠肺和心臟抗氧化系統的影響,以期為評價體育場館內細顆粒物濃度和機體氧化損傷之間的關系提供理論依據,同時也為PM2.5暴露劑量-運動反應之間的關系機制提供一定的實驗依據,研究結果亦可以為霧霾天氣下健身鍛煉者提供防護參考。
1 材料與方法(Materials and methods)
1.1 PM2.5的采樣及懸液制備
利用TH-150C型顆粒物智能采樣器(武漢天虹)采集某校體育館內PM2.5,采樣前清理采樣點周圍的運動器械及其他物品,同時確定采樣點為非污染源。為了最大程度模擬PM2.5對運動機體的影響,將儀器放置在人體呼吸帶高度(1.5 m),同時采用同心圓方式選取5個點,每2個采樣點之間相距5 m左右,使采樣儀器離墻>1 m、離門窗>3 m,空氣流量為1.13 m3·min-1。采樣時將已經真空干燥、稱量質量的濾膜放入采樣夾的濾網上,濾膜毛面朝進氣方向,將濾膜壓緊至不漏氣。采樣結束后將濾膜真空干燥,根據采樣前、后濾膜質量差和采樣體積得出顆粒物的質量濃度。將收集了PM2.5的玻璃纖維濾膜裁剪為小塊后浸入去離子水中,經超聲振蕩4次,每次30 min后用去離子水洗脫顆粒物,然后將濾液在4 ℃離心20 min(1 000 r·min-1,離心半徑59 mm),真空干燥后稱量質量,-20 ℃保存。為保證顆粒物實際毒性效果,實驗并未對顆粒物進行消毒滅菌處理,滴注前用0.9%生理鹽水配制成需要的濃度,超聲振蕩15 min使染毒懸液均勻,并滅菌備用。
1.2 實驗動物染毒劑量與染毒方式
運動大鼠采用非暴露式PM2.5氣管滴注染毒,滴注時保持室內溫度在20~26 ℃之間,室內相對濕度為44%~70%。滴注前先將染毒懸液預溫至37 ℃,在大鼠乙醚麻醉后,分別按低(7.5 mg·kg-1)、中(15 mg·kg-1)和高(30 mg·kg-1)3種劑量經氣管注入PM2.5顆粒物懸液,對照組滴注同等容量的生理鹽水,實驗大鼠染毒后進行運動。
1.3 實驗動物分組與運動方案
實驗動物選用32只7周齡健康雄性SPF級Wistar大鼠,體質量180~220 g。動物購回后在溫度為20~26 ℃、濕度為44%~70%的常規飼養籠內適應性喂養7 d,自由進食和飲水,照明隨同光照自然變化。所有動物處置均依照《關于善待實驗動物的指導性意見》的相關要求進行[4]。適應性喂養7 d后將大鼠隨機分為對照組(control group,CG)、高劑量染毒組(high-dose group,30 mg·kg-1,HG)、中劑量染毒組(middle-dose group,15 mg·kg-1,MG)和低劑量染毒組(low-dose group,7.5 mg·kg-1,LG)4組,每組8只,根據大鼠體質量/攝氧量回歸方程建立遞增負荷運動模型,正式訓練前將所有大鼠以10 m·min-1、5 min·d-1的方案先進行2 d的適應性訓練,具體運動方案如表1所示。

表1 實驗大鼠運動方案Table 1 Training program of experimental rats
1.4 肺泡灌洗液(BALF)和心臟組織勻漿的制備與指標測試
1.4.1 BALF制備
運動結束后用乙醚麻醉處死大鼠,切開頸部皮膚,暴露氣管,結扎左肺,在主氣管處剪一“V”形小切口,插人灌洗針頭,結扎固定。注射器抽取37 ℃生理鹽水緩慢注入肺內,同時輕輕按摩胸壁,待右肺變得膨隆后緩慢抽出灌洗液。灌洗2次,第1次注入6 mL,第2次注入3 mL,混勻抽吸2次,至灌洗液總量為6 mL。然后以4 000 r·min-1、4 ℃下離心20 min,取上清液于-20 ℃保存待測。
1.4.2 心臟組織勻漿液制備
大鼠宰殺后即刻稱取適量心臟組織,加入0.9%的生理鹽水,按體質量(g)∶體積(mL)=1∶9的比例加預冷的勻漿介質(pH 7.4,0.01 mol·L-1Tris-HCl,0.0001 mol·L-1EDTA-2Na,0.01 mol·L-1蔗糖,0.8%的NaCl溶液)于燒杯中,用眼科小剪盡快剪碎組織塊,然后倒入研缽中按照順時針方向進行研磨至糊狀。勻漿液通過二層紗布過濾后按試劑盒要求分別于低溫冷凍離心機4 000 r·min-1離心10 min,分離上清液,4 ℃冰箱保存備用或冷藏或-20 ℃冰箱冰凍備用,使用前按照試劑盒要求作相應的稀釋。
1.4.3 指標測試
采用5,5’-二硫代硝基苯甲酸(DTNB)比色法測定谷胱甘肽過氧化物酶(glutathione peroxide,GSH-Px)活性和丙二醛(malondialdehyde,MDA)、活性氧(reactive oxygen species,ROS)含量;采用羥胺氧化法測定總抗氧化酶(total superoxide dismutase,T-SOD)活性;過氧化氫酶(catalase,CAT)、谷胱甘肽(glutathione,GSH)采用分光光度方法測定。
1.5 統計學分析

2 結果(Results)
2.1 不同劑量PM2.5暴露對運動大鼠BALF抗氧化酶活性的影響
如表2所示,和CG組相比,除CAT之外,LG組中GSH-Px、T-SOD活性和GSH含量均高于CG組,其中GSH-Px活性有極顯著性差異(P<0.01);除GSH含量外,MG組、HG組GSH-Px、T-SOD和CAT活性呈劑量相關性下降,其中,GSH-Px、T-SOD活性與CG組相比差異有統計學意義(P<0.05,P<0.01),而GSH含量雖呈劑量相關性下降,但仍高于CG組,且有統計學意義(P<0.05,P<0.01)。
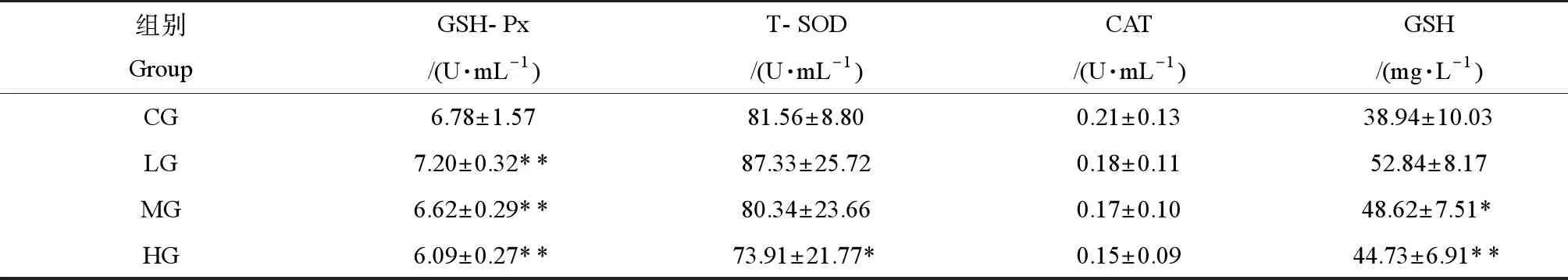
表2 PM2.5暴露對大鼠BALF抗氧化酶活性的影響(n=8)Table 2 Effects of PM2.5 exposure on antioxidant enzymes activity of BALF in rats (n=8)
2.2 PM2.5 暴露對運動大鼠心臟抗氧化酶活性的影響
如表3所示,和CG組相比,在3個劑量組中,隨著PM2.5劑量的增加T-SOD活性逐漸下降,差異具有統計學意義(P<0.05,P<0.01);而LG組GSH-Px活性與CG組相比略有上升,但MG組和HG組呈下降趨勢,且HG組與CG組相比有顯著性差異(P<0.05)。
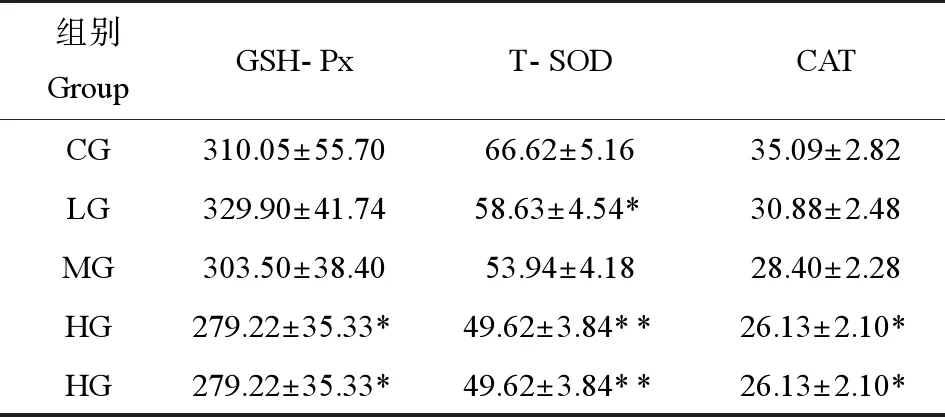
表3 PM2.5暴露對運動大鼠心臟抗氧化酶活性影響(n=8)Table 3 Effects of PM2.5 exposure on antioxidant enzymes activity of heart in rats (n=8) (U·mL-1)
2.3 PM2.5 暴露對運動大鼠BALF自由基含量的影響
運動及不同濃度PM2.5染毒對大鼠BALF自由基含量的影響如表4所示,由表4可知,和CG組相比,在3個不同劑量的PM2.5暴露組中,BALF中自由基含量隨著PM2.5暴露劑量的增加呈劑量相關性上升,差異有統計學意義。

表4 PM2.5對訓練大鼠BALF中丙二醛(MDA)、活性氧(ROS)含量的影響(n=8)Table 4 The influence on malondialdehyde (MDA) and reactive oxygen species (ROS) content of BALF of training rats after PM2.5 exposure (n=8) (U·mL-1)
2.4 PM2.5暴露對運動大鼠心臟自由基含量的影響
由表5可知,和CG組相比,在3個不同劑量的PM2.5暴露組中,隨著PM2.5暴露劑量的增加,MDA和ROS含量也成劑量相關性上升,差異有統計學意義。
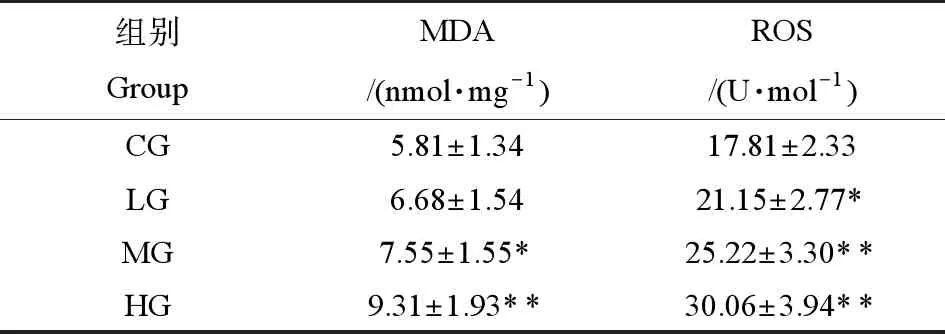
表5 PM2.5對訓練大鼠心臟MDA、ROS含量的影響(n=8)Table 5 The influence on (MDA) and (ROS) content of heart of training rats after PM2.5 exposure (n=8) (U·mL-1)
3 討論(Discussion)
3.1 PM2.5暴露對運動大鼠BALF抗氧化酶活性的影響
抗氧化系統作為內穩態平衡的調節因素之一,可以通過非酶類物質和酶類如抗氧化酶構成抗氧化防御的屏障,從而消解自由基對機體內穩態的破壞。PM2.5的機械損傷和生物化學損傷,會加重呼吸系統的炎癥及氧化應激反應。因此,BALF中抗氧化酶活性的改變是衡量PM2.5致肺組織氧化應激反應重要參考指標。心臟作為機體的動力器官,在運動過程中易受到外界應激,引起結構與功能改變[5]。以往研究表明,吸入空氣污染物會影響心率變異性、血管張力和動脈粥樣硬化的進展[6]。
由本實驗結果可知,不同劑量的PM2.5暴露對運動大鼠BALF內的GSH-Px、T-SOD、GSH和CAT產生不同的影響。其中和CG組相比,LG組中GSH-Px、T-SOD活性和GSH含量均出現上升趨勢,而CAT活性下降。而隨著PM2.5暴露劑量的增加,4個指標均呈現劑量相關性下降。分析其原因可能是由于大鼠在運動過程中受到神經和體液的調節,促進抗氧化酶活性的暫時性升高,以對抗運動過程中產生的自由基及PM2.5暴露帶來的負面影響,但是由于低劑量的PM2.5暴露對GSH-Px和T-SOD的負面影響不足以破壞機體的抗氧化防御系統,因此在LG組中呈現出GSH-Px和T-SOD活性升高的現象。
由于不同抗氧化酶的底物特異性、親合性以及在細胞中的位置不同,而且機體內決定抗氧化酶活性變化的一些因素很大程度上取決于不同的外界應激源及干擾因素,所以LG組CAT的降低,可能是低濃度的PM2.5暴露作為一種觸發因素,使CAT在PM2.5的刺激下出現防御性下降;但是隨著PM2.5暴露劑量的增加,MG和HG組中各酶活性出現顯著性下降,主要機制可能是PM2.5中的重金屬有機成分可以誘導自由基的產生,或通過GSH、還原型輔酶Ⅱ(NADPH)的電子轉移產生自由基[7]。當氧化應激增強時,細胞內ROS水平的升高導致溶酶體膜損傷,刺激肺組織與系統炎性因子和氧自由基的釋放,繼而促使氧化損傷[8]。染毒組GSH含量下降但仍高于CG組,推測隨著PM2.5劑量的增加,大鼠運動過程中H2O2生成增多,這些自由基與GSH中的—SH結合,大量消耗了組織中的—SH,加深了抗氧化酶的流失。染毒組GSH含量高于CG組,說明PM2.5染毒和力竭運動中自由基的增加反過來促進了氧化型GSH(GSSG)向還原型GSH的轉變,拮抗自由基的損傷。
3.2 PM2.5暴露對運動大鼠心臟抗氧化酶活性的影響
研究結果顯示,和CG組相比,LG組除GSH-Px外,心肌組織T-SOD和GSH在PM2.5染毒后下降,且T-SOD具有顯著性差異,在MG組和HG組中各酶活性下降。這說明心肌組織在抵抗由于運動和PM2.5染毒帶來的氧化損傷中處于劣勢。推測主要機制是:(1)運動或者PM2.5染毒造成了包括心肌結構改變、心肌間質膠原改建和心臟生物化學及心臟功能改變等方面的變化,從而使心臟包括抗氧化在內的一系列功能受損;(2)進入呼吸系統的PM2.5可通過血液循環引起心臟的氧化應激,削弱心臟的抗氧化功能,最終引發心血管系統損傷[9];(3)PM2.5作用于心臟后,其本身所吸附的有害物質會產生自由基,引起膜脂質過氧化、蛋白質氧化或水解,進而引起其抗氧化能力的下降;(4)由于本實驗大鼠的運動方案為一次性急性遞增負荷實驗,因此大鼠在運動過程中的肺通氣量會在短時間的內大幅度增加,同時中、高劑量的PM2.5由于攜帶更多的有害物質,會通過肺部進入血液循環,從而引起心臟的氧化應激反應[10];有研究表明,PM2.5對大鼠心臟氧化損傷程度隨PM2.5濃度的增加而增加,說明其抵抗自由基能力變弱[11];由于抗氧化酶活性的下降,誘導或抑制蛋白酶活性、引起心血管系統一系列病理和抗氧化能力的下降[12]。
3.3 PM2.5暴露對運動大鼠BALF和心臟ROS和MDA的影響
正常情況下,體內存在抑制自由基反應和清除自由基的抗氧化體系,從而維持體內自由基代謝的動態平衡[13]。但是當由于外界的強應激導致機體的內穩態發生紊亂時,可以造成機體自由基代謝的紊亂,使氧化與抗氧化失衡,造成對各組織系統的損傷[14]。本實驗數據顯示,PM2.5暴露可以升高BALF及心肌MDA和ROS的含量,表明當機體處于運動和PM2.5暴露應激狀態時,自由基的生成速度大于抗氧化系統的清除速度,造成ROS在體內的累積,對組織和細胞產生危害。尤其是PM2.5刺激組織誘導細胞產生的內源性ROS可以作為第二信使,通過改變氧化還原狀態調節與細胞增殖、分化及凋亡相關的信號轉導通路中多種靶分子的活性,最終決定細胞的命運[15]。在運動和PM2.5暴露組,各抗氧化酶活性總體呈下降趨勢,而組織中自由基的升高也對應了抗氧化酶的降低。
氧自由基的增加可以通過分子機制誘導氧化酶發生適應性變化,大強度訓練時機體處于脈沖式的氧化應激態中[16],同時運動過程中酸性代謝產物的堆積也產生較多的自由基。在低、中、高劑量濃度的PM2.5暴露后,MDA和ROS均呈劑量相關性升高,因此結合抗氧化酶的結果推測,PM2.5所含的炭核、氮、硫、多環芳烴、內毒素、細胞片段和過渡金屬等多種有害的化學成分,可以隨血液循環通過與各組織細胞接觸,并相互作用釋放出大量的ROS,穿過氣血屏障和血腦屏障,造成組織內氧化與抗氧化系統的失衡。

