超聲引導甲狀腺腫瘤微波消融術后腫瘤區遠期組織修復及血供狀況的臨床研究
韓江濤,劉紀蓉,鹿文靜,卿建兵,高艷穎,朱 欣
(1. 宜賓市第一人民醫院超聲科,四川 宜賓 644000 ;2. 川北醫學院,四川 南充 637000)
微波消融技術對具有消融指征的甲狀腺良惡性腫瘤的治療已在國內大力開展[1-2]。超聲引導甲狀腺微波消融即是在超聲引導下對病灶進行微波熱消融,從而導致其壞死,但消融后壞死組織仍位于腫瘤區。隨著術后時間的延長,消融區組織將會呈現不同的超聲改變。目前臨床上關于此手術近期療效的研究較多[3-4],對消融區遠期情況的研究較少。在本文中,筆者主要是探討超聲引導甲狀腺腫瘤微波消融術后腫瘤區遠期組織的修復及血供狀況。
1 資料與方法
1.1 一般資料
選取2016 年1 月至2019 年1 月在宜賓市第一人民醫院經病理證實的甲狀腺腫瘤23 例于微波消融術后約半年到2 年內進行消融區常規超聲復查、活檢及超聲造影。其中,男9 例,女14 例;年齡30 ~55 歲,中位數年齡42.5 歲。
1.1.1 病例納入標準 具有消融指征的甲狀腺腺瘤,生長速度較快,最大徑1 ~4 cm;乳頭狀癌,最大徑小于或等于1 cm 且未見異常淋巴結(特別是6、7 區)。
1.1.2 病例排除標準 有消融禁忌證、嚴重肝腎功能損害、嚴重出血傾向、冠心病心肌梗死、病灶過大且靠近大血管等重要結構、惡性病灶大于1 cm 或有淋巴結轉移者。
1.2 治療和檢測方法
1.2.1 超聲引導甲狀腺腫瘤消融治療 對于符合消融指征的甲狀腺腫瘤,先在彩超引導下向病灶周圍注入生理鹽水,以隔離保護病灶周圍正常組織。再將微波消融針準確穿入病灶,對病灶較大者由深到淺移動式逐次全面消融,微波消融治療采用南京億高微波消融儀,設置為連續模式,微波發射源距針尖約3.5 mm,微波向后輻射。設定功率30 W,采用腳踏控制(也可設定20 s 后自動斷開電源)。采用模式2,打開水循環冷卻系統, 累計消融時間約1 ~3 分鐘。消融至腫瘤區呈強回聲改變。
1.2.2 腫瘤消融區遠期組織檢測 消融術后半年到2年內使用西門子S2000-Helx 彩超、9L4 線陣探頭進行常規彩超檢查,并進行細針活檢及超聲造影。囑患者取頭部過伸仰臥位,詳細探查其甲狀腺消融區病灶,在二維圖像上清楚顯示消融區大小、位置、形態、邊界、內部回聲情況,采用彩色多普勒技術檢測消融區及周邊血流信號。制作細針針吸消融區細胞涂片,用無水乙醇固定后送檢。以團注的方式經肘正中靜脈注射SonoVue 混懸液(Braceo 公司)2.4 mL,啟動造影程序并行定量分析,觀察時間約3 min。觀察消融區造影劑的充盈情況,在SonoLiver CPS 定量分析軟件中將消融區及周圍正常甲狀腺組織設為感興趣區,測定Peak、TP、AUC、MTT,均測定5 次,求其平均值。
1.3 統計學方法
采用SPSS 22.0 軟件進行數據分析,超聲造影參數Peak、TP、AUC、MTT 等計量資料用均數± 標準差(±s)表示,采用t檢驗,計數資料用百分比(%)表示,采用χ2檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 術后遠期腫瘤消融區與周圍正常組織時間強度曲線造影參數的比較
在術后遠期,腫瘤消融區的Peak、TP、AUC、MTT 分 別 為(8.20±0.81)%、(47.88±3.81)s、(528.43±87.56)%s、(59.50±6.50)s,周圍正常區的Peak、TP、AUC、MTT 分 別 為(8.21±0.76)%、(48.02±3.65)s、(527.13±56.23)%s、(59.51±7.02)s。術后遠期腫瘤消融區與周圍正常區的Peak、TP、AUC、MTT 相比,差異無統計學意義(t=-0.019、-0.121、0.06、-0.05,P>0.05)。詳見表1。
表1 術后遠期腫瘤消融區與周圍正常組織時間強度曲線造影參數的比較(± s)

表1 術后遠期腫瘤消融區與周圍正常組織時間強度曲線造影參數的比較(± s)
造影區 例數 Peak(%) TP (s) AUC(%s) MTT(s)腫瘤消融區 23 8.20±0.81 47.88±3.81 528.43±87.56 59.50±6.50周圍正常區 23 8.21±0.76 48.02±3.65 527.13±56.23 59.51±7.02
2.2 常規彩超檢查
甲狀腺腫瘤消融區術后遠期(半年至兩年)常規彩超與周圍正常甲狀腺組織回聲高度相近,且分界不清,如下圖。

圖1 消融術前甲狀腺左葉TPC
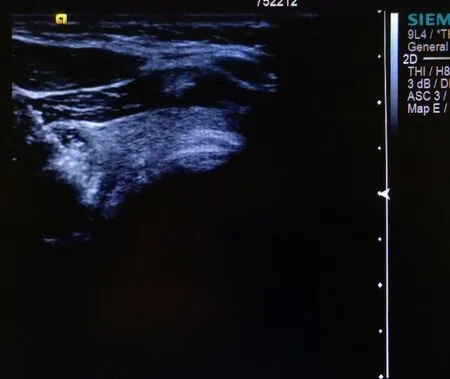
圖2 甲狀腺左葉TPC 消融術
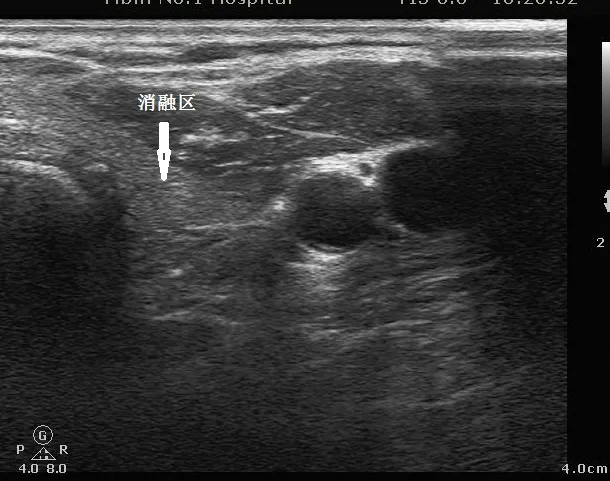
圖3 術后消融區遠期常規超聲
2.3 活檢
消融術后遠期消融區針吸活檢可見正常的甲狀腺濾泡上皮細胞(follicular epithelial cell,FEC),如圖4。
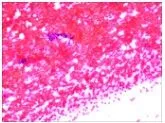
圖4 消融區遠期針吸細胞病理
2.4 術后遠期消融區超聲造影
術后遠期消融區超聲造影顯示,腫瘤區的造影劑充盈情況與周圍正常組織無明顯差異,如圖5,造影時間強度曲線如圖6。
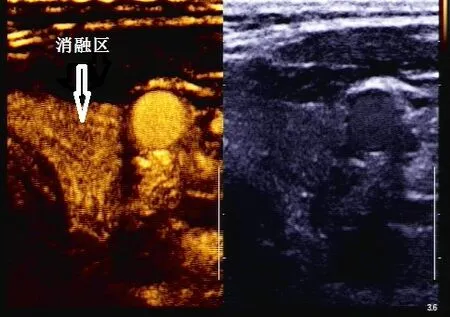
圖5 消融區遠期超聲造影
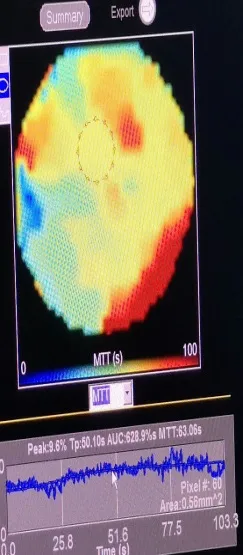
圖6 消融區遠期超聲造影參數
3 討論
隨著高清晰彩超的發展,越來越多的甲狀腺疾病被發現。甲狀腺腫瘤(結節)是常見病、多發病,其中良性腫瘤多為甲狀腺腺瘤,惡性腫瘤多為乳頭狀癌,約占5%[5-7]。有研究指出,在針吸細胞學(FNAB)診斷為良性腫瘤的甲狀腺實性結節患者中,手術切除病理結果為惡性者約占6%[8],故對于臨床和影像學檢查可疑惡性的甲狀腺腫瘤(結節),即使FNAB 診斷為良性病變仍應積極治療[9]。另外,對一些生長迅速、易引起局部壓迫癥狀的甲狀腺腫瘤或不能排除潛在惡性的甲狀腺腫瘤也要及時處理[10]。目前,甲狀腺腫瘤的治療趨向于微創化,其中對惡性腫瘤的治療越來越備受關注[11-12]。對于生長速度較快、小于4 cm的甲狀腺良性結節和良性腫瘤、懷疑惡性而小于1 cm的單發且無淋巴結腫大無外周侵犯或轉移的甲狀腺腫瘤、術后殘留或轉移的腫塊及淋巴結,臨床上應對其進行微波消融[13-14]。對鄰近氣管、食管、動脈、喉返神經、喉上神經、甲狀旁腺等重要結構的甲狀腺腫瘤進行液體隔離(hydro-dissection)可有效減少術后并發癥的發生。甲狀腺腫瘤微波消融既能有效去除腫瘤,又可最大限度減少并發癥,且能保持頸部美觀。這一微創技術的近期療效較為理想[15]。有研究指出,甲狀腺腫瘤微波消融后近期偶可出現疼痛、一過性聲音嘶啞、一過性甲功異常等并發癥。目前,臨床上對甲狀腺腫瘤微波消融后遠期療效、消融區遠期組織修復及血供情況的研究文獻相對較少。對甲狀腺腫瘤微波消融術后消融區的評估主要通過常規彩超、穿刺活檢[16-17]和超聲造影[18-19]。常規彩超可掃查腫瘤消融區的二維改變、回聲是否均勻、與周圍正常甲狀腺組織的回聲是否一致。穿刺活檢可得到消融區組織的病理結果,可區分壞死組織、纖維組織與修復后的正常甲狀腺組織。常規彩超可以檢查消融區的血流信號(即血供狀況),但超聲造影可更全面地反映組織的血液灌注。造影相關參數(如TP、Peak、AUC、MTT)可精確量化組織的血液供應。腫瘤區消融術后即刻呈強回聲改變,超聲造影時無造影劑進入,表現為黑洞征,粗針活檢為消融壞死組織。隨著消融術后時間的延長,消融區范圍逐漸縮小,回聲逐漸變低并接近周圍正常甲狀腺組織,術后遠期(大約在術后半年到兩年內)消融區壞死組織會逐漸吸收。對于病灶較大的消融區常規超聲偶可表現為回聲欠均勻,但隨著時間的再延長,其最終超聲表現與周圍正常甲狀腺組織無明顯差異, 很少出現因消融區較大致吸收不全而液化形成膿腫的情況;針吸活檢可見正常甲狀腺濾泡上皮或少許增生的濾泡上皮細胞;超聲造影可見造影劑進入并與周圍正常甲狀腺組織造影時間強度曲線的TP、Peak、AUC、MTT 無統計學差異。微波消融與傳統外科手術相比具有創傷小、患者恢復快的優點,可被認為是符合患者利益的建設性治療模式,由于產生的能量高,用于較大體積甲狀腺腫瘤治療時,療效同樣可靠[20-21]。由于本研究病例數相對較少,對消融區遠期組織的修復尚不能充分顯示。有文獻表明,射頻消融時部分患者會出現術中頸部疼痛及耳根、牙齒放射痛[22],少數患者即使進行液體隔離,仍有可能出現喉返神經損傷的表現[23], 本組病例中也有因并發癥的不適等原因而術后拒絕活檢者。有研究指出,超聲引導甲狀腺腫瘤微波消融術有望成為甲狀腺良性腫瘤(結節)、早期惡性及術后復發腫瘤的一線治療方案[24-26]。
綜上所述,有消融指征的甲狀腺腫瘤患者進行超聲引導甲狀腺腫瘤微波消融術后其腫瘤區遠期組織的修復及血供狀況良好。

