補腎活血方對人胚肺成纖維細胞IL-17A、LC3-Ⅱ影響的實驗研究*
劉曉明,李 芮,高善語
(山東中醫藥大學附屬醫院 濟南 250014)
特發性肺纖維化(Idiopathic pulmonary fibrosis,IPF)是一種發病機理不明確的間質性肺疾病,目前臨床缺乏有效治療方法及藥物。其中,細胞外基質的過度沉積是肺纖維化的主要病理改變[1-2],而細胞自噬正是保護細胞穩態的重要途徑,近來有研究發現細胞自噬調節與肺纖維化的發病密切相關,自噬受損還誘導更高的炎癥反應并增加膠原蛋白的積累,自噬-溶酶體降解途徑則是肺纖維化中降解膠原的主要途徑[3],提示自噬調節失調可能是肺纖維化發病的重要機制之一,而靶向調控自噬有望成為肺纖維化的診療新靶點和方向。有研究發現白介素17A 型細胞因子(Interleukin-17,IL-17A)能夠通過活化stat3 信號途徑調節自噬相關核心復合物組分表達與活化,進而自噬小體的活性被抑制,進一步干預細胞內外膠原蛋白的纖溶及降解。而在多項實驗中發現在多種組織纖維化模型中阻斷IL-17A 能夠使纖維化組織中受損的自噬活性得到顯著恢復,進而阻斷多種組織纖維化的進展。由此提出抑制IL-17A可激活自噬活性,延緩各種纖維化的發生及發展。進而我們推測阻斷IL-17A 靶向調控自噬有望成為肺纖維化的診療新靶點和方向。補腎活血方為經臨床驗證對肺纖維化有確切療效的中藥處方,前期通過網絡藥理學研究發現該方的臨床療效可能與IL-7A 以及細胞自噬有密切相關性,因此設計該體外實驗,觀察補腎活血方對纖維化模型中COL-I(I 型膠原蛋白,Collagen I)、IL-17A 及自噬小體含量的影響,探討補腎活血方在肺纖維化中的作用靶點。為下一步體內實驗指明方向,為明確具體的信號通路奠定基礎。本實驗具體流程圖見圖1。

圖1 實驗流程圖
1 實驗材料
1.1 實驗細胞株和主要試劑
人胚肺成纖維細胞MRC-5(賽百慷上海生物技術股份有限公司);TGF-β1(轉化生長因子-β1,Transforming growth factor-β1)(MCE中國)。
1.2 主要實驗儀器設備
超凈工作臺(蘇州凈化SW-CJ-IFD);HERACELL 150i 二氧化碳恒溫培養箱(日本SANYO 公司XD-101);顯微鏡(日本OLYMPUS公司IX51);臺式低速離心機(廣州吉迪儀器有限公司);高速冷凍離心機(德國eppendorf 公司5024R);酶標儀(山東恒美電子科技有限公司);EPS-300 水平電泳儀(賽默飛世爾科技中國);VE-186蛋白轉膜儀(賽默飛世爾科技中國);VE-180蛋白電泳儀(賽默飛世爾科技中國)。
2 實驗方案
2.1 補腎活血方血清制備
2.1.1 補腎活血方中藥湯藥制備
課題組于濟南市西嶺角養殖中心購入新西蘭兔20 只,雄性,體質量2.75±0.25 kg(SCXK(Lu) 201501)。將上述新西蘭兔飼養于山東省中醫院動物實驗中心。所有新西蘭兔在實驗過程中均可自由進食和飲水。將8 倍新西蘭兔等效劑量的中藥準確稱取,加入8 倍量的水浸泡后煎煮,藥液過濾濃縮,濃度為5 g·mL-1(生藥量),置4℃冰箱保存備用[1]。
2.1.2 制備過程
健康新西蘭兔隨機分為含藥血清組和正常血清組。
以56 g·kg-1生藥量對新西蘭兔進行灌胃。在灌胃前,對新西蘭兔禁食12 h,其中含藥血清組1 日灌胃2次11.2 mL/(kg·天),正常血清組以等體積0.9% NaCl灌胃1日2次。連續灌胃給藥7天,在末次給藥1 h后,對仍處在自然意識狀態下的新西蘭兔,腹腔注射1%利多卡因5 mL,取腹主動脈血。將所取血液置于37℃下放置1 h。血凝后,5000 r/min 離心10 min。分離血清,將同組血清混合,并滅活補體。然后使用0.22 μm醋酸纖維素膜對血清進行過濾和消毒,在-20°C 下保存以備將來使用[1]。
2.2 實驗細胞的培養
MRC-5 細胞被置于5% CO2、37℃培養箱中,在添加10%胎牛血清的不完全DMEM 培養基(Dulbecco′s modification of Eagle′s medium Dulbecco,改良Eagle 培養基)中生長,并以傳代后狀態較好的第3-4代細胞進行實驗。
2.3 實驗分組及藥物干預
參照文獻[3]及預實驗結果,確定TGF-β1 誘導MRC-5細胞活化的最佳濃度為5 ng·mL-1,最佳刺激時間為48 h。
2.3.1 實驗分組一
對照組,不同稀釋倍數的含藥血清組(1 倍、1/2倍、1/4倍、1/8倍、1/16倍、1/32倍、1/64倍、1/128倍)。
2.3.2 實驗分組二
空白對照組,TGF-β1處理組,TGF-β1處理+最佳濃度含藥血清干預1 h 組(含藥血清組),TGF-β1 處理+基因敲除陰性對照組(sh-NC 組),TGF-β1 處理+IL-7A 基因敲減組(sh-IL-17A 組),TGF-β1 處理+最佳濃度含藥血清干預1 h+過表達質粒陰性對照組(Vector 組),TGF-β1 處理+最佳濃度含藥血清干預1 h+IL-17A過表達質粒組(IL-17AOE組)。
2.4 MTT法測定各組對MRC-5細胞增殖的抑制情況
將細胞隨機分為9組,包括正常組(正常DMEM培養基)及不同稀釋濃度含藥血清干預組。各組細胞置于培養箱中(37℃5%CO2)培養24 h,棄去舊培養液,每孔加入20 μL MTT 液(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,Thiazolyl Blue Tetrazolium Bromide,3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽),繼續在培養箱中孵育4 h,棄去MTT液,加入DMSO,震蕩搖勻后在避光孵育15 min,酶標儀讀取波長490 nm 處各孔OD 值并記錄,實驗重復3次[1]。
2.5 CCK8(Cell Counting Kit-8)法檢測含藥血清對MRC-5細胞增殖的影響
MRC-5 細胞以1×105/孔接種于96 孔微量滴定板,除空白對照組外,其余各組加入TGF-β1 誘導48 h。然后更換100 μL新培養基,加入10%CCK8,于培養箱中培養4 h,用酶標儀在450 nm 測各組OD 值,實驗重復3次[1]。
2.6 RT-qPCR 技術(Real time Quantitative PCR,實時熒光定量)檢測含藥血清對MRC-5 細胞中IL-17A 含量的影響
用超純RNA提取試劑盒提取樣本中總RNA,采用RT-qPCR 方法檢測mRNA 的表達水平,以GAPDH(glyceraldehyde-3-phosphate dehydrogenase,甘油醛-3-磷酸脫氫酶)作為內參基因。表1-表2 為引物序列。

表1 IL-17A引物序列

表2 COL-Ⅰ引物序列
2.7 Western blot(蛋白質印跡法)檢測COL-Ⅰ、IL-17A、LC3Ⅱ(膜型自噬體)含量的變化
抽提總蛋白,具體操作按試劑盒說明進行。最后放入凝膠成像儀中顯影。
2.8 統計學方法
應用SPSS 21.0軟件分析實驗數據,應用單因素方差分析(One-Way ANOVA)進行具體分析,組間比較結果以平均值±標準差(±s)的形式表示,P<0.01 表明差異具有顯著統計學意義,P<0.05 差異具有明顯統計學意義。
3 實驗結果及分析
3.1 最佳濃度含藥血清的選擇
3.1.1 各組含藥血清對MRC-5細胞的抑制情況
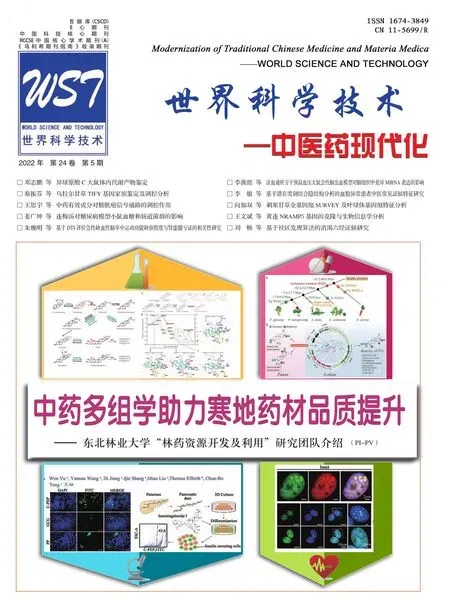
由圖2 可見,當含藥血清稀釋至0.0625 倍(1/16)時,細胞抑制率為10.06%,該藥物濃度下,細胞抑制率較低,對細胞損傷小,相對安全,故將含藥血清濃度稀釋至0.0625倍定為本實驗的藥物最大無毒濃度。
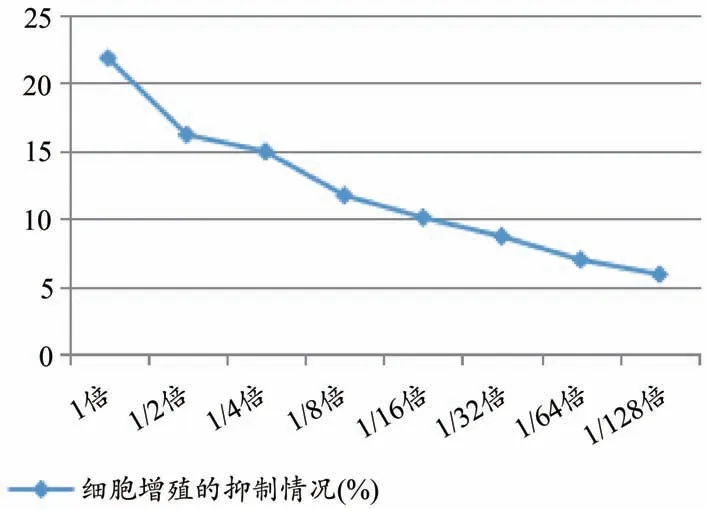
圖2 各組對MRC-5細胞增殖的抑制情況
3.1.2 Western blot法檢測各組COL-I 蛋白含量情況
由圖3 顯示,組間分析顯示,MRC-5 細胞加入含藥血清干預后,細胞內COL-ⅠmRNA 表達最大無毒濃度組(a組)降低最明顯。
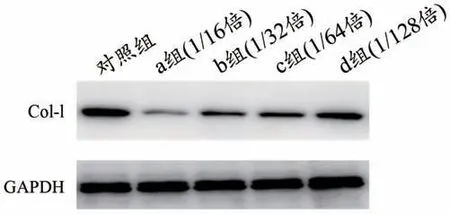
圖3 不同濃度含藥血清對細胞內COL-Ⅰ蛋白含量的影響
3.2 含藥血清對MRC-5細胞增殖的影響
表3 顯示,與空白對照組比較,TGF-β1 處理組的MRC-5 細胞增殖水平顯著增加(P<0.01),增殖率為15.21%。
表3 含藥血清對MRC-5細胞增殖的影響(±s)
表3 含藥血清對MRC-5細胞增殖的影響(±s)
注:▲與空白組相比較,P<0.01;▼與模型組相比較,P<0.01。
組別空白對照組TGF-β1處理組含藥血清組sh-IL-17A組IL-17AOE組OD值2.493±0.213 3.198±0.137▲2.473±0.086▼2.480±0.123▼3.215±0.126增殖抑制率(%)22.67 22.45
3.3 各組MRC-5細胞中IL-17A mRNA的表達量
3.3.1 含藥血清組與TGF-β1 處理組、空白對照組MRC-5細胞中的IL-17A mRNA表達量比較
表4、圖4 中,TGF-β1 處理組與空白對照組MRC-5 細胞中的IL-17A mRNA 表達量比較(P<0.05),含藥血清組與TGF-β1 處理組MRC-5 細胞中的IL-17A mRNA表達量比較(P<0.01)。
表4 含藥血清對IL-17A mRNA表達量的影響(±s)
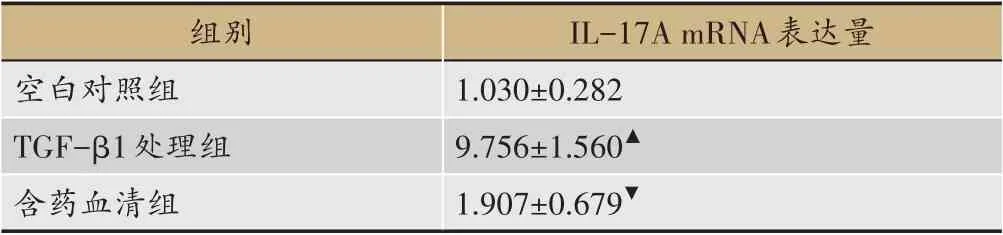
表4 含藥血清對IL-17A mRNA表達量的影響(±s)
注:▲與空白組相比較,P<0.05;▼與模型組相比較,P<0.05。
組別空白對照組TGF-β1處理組含藥血清組IL-17A mRNA表達量1.030±0.282 9.756±1.560▲1.907±0.679▼
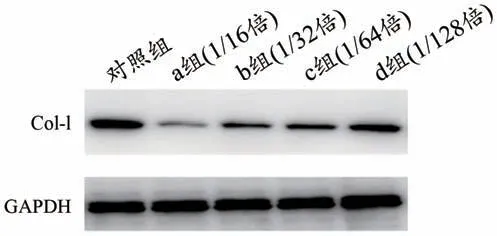
圖4 含藥血清對IL-17A mRNA表達量的影響
3.3.2 sh-NC 組與sh-IL-17A 組MRC-5 細胞中IL-17A mRNA表達量比較
表5、圖5 中,sh-NC 組與sh-IL-17A 組MRC-5 細胞中的IL-17A mRNA表達量比較(P<0.01)。
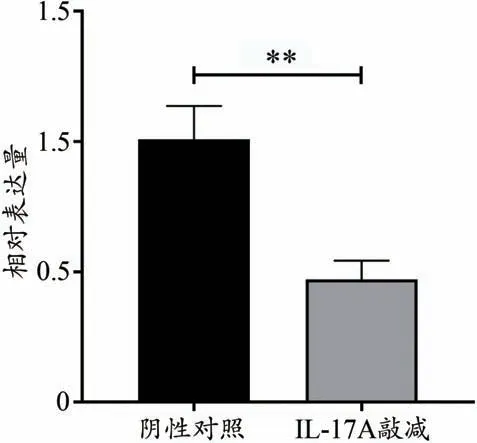
圖5 IL-17A基因敲除后IL-17A mRNA表達量的影響
表5 IL-17A基因敲除后IL-17A mRNA表達量的影響(±s)
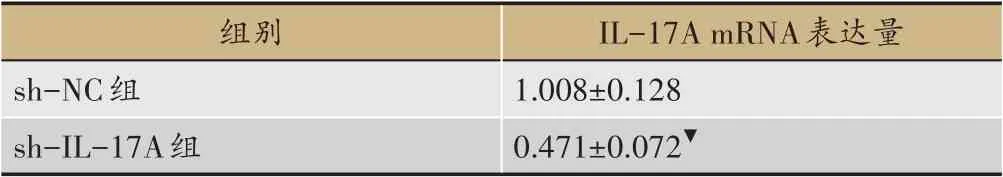
表5 IL-17A基因敲除后IL-17A mRNA表達量的影響(±s)
注:▼與sh-NC組相比較,P<0.05。
組別sh-NC組sh-IL-17A組IL-17A mRNA表達量1.008±0.128 0.471±0.072▼
3.3.3 IL-17AOE 組與Vector 組MRC-5 細胞中的IL-17A mRNA表達量比較
表6、圖6 中,IL-17AOE 組與Vector 組MRC-5 細胞IL-17A mRNA表達量比較(P<0.01)。
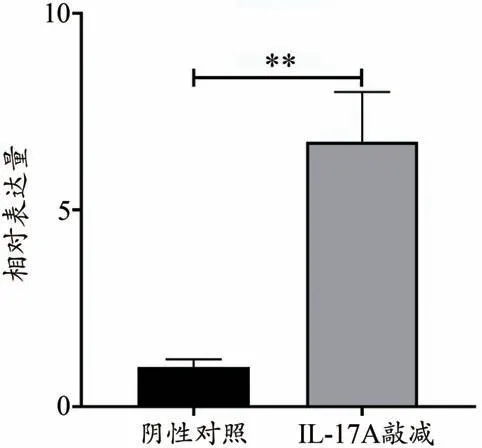
圖6 IL-17A質粒過表達后對IL-17A mRNA表達量的影響
表6 IL-17A質粒過表達后對IL-17A mRNA表達量的影響(±s)
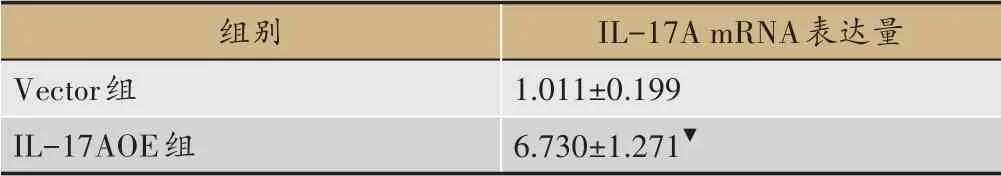
表6 IL-17A質粒過表達后對IL-17A mRNA表達量的影響(±s)
注:▼與Vector組相比較,P<0.05。
組別Vector組IL-17AOE組IL-17A mRNA表達量1.011±0.199 6.730±1.271▼
3.4 各組MRC-5細胞中COL-Ⅰ、IL-17A蛋白含量情況
COL-Ⅰ:圖7 顯示,含藥血清組細胞中COL-Ⅰ蛋白含量較TGF-β1處理組明顯降低;sh-IL-17A組細胞中COL-Ⅰ蛋白含量較sh-NC 組明顯減少,而IL-17AOE 組細胞中COL-Ⅰ蛋白含量較Vector 組明顯增加。
IL-17A:圖7 顯示,TGF-β1 處理組細胞中IL-17A蛋白含量量較空白對照組明顯增多,而含藥血清組細胞中IL-17A 蛋白含量較TGF-β1 處理組明顯減少;sh-IL-17A 組細胞中IL-17A 蛋白含量較sh-NC 組明顯減少,而IL-17AOE 組細胞中IL-17A 蛋白含量較Vector組明顯增加。

圖7 各組MRC-5細胞中COL-Ⅰ、IL-17A蛋白含量情況
3.5 各組MRC-5 細胞中自噬小體LC3-Ⅱ蛋白含量情況
圖8 激光共聚焦顯微鏡下觀察自噬小體的形態
圖8、圖9 顯示,與TGF-β1 處理組比較,含藥血清組細胞中LC3-Ⅱ蛋白含量明顯增多;與sh-NC 組比較,sh-IL-7A 組細胞中LC3-Ⅱ蛋白含量增多,而與Vector 組比較IL-7AOE 組細胞中LC3-Ⅱ蛋白含量明顯減少。
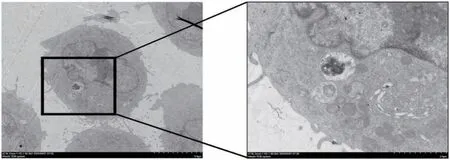
圖8 激光共聚焦顯微鏡下觀察自噬小體的形態
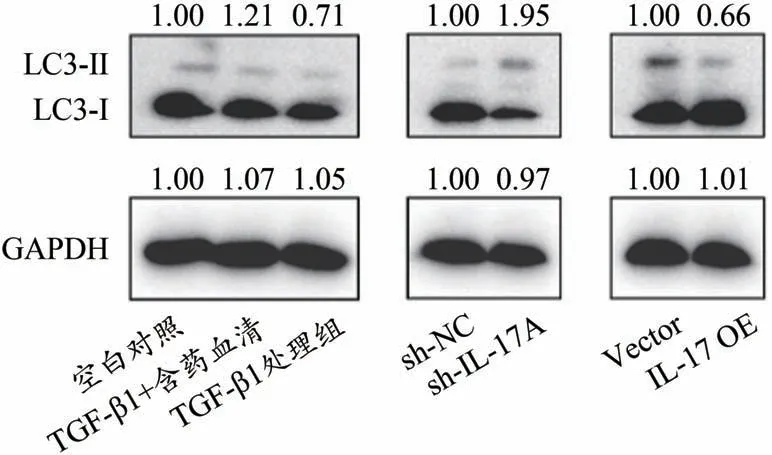
圖9 各組溶液對MRC-5細胞內自噬小體LC3-Ⅱ蛋白表含量情況
4 討論
研究表明,肺間質纖維化的形成與炎癥反應、氧化應激、細胞因子異常釋放、免疫系統失調、微循環障礙及細胞增殖、重構等有關[4],最終導致細胞外基質(即不溶性纖維蛋白)的過度沉積或者分解減少[2]。有研究發現阻斷IL-17A 的活性,激活細胞自噬,能夠阻斷膠原蛋白的異常沉積。因此,IL-17A可能成為肺纖維化治療的新靶點。
IL-17 是一種細胞因子,家族中最具代表性的成員IL-17A,一方面會誘導炎癥因子以及趨化因子的表達,另一方面會誘導一些組織修復相關因子的表達加速機體的恢復[5]。過高的IL-17A水平對于疾病的病理發展起到惡化作用。2010年,Wilson等人發現IL-17A的受體被敲除后,由博萊霉素誘導的肺組織纖維化程度得到顯著改善[6]。近年來有研究表明,IL-17A 還可以通過非TGF-β1 依賴途徑抑制自噬活化,進而抑制膠原降解[7-9]。因此,IL-7A 可能成為治療肺纖維化的潛在靶點,阻斷IL-17A的活性為其關鍵路徑。其中一條為IL-17A 的自噬活化機制,阻斷IL-17A 能夠抑制Vps34(Ⅲ型磷酸肌醇3-激酶,PI3K),進而通過GSK3β信號通路激活抑制性蛋白Bcl-2(B-cell lymphoma-2,B 淋巴細胞瘤-2)的ser70 位的磷酸化,抑制Bcl-2 與Beclin-1(programmed cell death-1,程序性死亡受體-1)結合,最終促進自噬活化,增加膠原蛋白的降解。自噬主要通過調節膠原降解和細胞凋亡來控制或者延緩肺纖維化的進展[10-11]。許多研究報道認為纖維化肺細胞中的自噬活性是降低的、促纖維化反應是激活的[12]。在肺纖維化患者的肺組織中可檢測到自噬小體,應用具有生物活性的自噬小體來評價自噬的活性[13-16]。自噬核心復合物(Bcl-2、Beclin-1、Vps34、Vps15、Atg14 以及Ambral 等)在自噬的活化過程中發揮了極其重要的作用,當Bcl-2 與Beclin-1 結合時,自噬被抑制;當Bcl-2 與Beclin-l 解離時,自噬被活化[17-18]。因此,Bcl-2 與Beclin-1 結合與否,是自噬活化的關鍵。因此,研究有效藥物通過抑制Bcl-2 與Beclin-1的結合,自噬活性被活化,進一步降解肺組織中膠原成分,阻斷甚至逆轉組織纖維化,為治療肺纖維化疾病提供新的治療思路。
課題組應用李芮教授治療肺纖維化的協定方補腎活血方(人參9 g,黃芪30 g,熟地黃15 g,山茱萸9 g,麥冬15 g,五味子6 g,當歸15 g,丹參15 g,黃芩15 g,川貝母6 g,虎杖18 g,炙甘草6 g),以傳統中醫理論為指導進行了一系列的臨床及實驗研究。其中2011 年在對慢阻肺合并肺纖維化的臨床觀察中發現,該方對老年患者的癥狀、體征有顯著改善作用,同時能夠升高隨增齡而降低的IgM,調節免疫球蛋白的改變,同時對炎癥指標CRP 亦有明顯的降低作用。因此可以從中看出補腎活血方治療肺纖維化可能通過調節免疫、減輕炎癥反應等方面來實現的[19]。而近年來在對該方的進一步臨床研究發現,補腎活血方治療IPF 療效確切,既能夠改善肺內換氣功能、提高動脈血攜氧能力、調節氧化/抗氧化失衡、減輕抗炎癥反應,同時還抑制膠原蛋白異常沉積,從而達到治療IPF 的良好療效[20]。方中以人參、黃芪、麥冬、熟地黃以補肺益腎,共為君藥;山茱萸、五味子上斂肺氣、下固腎精,共為臣藥;佐以當歸、丹參活血通絡,黃芩、虎杖以清瀉肺熱,川貝母、炙甘草祛痰止咳,六藥合用共祛瘀、痰、熱毒;炙甘草兼為使藥,以調和諸藥。“補腎活血方”對正氣虧虛、痰瘀毒聚所致的肺纖維化具有顯著的臨床療效。
基于以上研究基礎,我們提出假說:補腎活血方扶正、祛瘀、化痰、解毒,減少膠原蛋白的異常沉積是其治療肺間質纖維化的關鍵環節,其機制可能與IL-17A/PI3K/GSK3β信號通路調控細胞自噬密切相關。
根據圖10 假說我們課題組進行了一系列相關實驗研究,基于詳細的實驗數據分析可知:
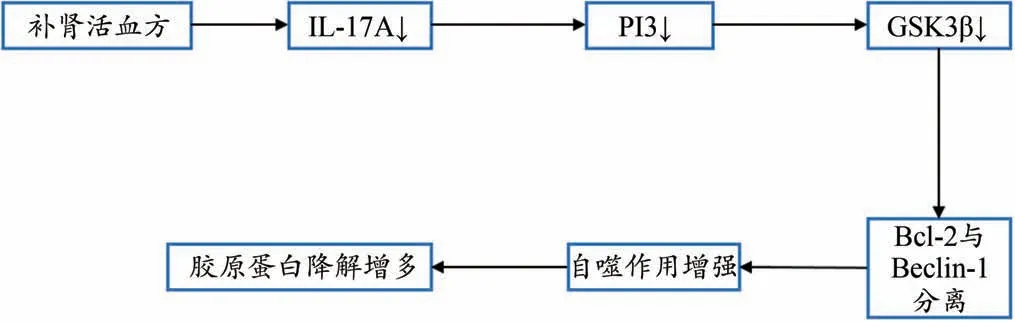
圖10 課題假說圖
首先,通過測定不同濃度含藥血清對MRC-5細胞增殖的抑制情況,選取含藥血清的最大無毒濃度。組間分析顯示,最大無毒濃度組(a 組)降低最明顯(P<0.01),a、b組與對照組兩兩比較差異性顯著,具有統計學意義,c、d組無明顯差異。因此最終選定a組濃度為本研究的最佳有效濃度。
其次,TGF-β1 處理組MRC-5 細胞的增殖率及COL-Ⅰ的蛋白表達量明顯高于空白對照組,說明應用TGF-β1作用MRC-5細胞造模成功。
第三,與TGF-β1 處理組比較,含藥血清組和sh-IL-17A 組細胞增殖水平均降低(P<0.01),且兩組之間細胞增殖率無明顯差異(P>0.05);而IL-17AOE 組細胞增殖水平與TGF-β1 處理組相似,兩組之間無明顯差異(P>0.05)。同時與TGF-β1 處理組比較,含藥血清組細胞中COL-Ⅰ的蛋白含量明顯降低,sh-IL-17A組細胞中COL-Ⅰ蛋白含量較sh-NC 組明顯減少,而IL-17AOE組細胞中COL-Ⅰ蛋白含量較Vector組明顯增加。說明含藥血清能夠明顯的降低MRC-5 細胞中膠原蛋白的含量,也可以說補腎活血方可有效的降低MRC-5細胞內的膠原蛋白的含量,其作用途徑可能與阻斷IL-17A通路有關。
第四,各組IL-17A mRNA表達量及蛋白含量比較中可以看出,而含藥血清組細胞中IL-7A mRNA 表達量及IL-17A 蛋白含量較TGF-β1 處理組明顯減少,且sh-IL-17A組細胞中IL-7A mRNA表達量及IL-17A蛋白含量較sh-NC 組明顯減少。IL-17AOE 組細胞中IL-7A mRNA 表達量及IL-17A 蛋白含量較Vector 組明顯增加。進一步驗證了該方是通過阻斷IL-17A 通路而起到治療肺纖維化作用的。
第五,在各組MRC-5 細胞內自噬標記蛋白LC3-Ⅱ含量比較中發現,TGF-β1 組較空白對照組MRC-5細胞中的LC3-Ⅱ蛋白含量降低,而與TGF-β1 處理組比較,含藥血清組細胞中LC3-Ⅱ蛋白含量明顯增多與sh-NC組比較,sh-IL-7A組細胞中LC3-Ⅱ蛋白含量增多,而與Vector組比較IL-7AOE組細胞中LC3-Ⅱ蛋白含量明顯減少。進一步說明了補腎活血方治療肺纖維化是通過阻斷IL-17A 通路、激活細胞自噬、降解膠原蛋白而實現的。
總之,通過本實驗我們發現,補腎活血方主要是通過阻斷IL-17A、激活細胞自噬、進而降解膠原蛋白來實現對肺間質纖維化的治療作用。該實驗是山東中醫藥科技發展計劃的一項在研課題,也是濟南市科技局臨床醫學科技創新計劃課題的一部分,該實驗主要是以MRC-5細胞為研究對象,通過相關指標檢測準確找到中藥復方(補腎活血湯)靶向治療的分子靶點,是本項目的創新,為下一步動物實驗指明研究方向,為進一步明確具體的信號通路奠定基礎,并詳細闡釋中藥復方的靶向治療機理,為臨床應用中藥治療IPF提供新的方法及理論支持。