轉(zhuǎn)錄和蛋白質(zhì)組學(xué)分析熱空氣處理對桃果實采后冷藏期間糖酸和酚類物質(zhì)代謝的影響
周丹丹,李婷婷,吳彩娥,屠 康
(1.南京林業(yè)大學(xué)輕工與食品學(xué)院,江蘇 南京 210037;2.南京農(nóng)業(yè)大學(xué)食品科學(xué)技術(shù)學(xué)院,江蘇 南京 210095)
水蜜桃屬于呼吸躍變型果實,采收多集中于高溫高濕的夏季,常溫貯藏過程中受病菌侵染易腐敗變質(zhì),造成品質(zhì)嚴(yán)重劣變。桃果實采后極不耐貯,嚴(yán)重限制了桃產(chǎn)業(yè)的發(fā)展。低溫有利于延緩桃果實后熟過程,但桃屬于冷敏型果實,低溫貯藏易發(fā)生冷害,從而引起一系列生理生化和品質(zhì)變化,如果實風(fēng)味變淡、可溶性糖和有機(jī)酸含量下降、果肉木質(zhì)化、組織發(fā)生褐變等,影響了果實的正常后熟。采后處理技術(shù)等外界因素對果實品質(zhì)具有重要影響,因此,研究釆后保鮮技術(shù)對桃果實生理代謝的影響具有重要意義。
熱空氣(hot air,HA)處理指將樣品置于35~50 ℃環(huán)境中進(jìn)行短時處理,目前已廣泛應(yīng)用于果蔬的采后貯藏保鮮中。HA處理可以有效延緩果實的成熟衰老,抑制果實的腐敗變質(zhì),提高果實的抗冷性,延長果實的貨架期。研究表明,HA處理可以通過增強(qiáng)熱激蛋白的表達(dá)量協(xié)同提高果實細(xì)胞膜的流動性和完整性,從而提高果實的抗冷害能力。同時,HA處理能夠誘導(dǎo)果實次級代謝物的合成和抗氧化酶的活性,激活植物組織的抗病性,從而提高果蔬的抗病能力。
轉(zhuǎn)錄組和蛋白質(zhì)組研究可以鑒定基因/蛋白的功能、探索基因/蛋白的調(diào)控過程、鑒定差異基因/蛋白,為探索果實采后生理變化的機(jī)理提供有利的工具,目前已在番茄、桃、葡萄、黃皮、石榴和馬鈴薯等果蔬中廣泛應(yīng)用。考慮到HA處理激發(fā)桃果實多條代謝途徑的復(fù)雜性,本研究采用轉(zhuǎn)錄組學(xué)和蛋白質(zhì)組學(xué)研究HA處理對桃果實采后糖酸和酚類物質(zhì)代謝的影響,以期從基因水平和蛋白水平揭示HA處理對桃果實采后冷藏過程中的分子調(diào)控機(jī)制。
1 材料與方法
1.1 材料與試劑
‘霞暉8號’水蜜桃采自江蘇省農(nóng)科園,選取開花后110 d左右的商業(yè)成熟期桃果實于當(dāng)天采收立即運回實驗室,挑選大小一致,著色均勻,成熟度一致且無病蟲害和機(jī)械損傷的果實作為實驗對象(720 個果實),于4 ℃環(huán)境下預(yù)冷過夜。
葡萄糖、果糖、蔗糖、檸檬酸、蘋果酸(標(biāo)品)上海源葉生物科技有限公司;乙腈(色譜純) 美國Sigma公司。
1.2 儀器與設(shè)備
CTHI-250B恒溫恒濕箱 施都凱儀器設(shè)備(上海)有限公司;BGISEQ-500通用測序儀 深圳華大基因股份有限公司;ABI 7500型定量聚合酶鏈?zhǔn)椒磻?yīng)核酸擴(kuò)增儀 美國Applied Biosystems公司;LC 20AB高效液相色譜 日本島津公司;UltiMate 3000超高效液相色譜、Q Exactive HF X串聯(lián)質(zhì)譜儀 美國賽默飛公司。
1.3 方法
1.3.1 桃果實分組與處理
熱空氣(HA)組:將桃果實置于聚乙烯(polyethylene,PE)保鮮袋中后于40 ℃、相對濕度90%~95%的恒溫恒濕箱中處理4 h。
對照(CK)組:將桃果實置于PE保鮮袋中后于20 ℃,相對濕度90%~95%的恒溫恒濕箱中處理4 h。
將上述處理后的桃果實于(1±1)℃冷庫中貯藏35 d,每隔7 d取樣進(jìn)行指標(biāo)(可溶性糖、有機(jī)酸、總酚、總黃酮、花色苷含量)測定。實驗每組處理設(shè)置3 個平行,每個平行包含20 個果實,整個實驗重復(fù)3 次。將貯藏至第0、7、21、35天的樣品用于轉(zhuǎn)錄組分析,將貯藏至第0、7、35天的樣品用于蛋白質(zhì)組分析。
1.3.2 可溶性糖和有機(jī)酸含量測定
桃果實糖酸含量的測定參考Yu Lina和Tang Mi等的方法并稍作修改。取5 g桃果肉樣品充分研磨,加入30 mL蒸餾水充分溶解,在80 ℃的水浴鍋中采用超聲波提取1 h。將上述樣品8 000×離心10 min后取上清液并用0.45 μm水系濾膜過濾備用。
可溶性糖含量測定:色譜柱為碳水化合物柱(250 mm×4.6 mm,5 μm),柱溫為40 ℃,流動相為體積分?jǐn)?shù)75%乙腈溶液,流速為1 mL/min,采用配有蒸發(fā)光散射檢測器檢測。
有機(jī)酸含量測定:色譜柱為Atlantis T3柱(150 mm×4.6 mm,5 μm),柱溫為40 ℃,流動相為磷酸二氫鉀(20 mmol/L,pH 2.5),流速為0.6 mL/min。根據(jù)光電二極管陣列檢測器的掃描模式,在210 nm波長處對果實有機(jī)酸組分進(jìn)行檢測。
通過與相應(yīng)標(biāo)準(zhǔn)品的保留時間比較,對糖和有機(jī)酸進(jìn)行定性和定量,每種化合物含量的單位為mg/g。樣品測定設(shè)置3 個重復(fù),每個重復(fù)進(jìn)行3 次平行測定。
1.3.3 總酚和總黃酮含量測定
總酚含量測定采用福林-酚法,以沒食子酸為標(biāo)準(zhǔn)物質(zhì)繪制標(biāo)準(zhǔn)曲線。總黃酮含量采用NaNO-Al(NO)-NaOH比色法測定,以蘆丁為標(biāo)準(zhǔn)品繪制標(biāo)準(zhǔn)曲線。總酚含量和總黃酮含量單位為mg/g。樣品測定設(shè)置3 個重復(fù),每個重復(fù)設(shè)置3 次平行測定。
1.3.4 花色苷含量測定
桃果實總花色苷含量的采用pH值示差法進(jìn)行測定,花色苷含量單位為μg/g。樣品測定設(shè)置3 個重復(fù),每個重復(fù)設(shè)置3 次平行測定。
1.3.5 轉(zhuǎn)錄組測序檢測
1.3.5.1 總RNA的提取與cDNA建庫
采用植物總RNA提取試劑盒提取桃RNA,經(jīng)過凝膠電泳和Nanodrop超微量分光光度計測定吸光度以檢測RNA的完整性和濃度,檢測合格的RNA由華大基因通過BGISEQ-500平臺進(jìn)行測序,構(gòu)建cDNA文庫。每個取樣點樣品分別設(shè)置3 個重復(fù)。
1.3.5.2 測序數(shù)據(jù)過濾和比對
使用過濾軟件SOAPnuke進(jìn)行統(tǒng)計,過濾去除低質(zhì)量、接頭污染以及未知堿基N含量過高的reads。得到clean reads后將其比對到參考基因組序列(NCBI_Prunus_persica_NCBIv2),之后再使用FPKM計算基因和轉(zhuǎn)錄本的表達(dá)水平。
1.3.5.3 差異表達(dá)基因的鑒定
基因表達(dá)量采用FPKM值表示,顯著差異表達(dá)基因的篩選條件為差異倍數(shù)兩倍以上(即|logFC|>1)并且≤0.001。
1.3.5.4 差異表達(dá)基因的GO分析和京都基因與基因組百科全書分析
使用R軟件中的phyper函數(shù)進(jìn)行富集分析,計算值,然后進(jìn)行錯誤發(fā)現(xiàn)率(false discovery rate,F(xiàn)DR)校正,通常≤0.05的功能視為顯著富集。根據(jù)基因本體(gene ontology,GO)注釋結(jié)果及官方分類,將差異基因進(jìn)行功能分類。根據(jù)京都基因與基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)注釋結(jié)果以及官方分類,將差異基因進(jìn)行生物通路分類。
1.3.5.5 差異表達(dá)基因?qū)崟r熒光定量聚合酶鏈?zhǔn)椒磻?yīng)分析
隨機(jī)選取9 個差異表達(dá)的基因進(jìn)行實時熒光定量聚合酶鏈?zhǔn)椒磻?yīng)(real time quantitative polymerase chain reaction,qPCR)分析,利用NCBI數(shù)據(jù)庫查找桃果實相關(guān)基因的CDS序列,利用Primer 5.0軟件設(shè)計引物(表1),qPCR采用AceQqPCR SYBRGreen Master Mix試劑盒,使用ABI 7500 PCR系統(tǒng),采用兩步法反應(yīng)程序:95 ℃預(yù)變性5 min;95 ℃變性10 s,60 ℃退火/延伸34 s,共40 個循環(huán)。數(shù)據(jù)分析以作為內(nèi)參基因,采用2法進(jìn)行基因相對定量計算。每組處理重復(fù)3 次。

表1 qPCR引物設(shè)計列表Table 1 Primers used for real time quantitative polymerase chain reaction (qPCR) analysis
1.3.6 蛋白質(zhì)組學(xué)分析
1.3.6.1 蛋白質(zhì)的提取與酶解分離
桃果肉加入2 mL Lysis Buffer 3(含1 mmol/L的苯甲磺酰氟和2 mmol/L的乙二胺四乙酸),渦旋振蕩后靜置5 min,添加0.5 mL 10 mmol/L的二硫蘇糖醇后振蕩2 min。樣品25 000×離心20 min,取上清液加入0.5 mL 10 mmol/L二硫蘇糖醇,56 ℃水浴1 h后加入0.2 mL 55 mmol/L碘乙酰胺暗室靜置45 min。加入4 倍體積冷丙酮,-20 ℃靜置2 h,樣品25 000×離心20 min,向沉淀中加入適量的Lysis Buffer 3,然后超聲處理使沉淀溶解后25 000×離心20 min,取上清液,進(jìn)行蛋白濃度定量。利用Bradford法和聚丙烯酰胺凝膠電泳法對提取的蛋白質(zhì)進(jìn)行定量。將符合質(zhì)量要求的蛋白質(zhì)采用胰蛋白酶酶解,將酶解后的肽段利用Strata X柱進(jìn)行除鹽后取樣品進(jìn)行分離,采用LC-20AB液相色譜系統(tǒng),分離柱為Gemini C柱(4.6 mm×250 mm,5 μm)對樣品進(jìn)行分離,于214 nm波長處監(jiān)測洗脫峰并分別收集組分,然后凍干。每個取樣點樣品分別設(shè)置3 個重復(fù)。
1.3.6.2 數(shù)據(jù)依賴采集模式建庫和數(shù)據(jù)非依賴采集定量檢測
將肽段樣品用流動相A(2%乙腈、0.1%甲酸)復(fù)溶,20 000×離心10 min后,取上清液通過UltiMate 3000超高效液相色譜儀進(jìn)行分離。樣品進(jìn)入trap柱富集并除鹽,隨后與自裝C柱串聯(lián),以300 nL/min流速通過如下條件進(jìn)行分離:0~5 min,5%流動相B(98%乙腈、0.1%甲酸);5~120 min,5%~25%流動相B;120~160 min,25%~35%流動相B;160~170 min,35%~80%流動相B;170~175 min,80%流動相B;175~10 min,5%流動相B。
數(shù)據(jù)依賴采集模式(data independent acquisition,DDA)檢測:經(jīng)過液相分離的肽段離子化后進(jìn)入到串聯(lián)質(zhì)譜儀進(jìn)行檢測。參數(shù)設(shè)置:離子源電壓1.9 kV;一級質(zhì)譜掃描范圍350~1 500/;分辨率為120 000;二級質(zhì)譜起始/固定為100;分辨率30 000。二級碎裂的母離子:電荷2到6。離子碎裂模式為HCD,碎片離子在Orbitrap質(zhì)譜儀中進(jìn)行檢測。
數(shù)據(jù)非依賴采集(data independent acquisition,DIA)檢測:離子源電壓設(shè)置為1.9 kV;一級質(zhì)譜掃描范圍/400~1 250;分辨率設(shè)置為120 000;最大離子注入時間50 ms;將/400~1 250均分為50 個窗口進(jìn)行連續(xù)窗口碎裂及信號采集。離子碎裂模式為HCD,碎片離子在Orbitrap質(zhì)譜儀中進(jìn)行檢測。
1.3.6.3 質(zhì)譜數(shù)據(jù)鑒定與分析
將滿足FDR≤1%的信息用于建立最終的譜圖庫,以差異倍數(shù)≥1和<0.01作為顯著性差異的標(biāo)準(zhǔn)進(jìn)行差異表達(dá)蛋白篩選,同時對差異表達(dá)蛋白進(jìn)行GO富集分析(http://www.geneontology.org)和KEGG通路(http://www.genome.jp/)功能注釋分析。基于定量結(jié)果,完成不同比較組差異表達(dá)蛋白的查找,最后進(jìn)行相應(yīng)差異富集蛋白的功能分析。
1.4 數(shù)據(jù)處理與分析
利用Excel 2013軟件對實驗數(shù)據(jù)進(jìn)行統(tǒng)計分析,采用SAS 9.2軟件Duncan多重比較法進(jìn)行差異顯著性分析。
2 結(jié)果與分析
2.1 HA處理對桃果實糖酸、總酚、總黃酮含量和花色苷含量的影響
如表2所示,共檢測到3 種可溶性糖,分別為蔗糖、葡萄糖和果糖,其中蔗糖的含量最高。不同處理組隨著貯藏時間的延長,蔗糖含量呈現(xiàn)明顯下降的趨勢,而葡萄糖和果糖含量呈現(xiàn)明顯上升的趨勢。與CK組相比,HA處理顯著抑制了桃蔗糖含量的下降(<0.05),并抑制了果糖和葡萄糖含量的上升,這與Yu Lina等的研究結(jié)果是一致的。檸檬酸和蘋果酸是桃果實中的主要有機(jī)酸,不同處理組2 種有機(jī)酸隨著貯藏時間的延長整體呈現(xiàn)下降的趨勢,其中CK組檸檬酸含量下降了0.17 mg/g,蘋果酸含量下降了0.41 mg/g。與CK組相比,HA處理可在第7、14、28、35天顯著抑制檸檬酸含量的下降(<0.05)。經(jīng)過HA處理14~35 d后桃果實蘋果酸的含量顯著高于CK組(<0.05)。Chen Ming等研究表明HA處理可以顯著抑制椪柑果實檸檬酸和蘋果酸含量的下降。總酚含量和總黃酮含量整體呈現(xiàn)先上升后下降的趨勢,CK組和處理組桃果實總酚含量于貯藏第21天達(dá)到最大值,分別為0.80 mg/g和1.07 mg/g,CK組總黃酮含量于貯藏第14天達(dá)到最大值(1.43 mg/g),而處理組總黃酮含量于第21天達(dá)到最大值,為1.93 mg/g。與對照組相比,HA處理顯著提高桃果實總酚含量和總黃酮含量,這與Wei Yingying等的研究結(jié)果一致。對照組桃果實花色苷含量變化比較穩(wěn)定,而HA處理組花色苷含量呈現(xiàn)先上升后下降的趨勢,HA處理顯著提高了桃果實花色苷含量。Zhou Dandan等研究結(jié)果表明,HA處理可顯著提高桃果肉花色苷含量不僅與苯丙烷代謝途徑關(guān)鍵酶活力有關(guān),同時與果實中可溶性糖和有機(jī)酸含量密切相關(guān)。研究表明,蔗糖、葡萄糖和果糖與果實花色苷的合成呈現(xiàn)正相關(guān)性,糖不僅是合成花色苷重要的前體物質(zhì),也是調(diào)節(jié)花色苷合成的重要信號物質(zhì)。Liu Xiaojuan等研究表明,蔗糖可以通過調(diào)控和轉(zhuǎn)錄因子,從而促進(jìn)蘋果花色苷的積累和果實色澤形成。有機(jī)酸含量決定了果實液泡內(nèi)pH值的變化,花色苷以陽離子的形式存在于果實液泡內(nèi),顏色隨液泡中的pH值改變而變化。Noro等研究發(fā)現(xiàn)檸檬酸和蘋果酸是蘋果花色苷合成的潛在刺激物。本研究表明,HA處理顯著提高桃果肉花色苷的含量與蔗糖、檸檬酸含量和蘋果酸含量密切相關(guān),HA處理可以通過抑制桃果實蔗糖、檸檬酸和蘋果酸的降解從而提高花色苷的含量。
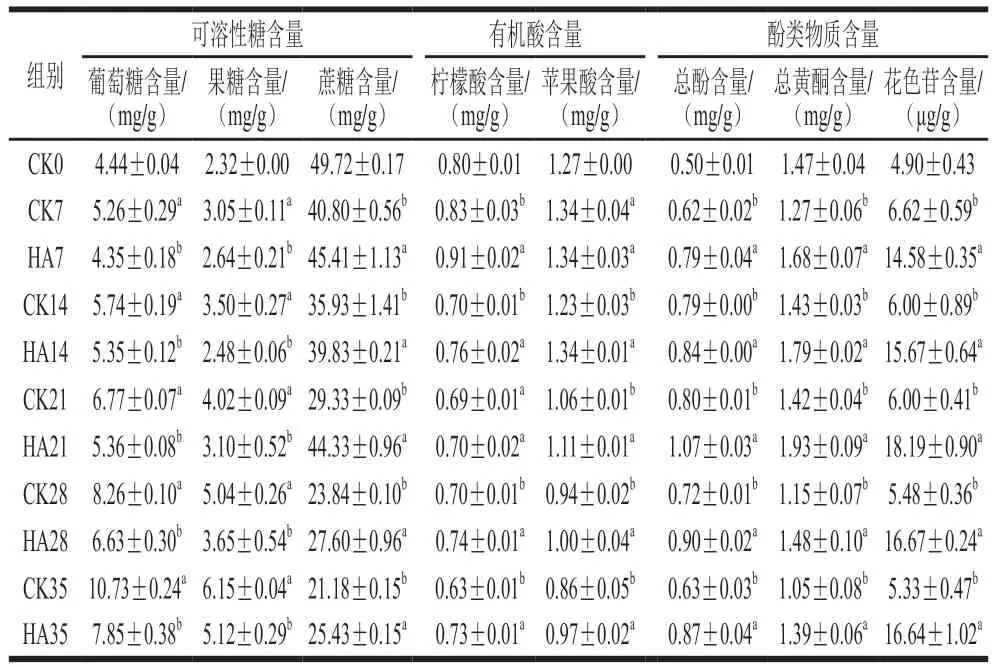
表2 HA處理對桃果實可溶性糖、有機(jī)酸和酚類物質(zhì)含量的影響Table 2 Effect of HA treatment on the contents of soluble sugars,organic acids and phenolic compounds in peach fruit
2.2 轉(zhuǎn)錄組分析結(jié)果
2.2.1 轉(zhuǎn)錄組測序數(shù)據(jù)質(zhì)量
對桃果實測序后進(jìn)行統(tǒng)計,總共獲得了518.05 Mb 個原始的reads片段,過濾后的clean reads片段為478.02 Mb 個,包含了47.81 Gb 個堿基數(shù)。其中過濾后質(zhì)量不低于20的reads比例大于97%,不低于30的reads比例約為90%。由此可以看出,測序質(zhì)量較好,可以滿足后續(xù)數(shù)據(jù)組裝及處理的要求。同時,利用qPCR驗證了轉(zhuǎn)錄組數(shù)據(jù)的準(zhǔn)確性,由圖1可知,qPCR檢測的9 個基因的相對表達(dá)量與轉(zhuǎn)錄組檢測的FPKM值具有較高的相關(guān)性,的最低值為0.795 1,最高值0.975 9,說明轉(zhuǎn)錄組測序數(shù)據(jù)可靠性較高。
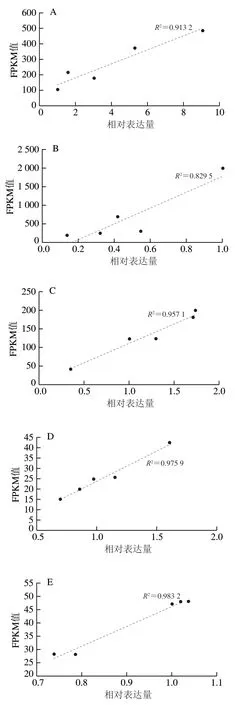
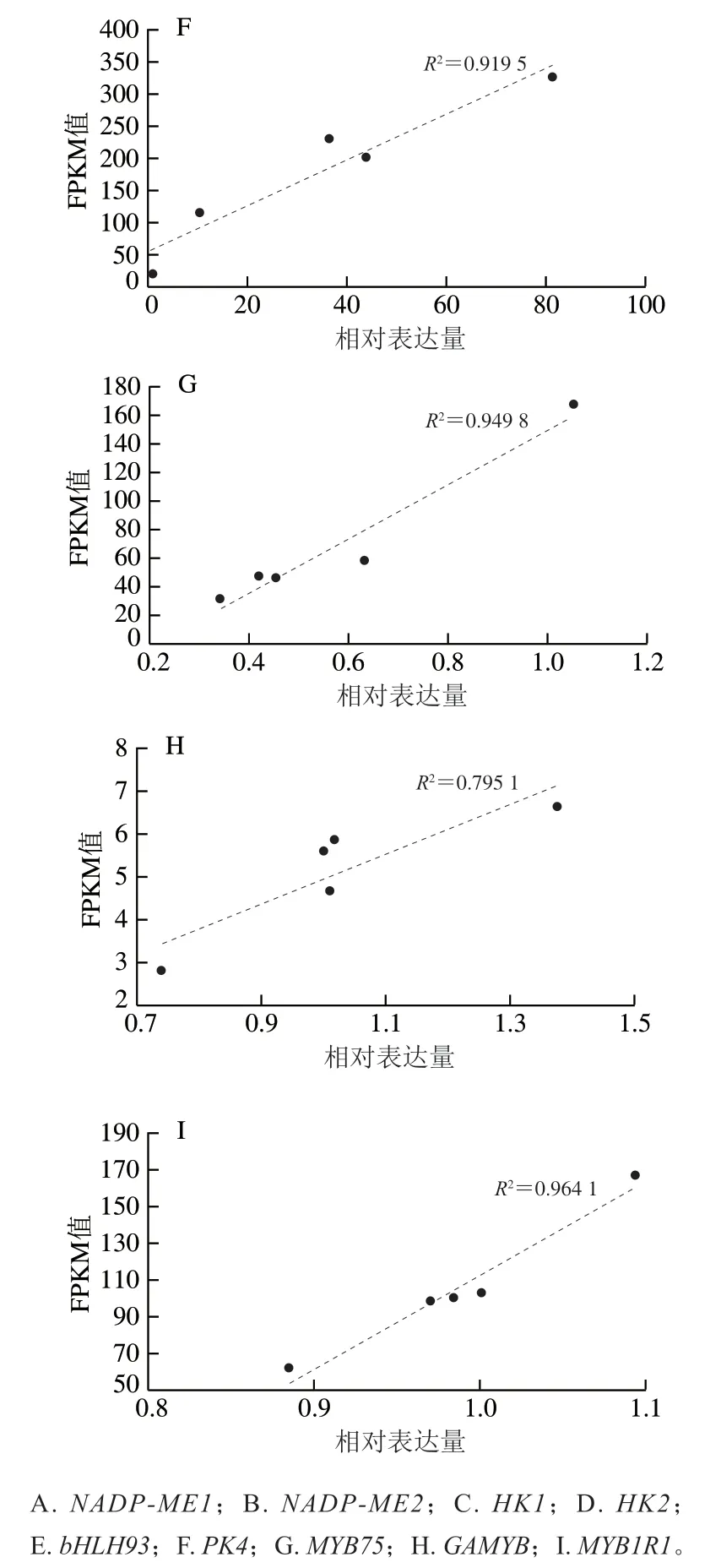
圖1 基因表達(dá)量的qPCR驗證分析Fig. 1 qPCR validation analysis of gene expression
2.2.2 差異表達(dá)基因的篩選
桃果實采后貯藏期間差異表達(dá)基因數(shù)量如圖2所示。以采收當(dāng)天的桃果實(CK0)為對照,分析不同貯藏時間下的差異表達(dá)基因。由圖2A可知,隨著貯藏時間的延長,差異表達(dá)基因的數(shù)量不斷上升,CK0 vs CK7、CK0 vs CK21、CK0 vs CK35 3 組差異基因總數(shù)分別為8 182、11 345、11 884 個。且隨著貯藏時間的延長,下調(diào)差異基因總數(shù)始終高于上調(diào)差異基因總數(shù),其中CK0 vs CK7、CK0 vs CK21和CK0 vs CK35分別有3 059、3 257 個和3 721 個基因上調(diào),有5 123、8 088 個和8 163 個基因下調(diào)。圖2B為同一貯藏時間下CK組與HA處理組差異表達(dá)基因的數(shù)量,隨著貯藏時間的延長,CK組與HA處理組差異基因表達(dá)總數(shù)逐漸減少,CK7 vs HA7、CK21 vs HA21和CK35 vs HA35分別為2 424、2 287 個和746 個。貯藏前期(7 d),HA處理下調(diào)表達(dá)的差異基因數(shù)量高于上調(diào)的差異基因數(shù)量,但是在貯藏中期(21 d)和貯藏后期(35 d),HA處理上調(diào)的差異基因數(shù)量高于下調(diào)的差異基因數(shù)量。
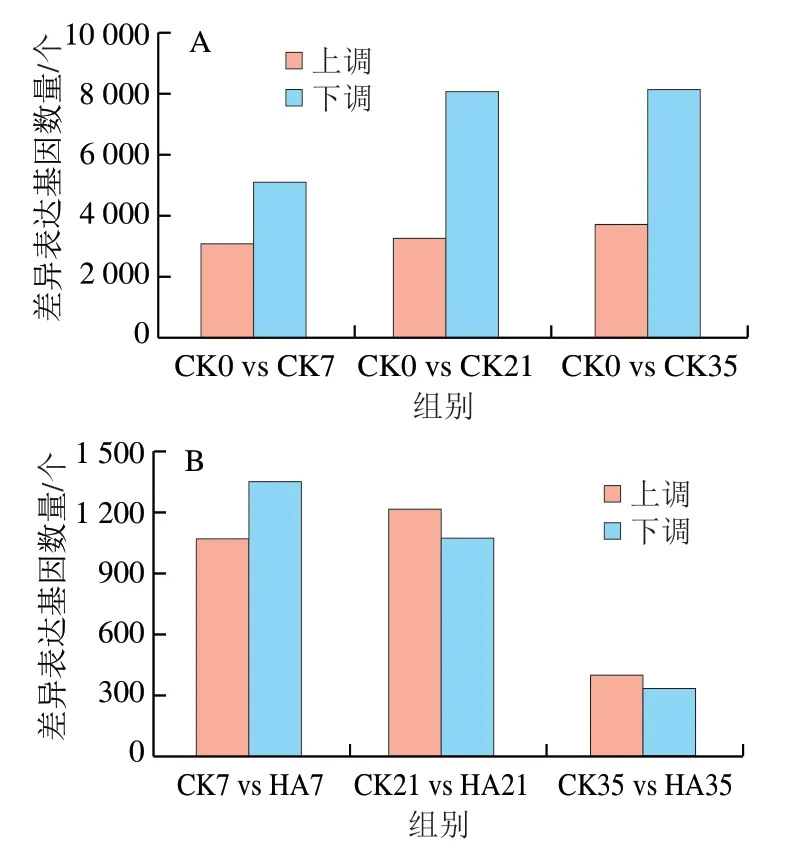
圖2 桃果實貯藏過程中差異表達(dá)基因數(shù)量(A)和HA處理與對照組差異表達(dá)基因數(shù)量(B)Fig. 2 Number of DEGs in control group among storage times (A) and number of DEGs between HA treated and control groups (B)
2.2.3 差異表達(dá)基因GO功能分析結(jié)果
將上述差異基因進(jìn)一步進(jìn)行GO功能分析,主要分為貯藏期間差異基因GO分析以及CK組和HA處理組差異基因GO分析。這些GO信息被進(jìn)一步被歸納為基因的分子功能、細(xì)胞組分、生物學(xué)過程3大類。圖3為對照組與HA組差異基因的GO分析結(jié)果,主要對比了CK7 vs HA7、CK21 vs HA21和CK35 vs HA35。由圖3可知,對于生物進(jìn)程中,差異基因主要聚集于細(xì)胞代謝過程、生物調(diào)控、刺激響應(yīng)和代謝過程這4 個亞類中。對于細(xì)胞組分歸類中,差異基因主要聚集于細(xì)胞、細(xì)胞膜、細(xì)胞膜組分和細(xì)胞器這4 個亞類中。對于分子功能,差異基因主要聚集于結(jié)合功能和催化活性這2 個亞類中。
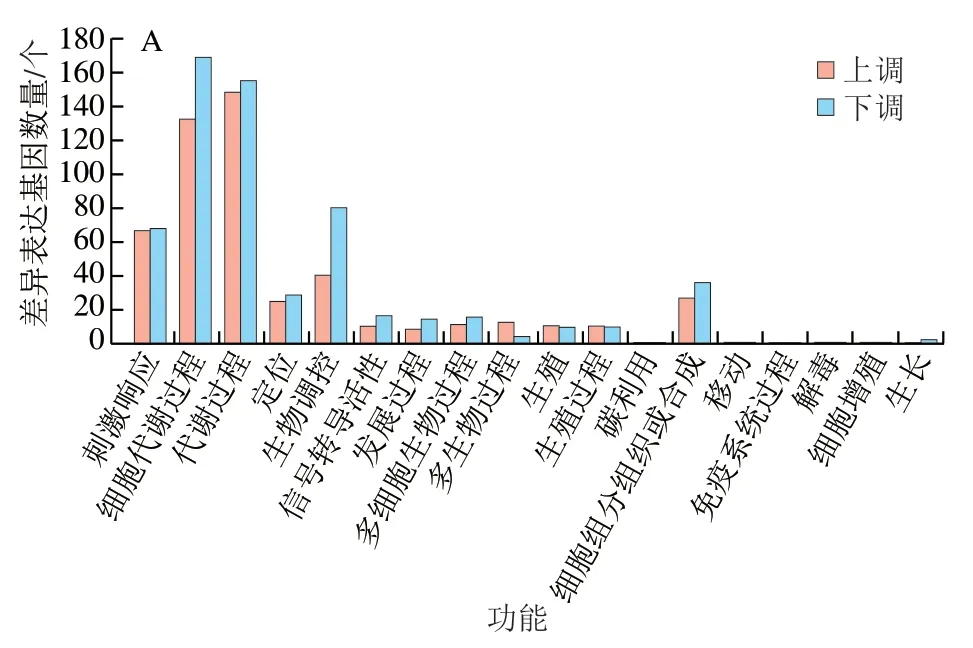
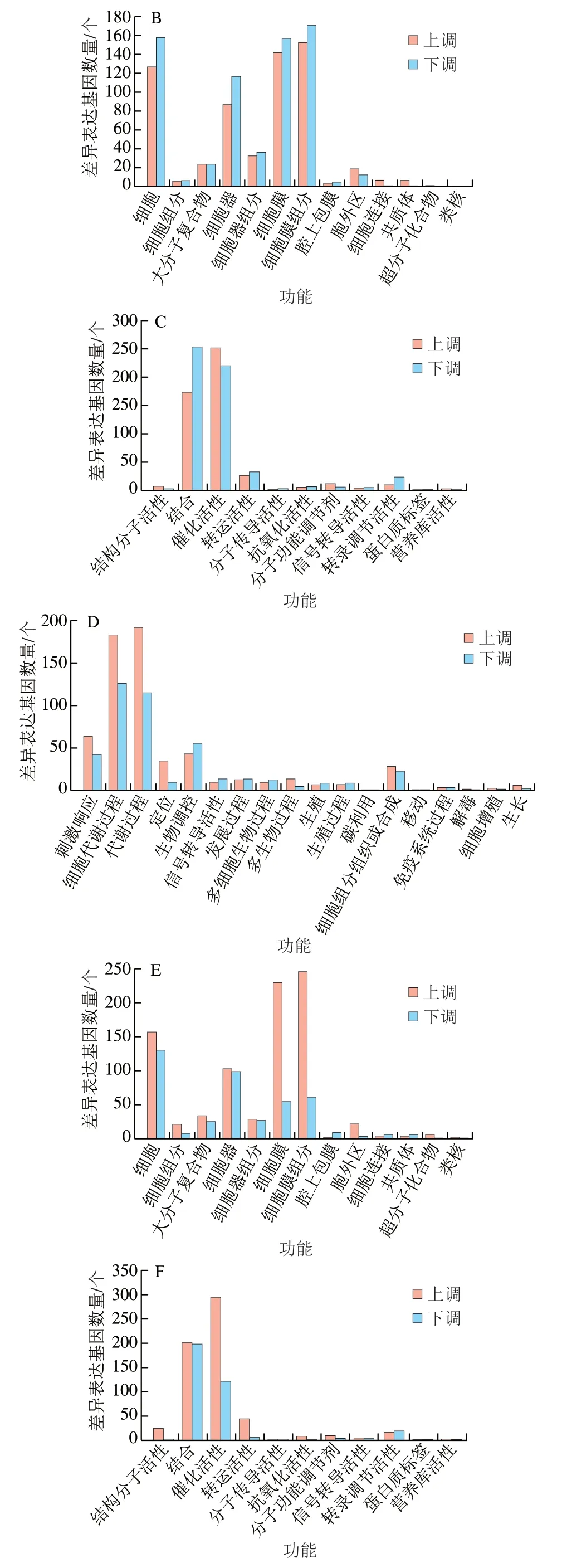
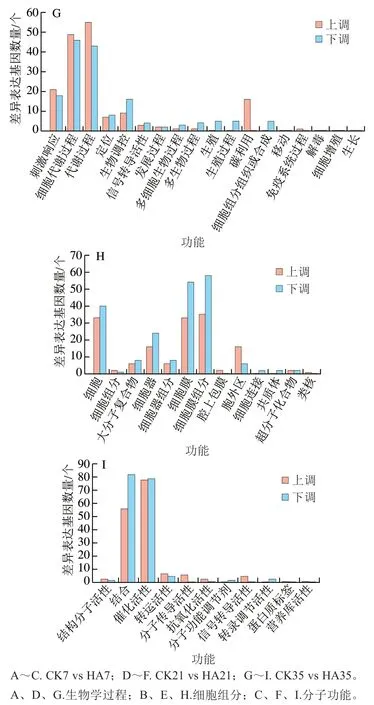
圖3 桃果實HA組和對照組差異表達(dá)基因GO功能分類Fig. 3 Gene ontology (GO) term assignment of DEGs between control and HA-treated groups
2.2.4 差異表達(dá)基因代謝通路富集
通過KEGG通路分析可以進(jìn)一步了解相關(guān)基因的生物功能和相互間的作用。KEGG分類主要包括6大類,分別為細(xì)胞過程、環(huán)境信息處理、遺傳信息處理、人類疾病、代謝和有機(jī)體系統(tǒng)。圖4為CK組和HA處理組差異基因的KEGG富集分析。CK組和HA處理組的差異基因在KEGG數(shù)據(jù)庫中共映射到20 個不同的代謝通路。在6 個分類中,CK組和HA處理組差異基因在代謝中占比最多,其次為遺傳信息處理。在代謝這一分類中,差異基因主要集中在總概,其次為碳水化合物代謝、次級產(chǎn)物代謝、氨基酸代謝和脂質(zhì)代謝。在遺傳信息處理分類中,差異基因主要聚集在翻譯、折疊、分類和降解。此外HA處理組和CK組差異基因在信號轉(zhuǎn)導(dǎo)途徑中占比也較多。
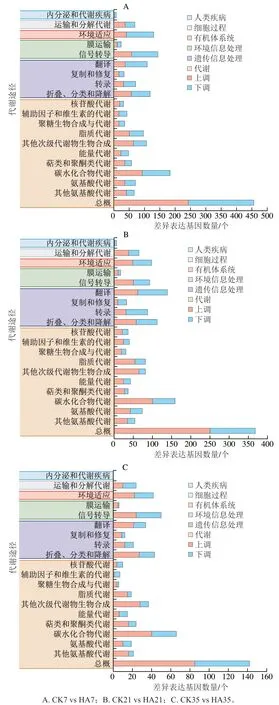
圖4 桃果實HA組和CK組差異表達(dá)基因KEGG代謝途徑分類分析Fig. 4 KEGG classification of DEGs between control and HA-treated groups
2.2.5 參與調(diào)控糖酸和酚類物質(zhì)代謝的差異基因
根據(jù)轉(zhuǎn)錄組測序結(jié)果,對集中于糖酸代謝和酚類物質(zhì)代謝的差異基因的表達(dá)量進(jìn)行了進(jìn)一步的分析。圖5為參與調(diào)控果實可溶性糖、有機(jī)酸和酚類物質(zhì)代謝的差異表達(dá)基因。
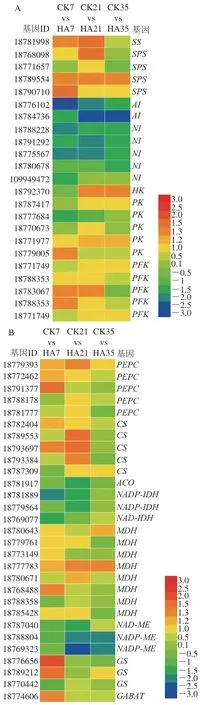
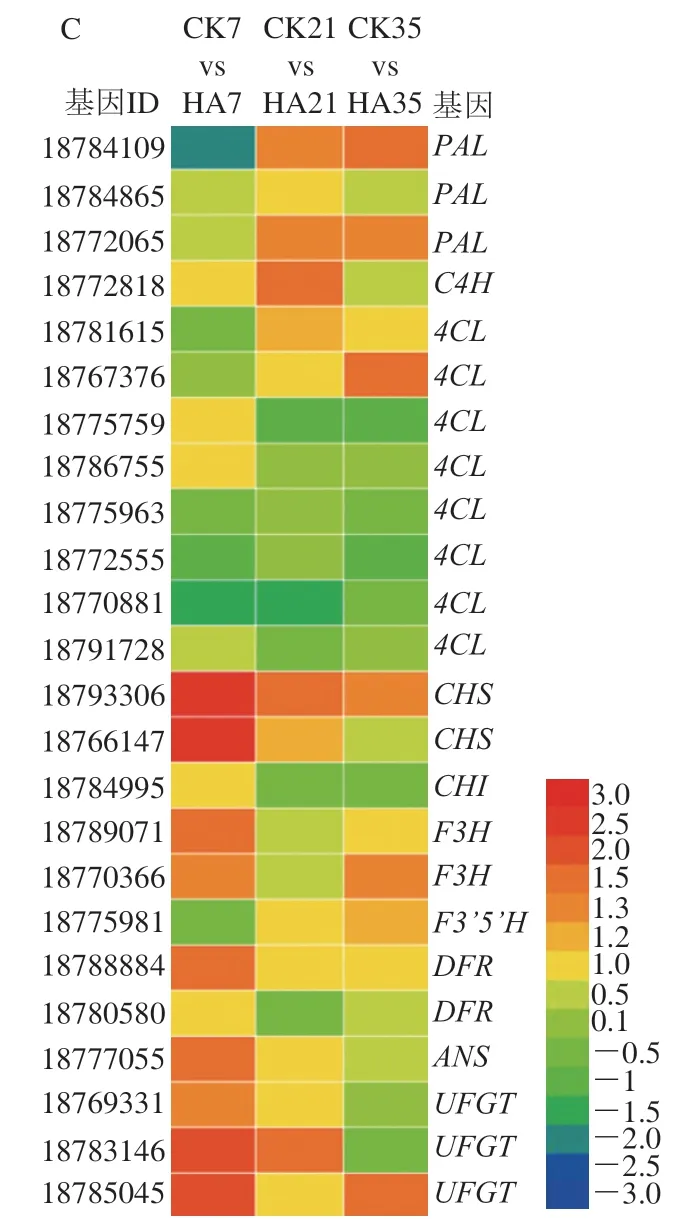
圖5 參與桃果實糖代謝(A)、有機(jī)酸代謝(B)和酚類物質(zhì)代謝(C)的差異表達(dá)基因Fig. 5 DEGs involved in the metabolisms of soluble sugars (A), organic acids (B) and phenols (C) in peach fruit
如圖5A所示,共檢測到22 個參與調(diào)控桃果實糖代謝的差異表達(dá)基因,差異基因主要為、、、I、、和。蔗糖合酶(sucrose synthase,SS)和蔗糖磷酸合酶(sucrose phosphate synthase,SPS)可以促進(jìn)葡萄糖和果糖轉(zhuǎn)化為蔗糖,而蔗糖可在轉(zhuǎn)化酶的催化下降解生成葡萄糖和果糖;己糖激酶(hexokinase,HK)、丙酮酸激酶(pyruvate kinase,PK)和磷酸果糖激酶(phosphofructokinase,PFK)參與果實糖酵解途徑,與果糖和葡萄糖的磷酸化反應(yīng)密切相關(guān)。貯藏前期,HA處理上調(diào)了、、、基因的表達(dá)量,其logFC均大于1;貯藏中后期,HA處理上調(diào)了基因的表達(dá)量。同時,HA處理抑制了桃果實和基因的表達(dá)量,其logFC均小于1。Yu Lina等研究表明,HA處理可以抑制桃蔗糖含量的降解主要與低表達(dá)量的和基因密切相關(guān),同時HA處理抑制了葡萄糖和果糖含量的上升與高表達(dá)量的和密切相關(guān)。與上述結(jié)果一致,本研究發(fā)現(xiàn)HA處理可以通過抑制和基因的表達(dá),提高、和基因的表達(dá),從而抑制了蔗糖的降解并抑制了葡萄糖和果糖的合成。
如圖5B所示,共檢測到29 個參與桃有機(jī)酸代謝的差異基因,主要參與蘋果酸和檸檬酸的代謝,差異基因主要為、、、、、和。可以催化檸檬酸的合成,而和促進(jìn)檸檬酸的降解,和參與檸檬酸的轉(zhuǎn)運。和參與果實蘋果酸的合成,而促進(jìn)了蘋果酸的降解。貯藏前期,HA處理提高了桃果實、、、和基因的表達(dá)量,同時HA處理顯著抑制了、和基因的表達(dá)量。以上結(jié)果表明,HA處理通過提高桃果實、和基因的表達(dá)量,并抑制基因的表達(dá)量從而抑制桃果實檸檬酸含量的下降。對于蘋果酸代謝的影響,HA處理通過上調(diào)和的表達(dá)量,并抑制基因的表達(dá),從而抑制桃蘋果酸含量的下降。
參與調(diào)控酚類物質(zhì)代謝的差異基因共檢測到24 個,主要集中于苯丙烷代謝途徑中,差異基因主要為、、、、、、、、和。、、可以催化果實苯丙氨酸轉(zhuǎn)化為酚酸類物質(zhì),后經(jīng)過、和進(jìn)一步催化生成黃酮類和黃烷醇類物質(zhì),、和參與果實花色苷的合成,促進(jìn)果實顏色的積累。本研究表明HA處理上調(diào)酚類代謝相關(guān)基因的表達(dá)量,尤其是在貯藏的前期。對、、和基因表達(dá)量影響較為顯著,logFC均大于2。以上結(jié)果表明,HA處理可以通過調(diào)控基因的表達(dá)量從而促進(jìn)桃果實苯丙氨酸向酚類物質(zhì)轉(zhuǎn)化,同時通過上調(diào)、、和基因的表達(dá)量從而提高果實黃酮類物質(zhì)的含量,最后通過提高、和基因的表達(dá)量,從而促進(jìn)桃果實花色苷的合成。
2.3 蛋白質(zhì)組學(xué)分析結(jié)果
2.3.1 差異表達(dá)蛋白的篩選
桃果實采后貯藏期間差異表達(dá)蛋白數(shù)量如圖6所示。以采收當(dāng)天的桃果實為對照,分析了不同貯藏時間下的差異表達(dá)蛋白。由圖6A可知,隨著貯藏時間的延長,差異表達(dá)蛋白的數(shù)量不斷上升,CK0 vs CK7組和CK0 vs CK35組的差異表達(dá)蛋白總數(shù)分別為160 個和951 個。在貯藏前期,上調(diào)蛋白數(shù)量和下調(diào)蛋白數(shù)量基本相等,貯藏后期,下調(diào)蛋白數(shù)量明顯高于上調(diào)蛋白的數(shù)量。圖6B為同一貯藏時間下CK組與HA處理組差異蛋白的數(shù)量,隨著貯藏時間的延長,CK組與HA處理組差異表達(dá)蛋白總數(shù)逐漸減少,CK0 vs HA7組和CK0 vs HA35組分別為401 個和339 個。貯藏前期和貯藏后期,HA處理下調(diào)表達(dá)的差異表達(dá)蛋白數(shù)量高于上調(diào)的差異表達(dá)蛋白的數(shù)量。
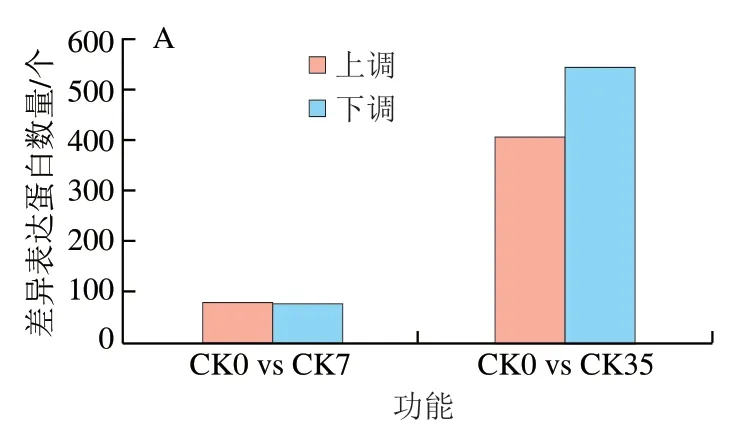

圖6 桃果實貯藏過程中差異表達(dá)蛋白數(shù)量(A)和HA處理與CK組差異表達(dá)蛋白數(shù)量(B)Fig. 6 Number of DEPs in control group among storage times (A) and number of DEGs between HA treated and control groups (B)
2.3.2 差異表達(dá)蛋白GO功能分析結(jié)果
將CK組與HA處理組差異基因進(jìn)行GO功能分析,這些GO信息被進(jìn)一步歸納為基因的分子功能、細(xì)胞組分、生物學(xué)過程3大類。圖7為CK組與HA處理組差異表達(dá)蛋白的GO功能分析結(jié)果,主要對比了CK7 vs HA7和CK35 vs HA35。在3大類中,CK組和HA處理組差異表達(dá)蛋白數(shù)量在生物學(xué)過程中最多,其次為細(xì)胞組分,分子功能中差異表達(dá)蛋白數(shù)量最少。在43 個亞類中,細(xì)胞代謝過程、代謝過程、細(xì)胞、細(xì)胞組分、結(jié)合和催化活性中差異表達(dá)蛋白數(shù)量較多。
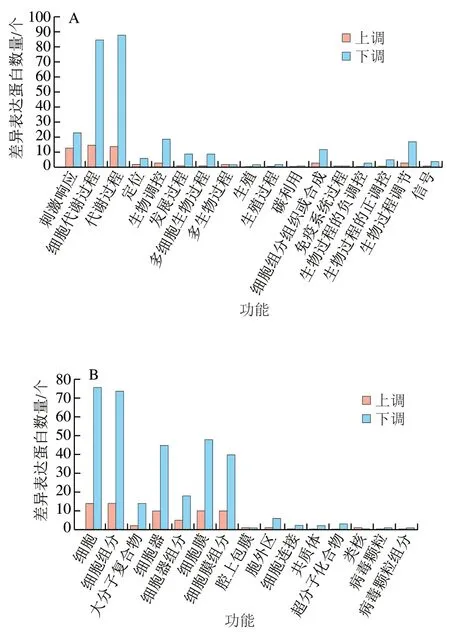
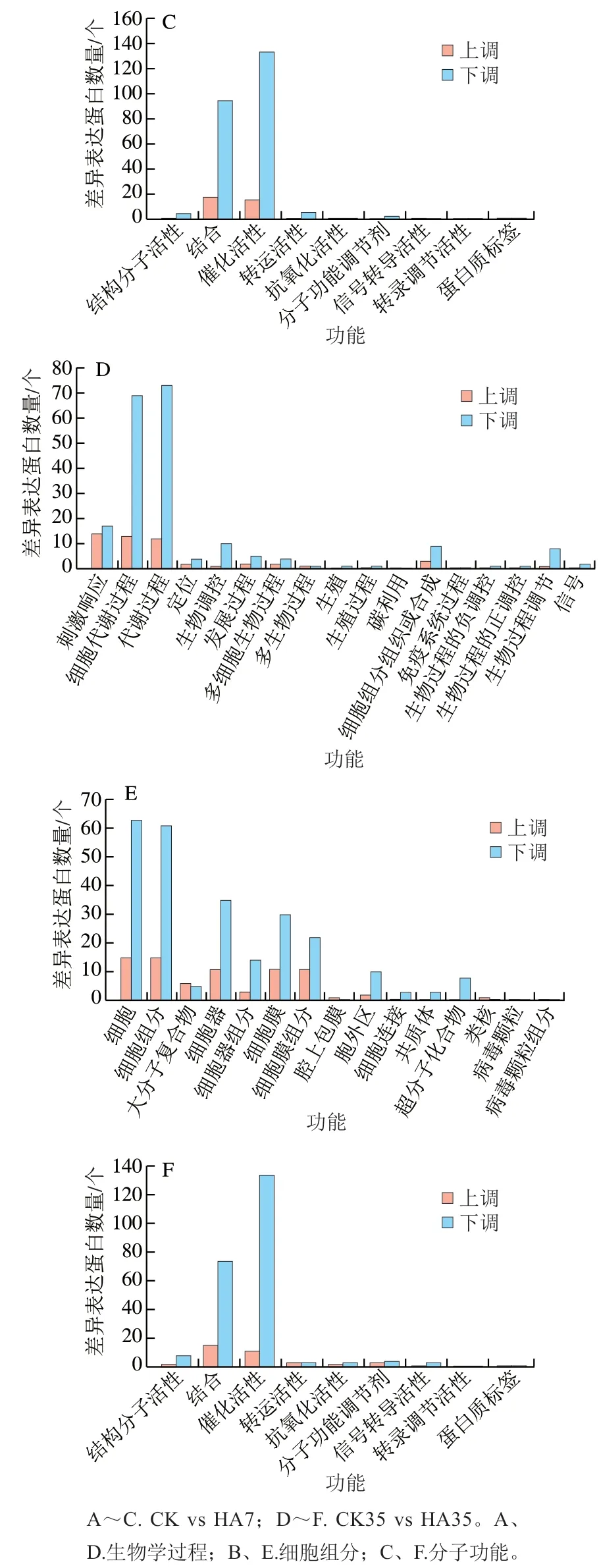
圖7 桃果實HA組和對照組差異表達(dá)蛋白GO功能分類分析Fig. 7 Gene ontology (GO) term assignment of DEPs between control and HA-treated groups
2.3.3 差異表達(dá)蛋白代謝通路富集
KEGG分類主要包括細(xì)胞過程、環(huán)境信息處理、遺傳信息處理、人類疾病、代謝和有機(jī)體系統(tǒng)6大類。CK組和HA處理組差異表達(dá)蛋白的KEGG富集分析如圖8所示。CK組和HA處理組的差異表達(dá)蛋白共映射到20 個不同的代謝通路。在6 個分類中,代謝中差異基因的占比最多,差異表達(dá)蛋白主要參與了碳水化合物代謝、其他次級產(chǎn)物代謝、氨基酸代謝和脂質(zhì)代謝等代謝途徑。差異表達(dá)蛋白在遺傳信息處理分類中占比也較多,主要集中在翻譯、折疊、分類和降解。
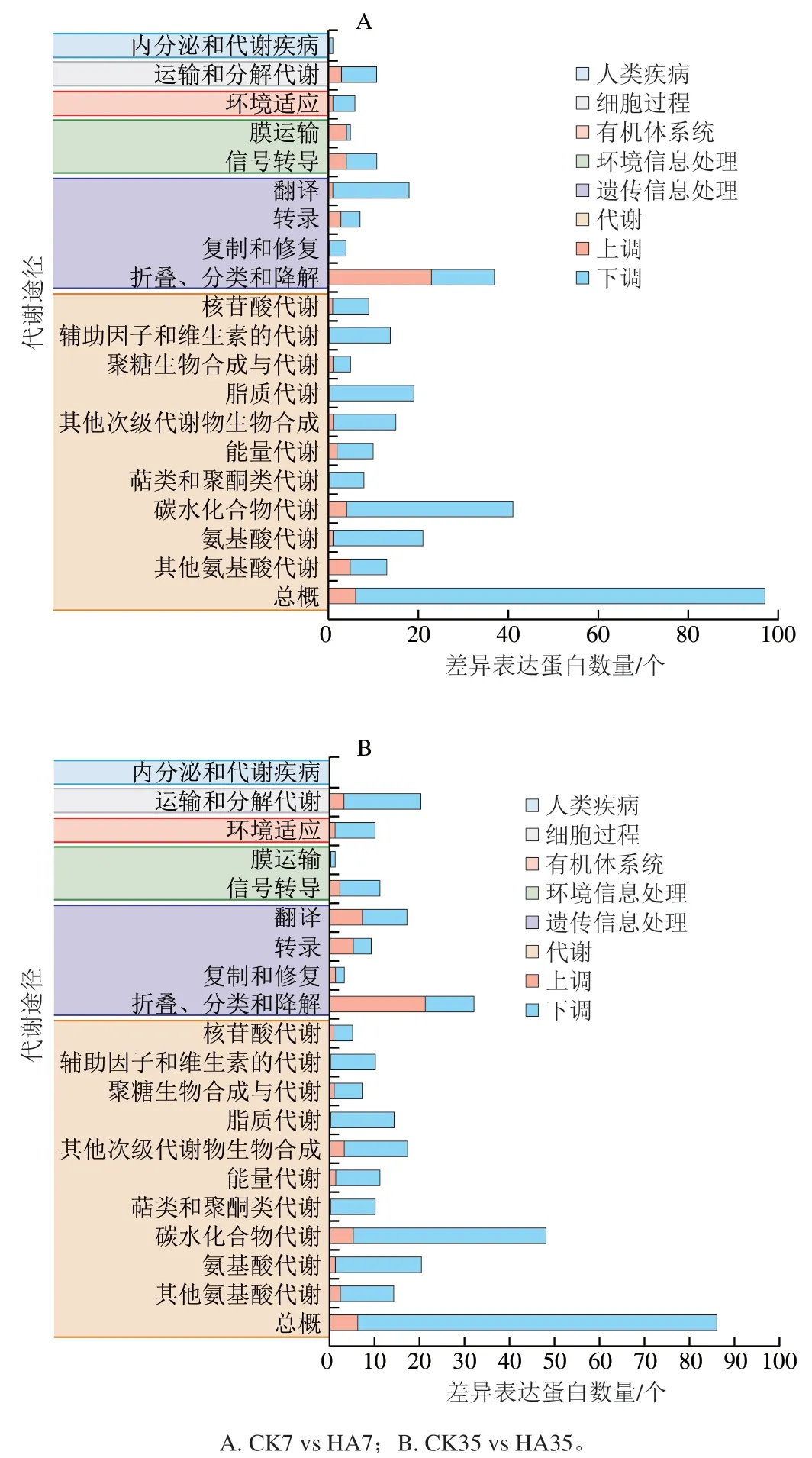
圖8 桃果實HA組和CK組差異表達(dá)蛋白KEGG代謝途徑分類Fig. 8 KEGG classification of DEPs between control and HA-treated groups
2.3.4 參與調(diào)控碳水化合物和次級代謝物代謝的差異表達(dá)蛋白
圖9為參與桃果實碳水化合物代謝和次級代謝物代謝的差異表達(dá)蛋白,共鑒定出44 個具有差異表達(dá)的蛋白,其中碳水化合物代謝差異表達(dá)蛋白有28 個,次級代謝物代謝差異表達(dá)蛋白有16 個。
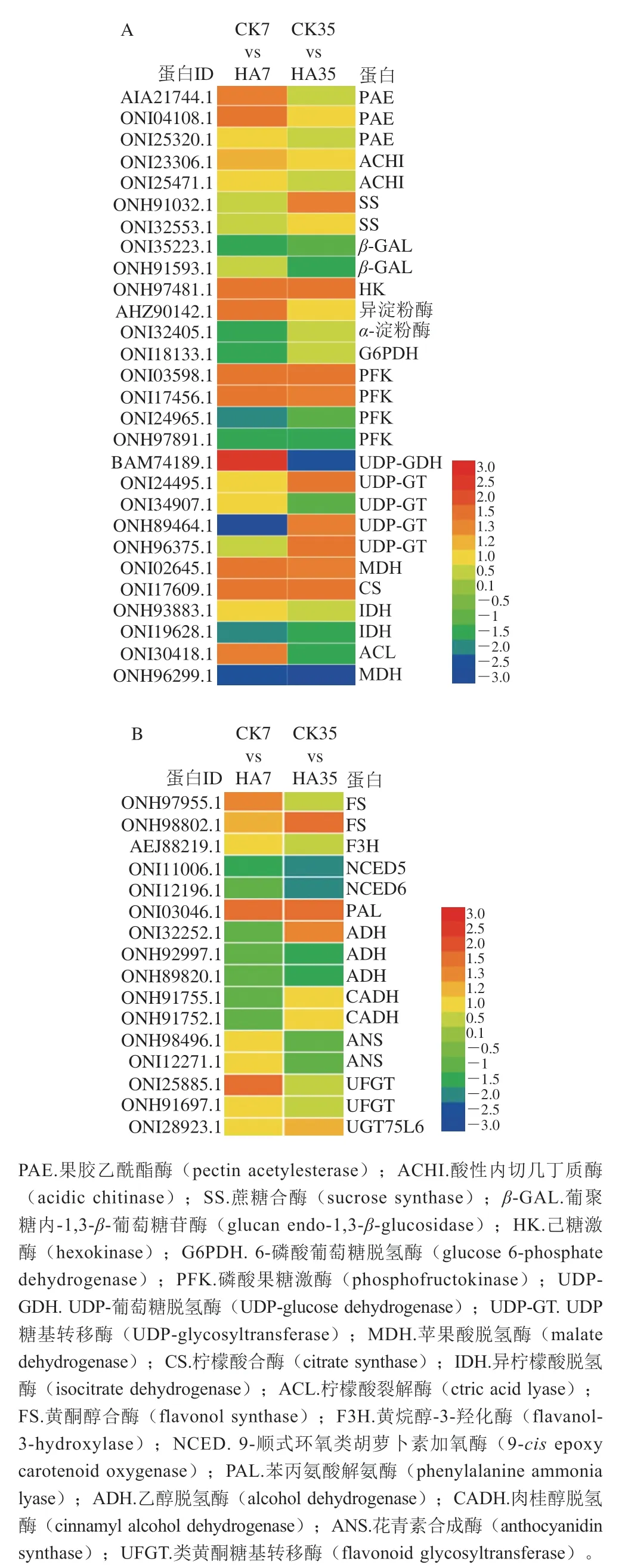
圖9 參與桃果實碳水化合物(A)和次級代謝物(B)代謝的差異表達(dá)蛋白Fig. 9 DEPs involved in the metabolisms of carbohydrates (A) and secondary metabolites (B) in peach fruit
碳水化合物代謝中,差異表達(dá)蛋白主要集中在糖代謝、有機(jī)酸代謝及果實抗病防御系統(tǒng)酶。在果實抗病防御系統(tǒng)中,果膠乙酰酯酶(pectin acetylesterase,PAE),酸性內(nèi)切幾丁質(zhì)酶(acidic chitinase,ACHI)和葡聚糖內(nèi)-1,3--葡萄糖苷酶(glucan endo-1,3-glucosidase,-GAL)主要參與了植物抗病脅迫進(jìn)程,經(jīng)過HA處理后的桃果實CHI和-GAL的表達(dá)量高于CK組,說明HA處理可以誘導(dǎo)果實的抗病性。在糖代謝過程中,鑒定到的差異表達(dá)蛋白主要包括SS、淀粉酶、HK、PFK、6-磷酸葡萄糖脫氫酶(glucose 6-phosphate dehydrogenase,G6PDH)、UDP糖基轉(zhuǎn)移酶(UDP-glycosyltransferase,UDP-GT)和UDP-葡萄糖脫氫酶(UDP-glucose dehydrogenase,UDP-GDH)。與CK組相比,HA處理上調(diào)了SS、PFK、UDP-GT和UDP-GDH蛋白的表達(dá)量,說明HA處理可以抑制蔗糖含量的降解,并促進(jìn)果糖和葡萄糖的代謝。結(jié)合轉(zhuǎn)錄組學(xué)數(shù)據(jù)分析,共有3 個糖代謝差異表達(dá)蛋白與相應(yīng)的差異表達(dá)基因變化相同,分別為HK(18792370、ONI32405.1)、PFK(18771749、ONH97891.1)和PK(18777684、ONI06129.1)。在有機(jī)酸代謝過程中,差異表達(dá)蛋白主要參與檸檬酸和蘋果酸的代謝,鑒定的差異表達(dá)蛋白主要為蘋果酸脫氫酶(malate dehydrogenase,MDH)、檸檬酸合酶(citrate synthase,CS)、異檸檬酸脫氫酶(isocitrate dehydrogenase,IDH)、檸檬酸裂解酶(ctric acid lyase,ACL)和蘋果酸異丙酯脫氫酶(isopropyl malate dehydrogenase,IMDH)。HA處理上調(diào)了MDH和CS蛋白的表達(dá)量,并下調(diào)了IDH、ACL和IMDH蛋白的表達(dá)量。其中MDH、IDH和CS蛋白的表達(dá)量變化與轉(zhuǎn)錄組中CS(18782404)、NAD-IDH(18781889)和MDH(18773149)基因的表達(dá)量變化相同,HA均提高了MDH和CS的表達(dá),并抑制了IDH的表達(dá)。
圖9B為參與桃果實次級代謝物代謝的差異表達(dá)蛋白,共鑒定到16 個具有差異表達(dá)的蛋白,主要為苯丙烷代謝途徑關(guān)鍵蛋白和糖苷轉(zhuǎn)移蛋白,差異表達(dá)蛋白主要為黃酮醇合酶(flavonol synthase,F(xiàn)S)、黃烷醇-3-羥化酶(flavanol-3-hydroxylase,F(xiàn)3H)、9-順式環(huán)氧類胡蘿卜素加氧酶(9-epoxy carotenoid oxygenase,NCED)、苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)、乙醇脫氫酶(alcohol dehydrogenase,ADH)、肉桂醇脫氫酶(cinnamyl alcohol dehydrogenase,CADH)、花青素合成酶(anthocyanidin synthase,ANS)和類黃酮糖基轉(zhuǎn)移酶(flavonoid glycosyltransferase,UFGT)。與CK組相比,HA處理提高了FS、PAL、UFGT等蛋白的表達(dá)量,從而促進(jìn)了桃果實苯丙氨酸向花色苷類物質(zhì)的合成。其中,PAL蛋白(ONI03046.1)與基因(18772065)的表達(dá)量變化一致;UFGT蛋白(ONI25885.1)和基因(18785045)表達(dá)量的變化相同,說明HA處理均能顯著提高PAL和UFGT蛋白和基因的表達(dá)。同時,HA處理明顯下調(diào)了ADH、NCED的表達(dá)量,說明HA處理可以顯著抑制果實類胡蘿卜素等物質(zhì)的降解。
3 結(jié) 論
HA處理(40 ℃、4 h)對桃果實糖代謝、有機(jī)酸代謝和酚類物質(zhì)代謝影響較大。HA處理可以有效抑制蔗糖、檸檬酸和蘋果酸含量的下降,并抑制了葡萄糖和果糖含量的上升。同時,HA處理顯著提高了桃果實總酚、總黃酮和總花色苷的含量。轉(zhuǎn)錄組學(xué)和蛋白質(zhì)組學(xué)分析結(jié)果表明,大多數(shù)的差異表達(dá)基因和蛋白主要集中在碳水化合物代謝和次級代謝物代謝途徑中。對于糖代謝途徑,HA處理通過抑制酸性轉(zhuǎn)化酶(acid invertase,AI)和中性轉(zhuǎn)化酶(neutral invertase,NI)的表達(dá),并上調(diào)SS、SPS和PFK表達(dá),從而抑制桃果實蔗糖含量的降解及果糖和葡萄糖含量的上升。對于有機(jī)酸代謝,檸檬酸和蘋果酸是桃果實的主要有機(jī)酸,HA處理通過上調(diào)CS表達(dá)并下調(diào)IDH和烏頭酸酶(aconitase,ACO)的表達(dá)量,從而抑制檸檬酸含量的下降,同時HA處理通過上調(diào)磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PEPC)和MDH并下調(diào)ME的表達(dá)量,從而抑制桃果實蘋果酸含量的下降。對于酚類和花色苷代謝,HA處理可以通過上調(diào)PAL和肉桂酸羥化酶(cinnamate hydroxylase,C4H)的表達(dá)量,從而促進(jìn)苯丙氨酸向下游酚類物質(zhì)轉(zhuǎn)化,通過上調(diào)查耳酮合成酶(chalcone synthase,CHS)、查耳酮異構(gòu)酶(chalcone isomerase,CHI)和F3H表達(dá)量促進(jìn)桃果實黃酮類物質(zhì)的合成,并通過上調(diào)二氫黃酮醇還原酶(dihydroflavonol reductase,DFR)、ANS和UFGT表達(dá)量,從而提高桃果實花色苷的含量。

