布洛芬對稀有鮈鯽早期生命階段的急慢性毒性效應?
謝 丹,王明麗,王秀海??,胡 泓,李正炎,趙曉明,沈佳峰
(1.中國海洋大學環境科學與工程學院,山東 青島 266100;2.山東省青島生態環境監測中心,山東 青島 266003)
藥品的使用在治療疾病、提高人類平均壽命的同時也可能給生態環境造成壓力。中國作為世界上最大的藥品和個人護理品(Pharmaceuticals and Personal Care Products,PPCPs)生產國和消費國,對PPCPs的使用非常廣泛,其代謝產物進入水環境后,會給水生生物的生存帶來威脅。布洛芬(Ibuprofen,IBU)為非甾體類抗炎藥(Nonsteroidal anti-inflammatory drugs,NSAIDs),是一種不溶于水的白色結晶性粉末,其化學性質穩定、不易被降解,被廣泛應用于鎮痛、解熱以及抗炎等臨床治療中。對非甾體類抗炎藥使用情況的調查結果表明,IBU在全球被普遍使用,歐洲國家布洛芬和雙氯芬酸的使用率最高[1],亞洲國家布洛芬、雙氯芬酸、萘普生和乙酰水楊酸的使用率較高[2],且IBU已列為中國優先控制的藥物[3]。布洛芬被攝入人體后,經肝、腎代謝,大部分隨尿液及廢水處理廠等的大量排放進入自然環境,加劇了水環境的污染程度。
隨著IBU的廣泛使用,水體中IBU含量已呈上升趨勢。環境調查監測發現,英國、德國河流地表水IBU含量范圍為0.008~2.38 μg/L;污水處理廠進水中IBU含量高于河流,英國和瑞士污水處理廠進水中IBU的平均含量分別為20.7和3.12 μg/L[4-5]。在47個國家的地表水、地下水、飲用水和污水處理廠進出水等各類水體的6 950個樣品中檢測到IBU,平均濃度為0.108 μg/L,其中西歐地區的最高檢測濃度為303 μg/L[6]。對中國長江中、下游以及流域內四大淡水湖(洞庭、鄱陽、太和巢湖)范圍內31個站點的檢測中,僅在長江下游上海地區附近的2個河口站點檢測到 IBU,這可能是由于上海及周邊區域的廢水排放導致IBU在河口區域富集,其平均和最高濃度分別為11.3和99.3 ng/L[7]。在華北黃河、海河、遼河所有地表水中(共37個站點)均檢測到IBU,且在人口高密度地區、河流下游及匯合處檢測頻率較高,檢測濃度范圍為2.4~416 ng/L[8]。
由于IBU具有較高的生物活性,水生生物通過蓄積作用導致組織濃度增加,進而產生急、慢性毒性效應[9-10]。美國環保署也認為這類藥物可能對生物繁殖存在風險,尤其對生物生命早期階段更加敏感[11]。已有多項研究表明IBU對水生生物具有急性毒性效應,且其難降解的特性可能會對水生生物產生潛在的慢性毒性效應,特別是對富有經濟價值的物種。調查顯示,IBU會對魚類等高營養級生物產生慢性毒性作用,具有較高的生態風險,且水生生物對藥物中化合物的敏感性順序為藻類 > 水蚤 > 魚類[12]。
對布洛芬毒性效應的研究在國外最先開始,其中淡水物種占多數。生態毒理學研究表明,魚類長期暴露在低濃度的IBU中,代謝酶等受到影響,從而引起腎臟毒性、免疫抑制作用等[13]。IBU還可作用于中樞神經系統[14],會對菲律賓蛤仔(Ruditapesphilippinarum)的基因轉錄產生影響,導致神經損傷,進而產生氧化應激反應[15]。此外IBU還可抑制小球藻(Chlorellavulgaris)生長[16]。商品化的IBU[17]和雙氯芬酸[18]藥物均可在鯉魚(Cyprinuscarpio)的肝臟、皮膚和鰓等組織中富集,誘導其氧化應激[19]。IBU對斑馬魚(Daniorevio)不同組織的慢性毒性效應研究也得出了同樣的結果,證實了其在鰓和肝臟中的富集程度最高[20]。長期的IBU暴露會延長魚類產卵時間,可能會對魚類受精、繁殖產生影響[21]。Gutiérrez-Noya等發現IBU在環境濃度下能夠對鯉魚產生胚胎毒性和致畸作用[6]。較高濃度的IBU對斑馬魚胚胎發育、孵化率及仔魚的存活和行為活動等產生顯著影響[22]。Li等在研究化合物藥品萘普生對斑馬魚胚胎和仔魚的急性毒性時,產生了孵化抑制、心率變緩和形態異常等中毒反應[23]。有研究得出IBU的致畸指數(TI)值為2.82,因而證實其為潛在致畸物質[24]。目前IBU對水生生物毒性效應研究相對較少,且局限于組織器官和基因組學等方面的研究,缺乏對水生生物宏觀毒性效應的研究;而IBU的環境檢測濃度通常在μg/L級別,不足以對稀有鮈鯽產生宏觀毒性作用,難以評估IBU對水環境的生態風險。因此急需開展IBU宏觀毒性效應研究,探究IBU的毒性作用大小,評估其對水生生物的潛在危害,為中國IBU水質基準的制定和生態風險評估提供參考依據。
本實驗選用中國本土稀有鮈鯽(Gobiocyprisrarus)作為受試物種。稀有鮈鯽具有飼養方便、體型小、繁殖速度快、產卵量大等優勢,可實現人工控溫全年產卵,且胚胎透明易觀察[25]。研究表明,稀有鮈鯽與國際標準化受試物種斑馬魚對同一污染物的敏感性相近,毒性結果具有良好的重現性[26],且胚胎對藥物的敏感性高于仔魚[20]。本實驗參照文獻[27]中的NO.236、NO.210、NO.212和文獻[28],開展布洛芬對稀有鮈鯽的急、慢性毒性實驗,從受精卵開始進行暴露,涵蓋了生物早期生命階段。
1 材料與方法
1.1 實驗材料
本實驗所用布洛芬(IBU,C13H18O2,純度≥98%)產自上海麥克林生化科技有限公司。藥品于實驗當天用曝氣除氯后的自來水配制成120 mg/L母液,以甲醇為助溶劑,在磁力攪拌器上攪拌溶解2 h。母液每3 d配置一次,實驗時將母液加入曝氣除氯后的自來水,依次稀釋到所需質量濃度制成暴露溶液,暴露溶液中甲醇助溶劑終濃度最高為0.5%。上述所用試劑均為分析純。
1.2 受試生物
稀有鮈鯽親魚購自中國科學院水生生物研究所(武漢)。以不高于1 g/L的密度暫養于本實驗室30 cm×18 cm×20 cm(長×寬×高)的玻璃缸內(雌雄分開)。加熱棒控溫,溫度保持在(25±1)℃,采用循環過濾裝置,每5~6 d換2/3水(曝氣除氯48 h并用紫外燈照射殺菌的自來水)。光照周期14 h∶10 h(晝∶夜),自然日光燈照射。保持恒定條件馴養7 d以上,每天換水前、后測定缸內溶液的溶解氧、pH、溫度等參數,保持溶解氧含量大于飽和濃度的60%,pH在7.5~8.5之間。每日10:00和16:00按時飼喂紅蟲,每次喂食量以15~30 min吃完為準。
1.3 實驗方法
1.3.1 魚卵的收集 實驗開始前一天下午將親魚分別置于產卵網中,用網隔離以防止親魚吞食魚卵。用加熱棒控溫,并將水溫從25 ℃緩慢升高1 ℃,稀有鮈鯽產卵一般在晚20:00左右,產卵后8 h內收集,將幾個產卵網中的卵混合并隨機選擇用于實驗。稀有鮈鯽卵直徑為1.5 mm左右,采用內徑4 mm的一次性移液管進行卵的轉移,轉移過程中避免受精卵接觸空氣。通過體視顯微鏡下觀察來選擇分裂期間無明顯不規則或絨毛膜損傷的原腸期卵。
1.3.2 暴露實驗 將正常的受精卵與未受精卵分離(記錄受精率),將正常發育的卵轉移至用恒溫水浴鍋(26±1)℃預熱的標準24孔板中(每塊板設20個暴露組,4個空白組。每孔1個卵,共24個卵),并在暴露實驗前3 h內填充2 mL/孔的布洛芬溶液。胚胎孵化前每12 h更換90%的暴露液,孵化后每24 h更換一次暴露液,并及時剔除死亡的胚胎。每24 h記錄一次觀察結果,直到測試結束。在更新暴露液前后分別測量pH值,保持溶解氧濃度大于飽和度的80%,溫度(26±1)℃。根據預實驗結果,急性毒性試驗共設置55、65.45、77.88、92.68、110.3 mg/L 5個IBU濃度梯度實驗組,外加0.5%甲醇溶劑對照組和空白對照組。急性毒性實驗測試周期為96 h。
慢性實驗方法同急性實驗,待仔魚卵黃囊吸收完全,可以游動時,轉移至結晶皿中進行后續暴露實驗。每個結晶皿20條仔魚,250 mL暴露液。每個濃度組設置3個平行,每24 h更換一次暴露液,每天喂食豐年蝦蟲卵一次。持續觀察仔魚行為特征并記錄,及時撈出死亡的仔魚(死亡標志為身體發白,不游動,用玻璃棒觸動無反應)。慢性毒性實驗設置5、8、12.8、20.48、32.77、52.43 mg/L 6個濃度梯度實驗組,外加0.5%甲醇溶劑對照組和空白對照組。慢性毒性實驗測試周期為21 d。
在更換暴露液之前對所有不同濃度的暴露液進行取樣,用0.22 μm聚丙烯膜抽濾,采用高效液相色譜儀分析其濃度。
1.3.3 顯微鏡觀察 對受試胚胎進行每天至少1次的顯微鏡觀察:①48 h起記錄所有暴露組和對照組的孵化率及孵化時間;②在24、48、72和96 h后記錄尾巴未脫落的數量;③在24、48、72和96 h后記錄凝結的胚胎數量;④在24、48、72和96 h后記錄缺乏體節形成的胚胎數量(24 h后未形成體節可能是由于發育延遲所致。最遲在48 h后,應開始形成體節。如果沒有,則認為胚胎已經死亡);⑤在48、72和96 h后記錄無心跳(不規則心跳不記錄為無心跳);⑥記錄孵化后仔魚的成活率;⑦記錄其他畸形癥狀,如心包水腫、卵黃囊腫、脊柱和尾巴彎曲等。其中②~⑤為死亡標志[29]。
1.3.4 統計處理 急性實驗:運用SPSS Statistics 25.0對稀有鮈鯽胚胎的孵化率、死亡率、畸形率和異常率進行概率回歸分析,以濃度和各毒性效應終點的異常胚胎數目進行概率分析和卡方檢驗(p>0.15即存在顯著性差異),確定其95%置信區間,估算96 h時布洛芬對稀有鮈鯽胚胎的急性毒性效應值,即半數效應或半數致死濃度(ECx或LCx)。
慢性實驗:運用SPSS Statistics 25.0對稀有鮈鯽早期生命階段的孵化率、死亡率、畸形率、異常率、全長、干質量和濕質量進行顯著性檢驗。對3組平行比較均值,進行單因素ANOVA方差分析,運用Dunnett′s Test(1-Side,p<0.05)進行多重比較顯著性檢驗,估算布洛芬對稀有鮈鯽早期生命階段的孵化率、死亡率、畸形率、異常率、全長、干質量和濕質量的慢性毒性值無,即可見效應濃度(NOEC)和最低可見效應濃度(LOEC)。
2 結果與討論
2.1 急性實驗
2.1.1 結果分析 經卡方檢驗,各暴露組稀有鮈鯽胚胎的孵化率、死亡率、畸形率、異常率較空白對照組均存在顯著性差異(p>0.15)。隨IBU濃度的升高,稀有鮈鯽胚胎的孵化率持續降低,死亡率、畸形率和異常率均不斷增高。高濃度組(≥77.88 mg/L)在24 h后已出現凝結死亡、畸形等中毒反應。最低濃度暴露組(55 mg/L)在48 h后出現畸形現象,60 h時出現凝結死亡現象,暴露過程中孵化率未受到影響,96 h時的孵化率為100%(見表1)。而濃度為65.45 mg/L時,稀有鮈鯽胚胎的孵化過程受到顯著影響,孵化率隨暴露濃度的升高逐漸降低;濃度為110.3 mg/L時,胚胎在96 h后均未孵化,數據擬合得出孵化率的96 h LC10為112.7 mg/L(見表2)。

表1 布洛芬對稀有鮈鯽胚胎孵化率、死亡率、畸形率和異常率的影響

表2 布洛芬對稀有鮈鯽胚胎的急性毒性效應值
對于65.45 mg/L暴露組,24 h時出現尾部畸形狀態,48 h時出現凝結死亡、脊柱彎曲和卵黃囊腫等中毒現象;77.88和92.68 mg/L暴露組于24 h時即出現凝結死亡現象;110.3 mg/L濃度下,96 h時所有受試胚胎全部死亡,并均伴隨畸形。說明在此暴露濃度范圍內,稀有鮈鯽胚胎的毒性效應與暴露濃度成正相關。數據擬合得出LC50和畸形率的EC50均為77.73 mg/L;在92.68 mg/L 暴露組中,96 h后所有受試胚胎均出現異常,采用SPSS進行數據擬合得出異常率的EC50為66.7 mg/L。表3列出了IBU 12 和24 h的實測濃度(更換暴露液前的舊溶液),回收率均在90%~100%之間,在名義濃度的±20%范圍內,說明IBU具有良好的穩定性,可用配置的暴露液濃度作為最終濃度來計算毒性效應值。實驗中空白對照和溶劑對照組的胚胎總存活率、孵化率均為100%,符合胚胎急性毒性實驗要求。
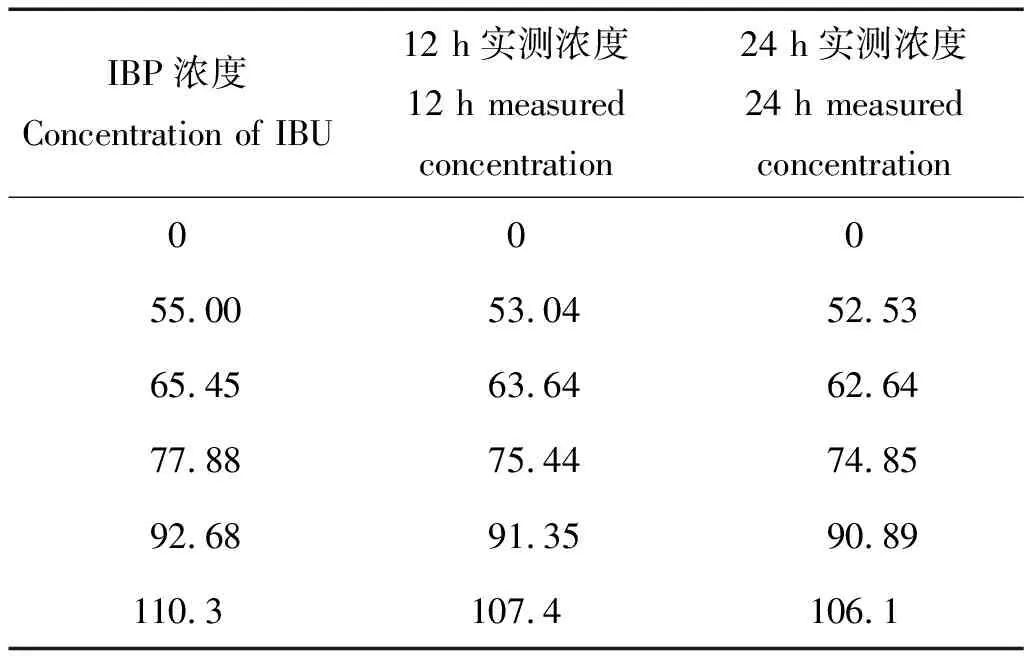
表3 各實驗組中布洛芬的實測濃度
IBU對稀有鮈鯽胚胎的急性毒性作用主要表現在出膜時間延遲、孵化率降低、胚胎凝結死亡、尾巴未分離、缺乏體節形成、心臟凝結無心跳、心包水腫、卵黃囊腫、脊柱和尾巴彎曲、發育遲緩、出膜后體形小以及胸鰭、尾鰭和口部等組織發育異常等(見圖1)。其中心包水腫最為普遍,且在急性實驗期間,各暴露組所有胚胎在96 h后均產生了不同程度的異常現象。急性實驗過程中觀察到胚胎存在心跳抽動的未計入死亡數。IBU對胚胎死亡的96 h半數致死濃度在10~100 mg/L范圍內(見表2),參照水生生物急性毒性分級為B級,屬于低毒類化學品。

(心包水腫 Pericardial edema;胚胎凝結 Embryo coagulation;凝結死亡 Condensation death;脊柱縱彎 Spine vertical bend;脊柱橫彎 Spine bending;口部組織發育異常 Dysplasia of oral tissue;脊柱彎曲 Spinal curvature;發育遲緩 Developmental retardation;心臟凝結 Cardiac coagulation;卵黃囊腫 Yolk cyst;尾巴彎曲。)
2.2 慢性實驗
2.2.1 結果分析 布洛芬對稀有鮈鯽慢性毒性實驗結果見表4、5。慢性實驗中IBU各暴露組對稀有鮈鯽胚胎的孵化率無明顯影響,孵化率均為100%,當濃度大于32.77 mg/L時,出膜時間出現延遲。
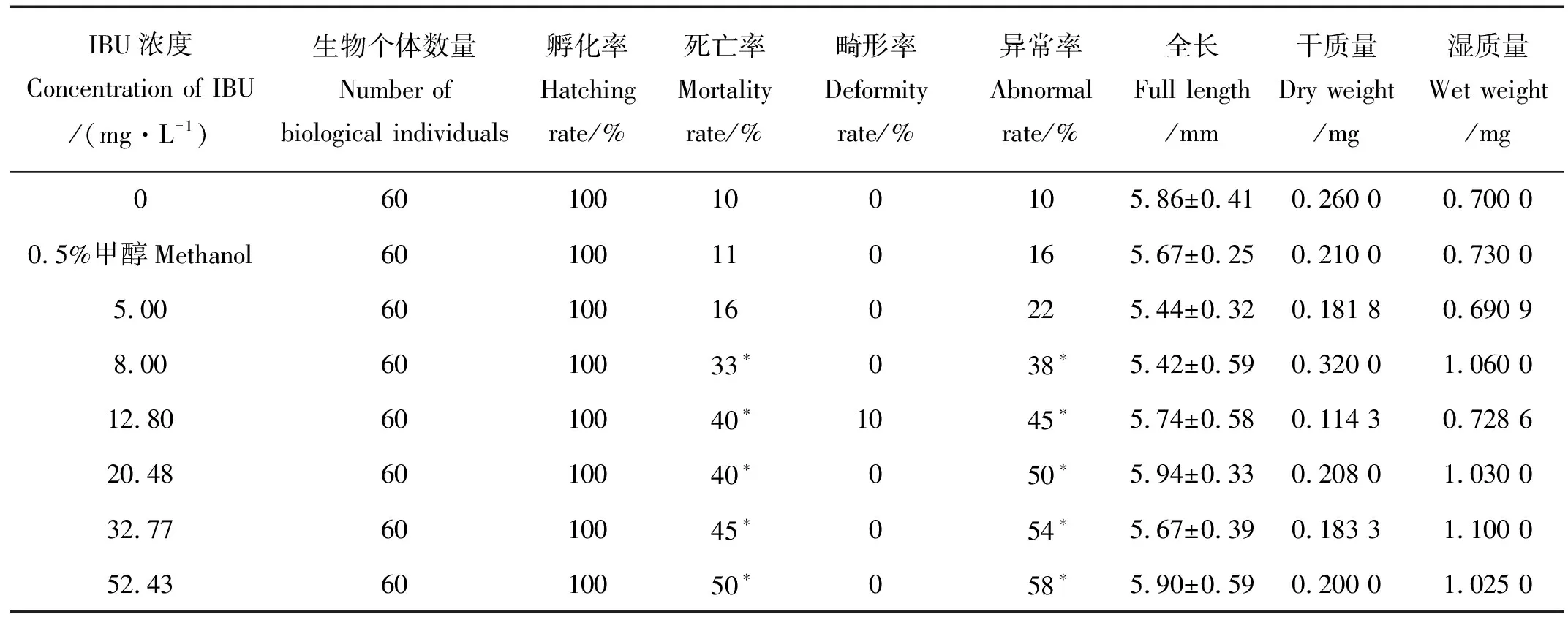
表4 布洛芬對稀有鮈鯽孵化率、死亡率、畸形率、異常率、全長和干、濕質量的影響

表5 布洛芬對稀有鮈鯽的慢性毒性效應值
5 mg/L暴露組死亡數量較對照組無顯著差異(p>0.05)。當IBU濃度達到8 mg/L時,毒性作用顯著增強,稀有鮈鯽的死亡數和異常數較其他暴露組明顯增加。暴露第7天觀察到異常稀有鮈鯽仔魚心包處凝結發紅,且伴隨游動不協調現象。一旦出現游動不協調或不游動及不進食等異常現象的仔魚,在1~2 d后均死亡。運用SPSS進行數據擬合得出死亡率的NOEC為5 mg/L,LOEC為8 mg/L。
從異常率來看,IBU濃度達到8 mg/L時,稀有鮈鯽異常數目相比空白對照和5 mg/L濃度組存在明顯差異,異常率的NOEC和LOEC分別為5和8 mg/L。對稀有鮈鯽的全長和干、濕質量數據的檢驗分析結果顯示IBU濃度在0到52.43 mg/L范圍內無顯著性差異,表明此濃度范圍內IBU對稀有鮈鯽的全長和干、濕質量無明顯毒性作用,其毒性效應值NOEC均為52.43 mg/L,LOEC均大于52.43 mg/L。分別在7 和14 d對各濃度組取樣,測定24 h的IBU實際濃度(更換暴露液前的舊溶液),結果顯示回收率均在110%~120%之間,保持在名義濃度的-20%~20%之內,因此可用配置的暴露液濃度作為最終濃度來計算毒性效應值。
IBU對稀有鮈鯽早期生命階段的毒性作用主要表現在胚胎的凝結死亡、心包水腫、卵黃囊腫等和仔魚的存活、發育遲緩、組織發育異常、脊彎、尾彎以及行為異常等(見圖1)[30]。其中行為異常發生率最高,主要表現有不游動或游動不敏捷、不協調,魚體側翻、沉在缸底,呼吸困難,不進食或身體發白等。慢性實驗中鮈鯽的死亡現象均發生在孵化出膜之后。
2.3 稀有鮈鯽各發育時期及形態特征
表6列出了稀有鮈鯽各發育時期及形態特征,包含卵裂期、囊胚期、原腸期、分裂期、成形期和孵化期,與斑馬魚相似[31-32]。稀有鮈鯽胚胎透明,受精卵具有黏性、能沉底、吸水膨脹,因此易觀察,而未受精的卵呈乳白色。受精卵孵化溫度一般在20~30 ℃范圍內,隨溫度升高而縮短,表6為各個發育時期均為孵化溫度((26±1)℃)的時間和形態特征。圖2展示了稀有鮈鯽正常發育各個時期的顯微鏡觀察照片。

表6 稀有鮈鯽各發育時期及形態特征

圖2 稀有鮈鯽胚胎正常發育各時期圖
3 討論
3.1 急性毒性效應
急性實驗結果顯示,IBU對稀有鮈鯽胚胎死亡率的LC50為77.73 mg/L,與畸形率(77.73 mg/L)、異常率(66.70 mg/L)的毒性效應值相差不大。在高濃度作用下胚胎從產生畸形、心包水腫和卵黃囊腫等毒性效應到發生死亡凝結的時間間隔較小,死亡濃度范圍較窄,說明在高濃度作用下稀有鮈鯽胚胎中毒作用快且明顯。同樣將大型蚤(Daphniamagna)暴露在高濃度IBU(200 mg/L)中,結果顯示死亡均發生在暴露24 h后[33],濃度大于10 mg/L時大型蚤繁殖率降低,低于40 mg/L時不引起死亡,但高于80 mg/L時無存活。研究表明,IBU在低濃度下會對斑馬魚胚胎及仔魚產生心臟毒性,對心臟結構和發育產生影響[36],EC50為2.496 mg/L。
暴露于IBU的斑馬魚胚胎同樣產生了孵化率降低、發育遲緩、組織器官畸形、色素減退、心包水腫、胚胎死亡率升高及氧化損傷等毒性效應[22, 24]。IBU作為一種丙酸衍生物[37],又稱非選擇性抑制劑[22],能對環氧化酶(COX)產生抑制作用;而COX是胚胎發育過程中一種重要的酶[38]。IBU通過抑制COX-1和COX-2系統來抑制前列腺素(PG)的合成[39-40]前列腺素(PG)在生殖、維持心血管系統穩定以及組織器官形成中發揮重要作用[41]。IBU通過對COX-1的抑制,破壞心血管內環境穩定,導致胚胎心率異常、形成心包水腫,從而壓迫心臟,造成心臟損傷等[42],最終導致胚胎發育遲緩、組織器官畸形等毒性效應[36]。這也是心包水腫在本研究中普遍產生的原因。
細胞色素P450酶(CYP)是與藥物代謝相關的酶,IBU的致畸作用可能是由于其和多種CYP作用,發生了生物轉化[43-44],使代謝產物具有更高的毒性[45]。本實驗中隨IBU濃度的升高,稀有鮈鯽胚胎的孵化率持續降低,這與Sánchez-Aceves等[24]和Xia等[46]的研究結果一致,可能是由于IBU的作用導致蛋白酶活性受到抑制、改變了絨毛膜的滲透性,使內部耗氧量增加致使自發運動減少,最終對發育過程產生影響,如尾巴不能正常脫落而導致胚胎死亡及孵化延遲等[47-49]。稀有鮈鯽的多種中毒現象表明,IBU會對稀有鮈鯽胚胎的孵化及組織器官、神經系統的發育產生影響,對其生存構成威脅。
3.2 慢性毒性效應
慢性實驗中,低濃度組對稀有鮈鯽胚胎的孵化率、仔魚的全長和干、濕質量均未產生明顯毒性作用。當IBU濃度達到8 mg/L時,仔魚形態異常的數量相較空白對照顯著性差異,暴露期間仔魚出現不游動、不進食和身體翻轉等現象,1~2 d內均死亡。表明長期的IBU暴露會對稀有鮈鯽的心臟、腦和骨骼等組織發育及代謝等生理活動產生影響,出現氧化應激反應。有研究表明,較高濃度的IBU(1 000 μg/L)可通過改變生物標記物來降低菲律賓蛤仔的免疫力,最終導致氧化應激反應[50];暴露于較高濃度IBU的斑馬魚仔魚同樣出現了不游動或游動顯著減少的現象,且相較雙氯芬酸而言,IBU的毒性作用更為緩慢且持久[46]。
IBU直接作用于COX-1和COX-2系統,抑制環氧化酶,導致胚胎自發運動減少、孵化延遲和骨骼發育缺陷等,可能是稀有鮈鯽產生畸形和不游動的原因,且IBU是通過作用于人的中樞神經系統來達到止痛的目的[51],因此能夠證明其具有潛在神經毒性[46]。對斑馬魚的基因測試也證實了這一點,基因表達的減少導致腦損傷,進而表現為行為異常等毒性效應[46]。魚類暴露于IBU中導致其氧化還原系統發生變化,蛋白等被代謝為有毒物質,進而產生胚胎毒性,導致仔魚嚴重畸形等[52]。
多項研究表明IBU可在魚類肝臟和鰓等組織中富集[17, 20],并且由于其特殊的藥物特性和作用機制,使其對水生生物的毒性效應緩慢且持久,長期的低濃度暴露引發氧化應激反應[19];這也表明IBU在組織器官中的蓄積作用可能是導致稀有鮈鯽產生宏觀慢性毒性效應的原因。IBU對蝸牛(Planorbiscarinatus)的21 d毒理學實驗結果顯示,存活率的LOEC和NOEC分別為45.36和5.36 mg/L,孵化率的LOEC和NOEC分別為5.36和2.43 mg/L[53],與本實驗毒性效應值相近;而IBU對斑馬魚DNA的慢性毒性效應值為66.4 ng/L[54],慢性毒性效應值相差較大。因此,IBU對水生生物的宏觀和基因組學毒性效應之間的差異和聯系還需進一步研究。通過本實驗發現,稀有鮈鯽胚胎及仔魚均展現了良好的生物學特性,其毒理學特征與斑馬魚具有很大程度的相似性,展現了良好的適用性,可作為毒理學實驗的模式生物。且中國尚未開展布洛芬水質基準的研究與制定,本實驗得出的IBU急、慢性毒性效應值可為今后IBU的基準制定提供依據。
3.3 展望
由于布洛芬具有化學穩定性,其在水環境中不易被降解,長時間的暴露對生物各個組織器官具有潛在危害,需進一步開展布洛芬對稀有鮈鯽早期生命階段的組織器官和基因組學等方面毒性效應的研究,并與宏觀毒性效應進行對比分析。另外,水環境中通常有多種污染物共同存在,混合物對水生生物的毒性作用與機制還有待研究。本研究中IBU的暴露濃度高于水環境中的檢測濃度,對此,今后將進一步研究環境相關濃度下IBU對稀有鮈鯽胚胎的潛在毒性效應。
4 結論
(1)一定濃度的布洛芬暴露下,稀有鮈鯽胚胎及仔魚均呈現不同程度的毒性效應,包括孵化率降低、凝結死亡、心包水腫、卵黃囊腫、脊柱和尾巴彎曲、發育遲緩、組織發育異常和行為異常等。其中:心包水腫在急性毒性實驗中最普遍;行為異常在慢性實驗中發生率最高。
(2)急性實驗中,稀有鮈鯽的毒性效應貫穿胚胎發育全過程;慢性實驗中,低濃度對胚胎發育、孵化率和畸形率無效應,但對孵化后的仔魚具有毒性效應,多表現為行為異常。
(3)稀有鮈鯽胚胎透明、易觀察、對污染物暴露敏感,可作為生態毒理學研究的潛在模式生物。
(4)水生生物對IBU存在生物蓄積作用,通過長期的暴露會對水生生物的生存和繁殖產生危害,應加強IBU慢性毒性效應的研究;另外,污水處理廠的進出水、河口及河流交匯處的IBU濃度高,具有較高的生態風險,應予以廣泛的關注。

