動脈入路胰腺全系膜切除胰十二指腸切除術治療胰頭癌的臨床效果觀察
肖 杰,周 濤,孫占虎,楊 磊,胡光明,張華平
胰頭癌是發生于胰腺頭部的惡性腫瘤,近年來發病率有逐漸增高的趨勢,其惡性程度較高,病情進展迅速,早期診斷困難,預后不佳[1]。胰十二指腸切除術(PD)是胰頭癌患者標準治療方法,治療后患者遠期復發率、長期生存率與術中切緣陰性(RO)密切相關[2-4]。但在胰頭癌PD中所涉及的解剖方式復雜,且切除范圍大,因此術后并發癥的發生風險也隨之增加[5]。有學者提出,改變PD手術入路可降低其操作難度,增加術中RO率,進而達到提高治療效果、改善患者預后的目的[6-7]。基于此,本研究分析以動脈入路胰腺全系膜切除PD和傳統PD對胰頭癌的治療效果,為臨床治療術式選擇提供參考。現報告如下。
1 資料與方法
1.1一般資料 收集2017年1月—2020年1月本院收治的胰頭癌81例。納入標準:均經病理檢查證實為胰頭癌;均為首次治療,臨床資料完整;術前均進行影像學檢查;患者及家屬均知曉本次研究,簽署知情同意書。排除標準:出現轉移者;肝腎功能異常者;有上腹部手術史者。根據術式不同分為傳統PD治療組(傳統組)38例,動脈入路胰腺全系膜切除PD治療組(觀察組)43例。傳統組男21例,女17例;年齡40~72(51.62±4.58)歲;腫瘤直徑:10~35(14.61±1.77)mm;臨床分期:Ⅰ~Ⅱ期27例,Ⅲ~Ⅳ期11例。觀察組男24例,女19例;年齡40~72(51.49±4.17)歲;腫瘤直徑:11~35(15.20±1.15)mm;臨床分期:Ⅰ~Ⅱ期29例,Ⅲ~Ⅳ期14例。2組性別、年齡等方面比較差異無統計學意義(P>0.05),具有可比性。
1.2方法 傳統組:氣管插管全身麻醉,麻醉滿意后以右側反L型切口進入患者腹腔,排除肝臟、腹腔轉移后行Kocker切口,將十二指腸側腹膜切開,探查腫瘤是否侵襲門靜脈/腸系膜靜脈。將遠端胃離斷,暴露肝總動脈,分離膽囊并離斷肝總管,肝十二指腸韌帶脈絡化;將胰腺頸部、頭部、胰腺鉤突、門靜脈、腸系膜等結扎、離斷。在只剩胰腺鉤突與腸系膜上動脈相連接后,將腸系膜上動脈的纖維鞘膜縱行切開,分離后露出鉤突系膜,并由上而下鉗夾、切斷、結扎腸系膜上動脈與胰腺間的組織與動脈血供,胰腺十二指腸下動脈需單獨結扎。術后將胰腸、胃腸、膽腸吻合,并對腹腔進行充分沖洗,放置引流管后依次縫合切口,結束手術。觀察組:麻醉方法及切口同對照組。將十二指腸、胰頭部仔細游離后,結扎、離斷十二指腸下動脈。使用硅膠管懸吊腸系膜上動脈,結扎、離斷小分支,分離腸系膜上動脈至十二指腸水平部與升部交界區;切斷胰腺系膜,清掃淋巴結、脂肪組織。將胃結腸韌帶打開,離斷胃,隨后打開小網膜囊,直達肝十二指腸韌帶左緣,清掃淋巴結。解剖并懸吊肝總動脈,切斷、結扎胃十二指腸動脈、胃右動脈,并將肝總動脈骨骼化,清掃腹腔干周圍淋巴結。骨骼化肝固有動脈及其分支的3條入肝動脈,將門靜脈左側的結締組織均清除干凈。肝總管進行橫斷,結扎遠側斷端,清掃門靜脈后、胰頭上緣的淋巴結及結締組織。在距屈氏韌帶10~15 cm處將空腸切斷,暴露胰腺上、下緣處門靜脈及腸系膜上靜脈前壁,在其前方結扎、切斷胰腺頸部。離斷胰腺鉤突部系膜,沿腹主動脈前壁向上解剖至腹腔干,切斷附著于腹腔干的胰腺系膜,清掃腹腔干右側的淋巴組織。若腸系膜上靜脈、門靜脈未受腫瘤侵犯,可于胰腺鉤突右側從上至下、從右向左結扎、離斷門靜脈和腸系膜上靜脈的分支;若懷疑腸系膜上靜脈、門靜脈受侵犯,則在腸系膜上靜脈、門靜脈預置阻斷帶,再對其分支結扎、離斷。腸系膜上靜脈、門靜脈僅受壓者可安全剝離,腸系膜上靜脈、門靜脈受侵犯者行受侵血管切除對端吻合。后續步驟同傳統組。2組術后均根據患者實際情況行規范化療。
1.3觀察指標
1.3.1手術情況及住院時間:手術指標包括手術時間、腸胃功能恢復時間、術中出血量。
1.3.2RO率及腫瘤復發率:術后根據病理結果了解腫瘤復發情況,未發現殘留癌細胞組織視為RO,記錄RO率。對患者進行隨訪,了解患者術后6個月復發情況,經影像學檢查可見復發病灶,出現遠處轉移為腫瘤復發。
1.3.3腫瘤標志物水平:包括癌胚抗原(CEA)、糖類抗原19-9(CA19-9)、糖類抗原50(CA50)。2組均于術前和術后1個月采靜脈血5 ml,使用酶聯免疫吸附試驗進行檢測,儀器為Multiskan Ascent全自動酶標儀,試劑盒由Genzyme公司提供。
1.3.4并發癥發生情況:觀察并記錄2組術后出血、感染、胃排空障礙、胰瘺/膽瘺等發生情況。
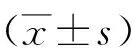
2 結果
2.1手術指標、住院時間 觀察組手術時間、腸胃功能恢復時間、住院時間均短于傳統組,術中出血量少于傳統組(P<0.01)。見表1。
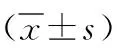
表1 2組胰頭癌手術指標及住院時間比較
2.2RO率、腫瘤復發率 觀察組RO 38例(88.37%),傳統組RO 23例(60.53%);觀察組RO率高于傳統組(P<0.01)。觀察組復發3例(6.98%),傳統組復發11例(28.95%);觀察組復發率低于傳統組(P<0.01)。
2.3腫瘤標志物水平 2組手術前后CEA、CA19-9、CA50水平組間比較差異均無統計學意義(P>0.05);2組術后CEA、CA19-9、CA50水平均低于術前(P<0.05)。見表2。
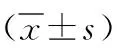
表2 2組胰頭癌手術前后腫瘤標志物水平比較
2.4并發癥發生情況 2組并發癥發生率比較差異無統計學意義(P>0.05)。見表3。

表3 2組胰頭癌術后并發癥發生情況比較[例(%)]
3 討論
PD為胰頭癌主要治療手段。在傳統PD治療中需了解患者是否出現肝、腹腔轉移,隨后行Kocher切口,并了解胰腺周圍、腸系膜上靜脈、門靜脈等部位是否存在侵犯和轉移情況,對于未出現腫瘤侵犯者行根治性PD治療[8-9]。因此在傳統PD治療過程中由于腫瘤在術中可受到反復的觸碰、擠壓易出現腫瘤細胞脫落進入血液的情況,可引起血行轉移,影響治療效果,增加術后復發風險[10-11]。
本研究發現,2組術后CEA、CA19-9、CA50水平均較術前降低,而觀察組術后恢復情況優于傳統組,RO率高于傳統組,復發率低于傳統組,且不增加并發癥發生風險。提示動脈優先入路的PD治療可提高胰頭癌RO率,從而降低復發率,并促進患者恢復。分析原因:①美國國立綜合癌癥網絡指南表明,胰頭癌侵犯腸系膜上動脈>180°時不可進行切除治療,侵犯腸系膜上動脈<180°、門靜脈/腸系膜上靜脈重建時則可行切除治療,在治療過程中可完成RO切除使患者受益[12-13]。以動脈優先入路可對患者腸系膜上動脈進行探查,了解其受侵犯情況,從而決定手術是否繼續,以達到減輕手術創傷的目的[14-15]。②采取動脈優先入路PD治療時先阻斷胰頭部血液供應,為切斷胰腺頸部建立了安全區域,從而減少術中出血量,加快手術進程[16-18]。以往有研究發現,選擇動脈優先入路的PD治療可明顯縮短手術時間,減少術中出血量,本研究結果與文獻報道相符[19-20]。③傳統PD治療復發率較高,以腹部局部復發常見[21-22]。以動脈優先入路的PD治療則是在術中將腹腔干右側、腸系膜上動脈神經、脂肪、淋巴均完全切除,從而有效提高了腹膜后RO率,降低復發率[23-24]。④動脈優先入路的PD治療從腫瘤側后方離斷胰腺頸部,分離鉤突,可更好暴露手術區域,并以血管懸吊、牽拉的方式減少在PD時對腫瘤的擠壓、拉扯,在一定程度達到了“無接觸”切除的目的[25-26]。本研究結果顯示,2組并發癥發生率比較差異無統計學意義,提示動脈入路胰腺全系膜切除PD治療胰頭癌臨床效果較好,且不增加并發癥發生率。
綜上所述,動脈入路胰腺全系膜切除PD治療胰頭癌臨床效果佳,可提高RO率,降低復發率,對改善患者預后有積極意義。

