復發腦膠質瘤再手術治療的臨床療效
朱曉鋒 ,周廣平 ,王來藏 ,周厚俊 ,耿 鑫 ,余化霖 ,李經輝 ,白 鵬
(1)昆明醫科大學第一附屬醫院神經外二科,云南 昆明 650032;2)成都市第五人民醫院神經外科,四川 成都 610000)
腦膠質瘤是最常發生的中樞神經系統惡性腫瘤之一,源于顱內的神經上皮組織,在顱腦腫瘤中所占比例 > 40%[1]。一般情況下,低級別的膠質瘤的預后良好;高級別膠質瘤存在較強的侵襲性,預后極不理想。高級別膠質瘤-間變型膠質瘤的5 a 生存率約30%,膠質母細胞瘤的5 a 生存率只有5.5%,膠質母細胞瘤患者的生存期小于1 a 的超過了50%[2]。膠質瘤的治療方法較多有顯微外科手術治療;術后輔助治療(放化療等);免疫及基因靶向治療等,但幾乎所有的膠質瘤都會復發,導致病患預后不佳[3]。復發膠質瘤的再治療十分必要但任務艱巨,且沒有標準選擇的治療方式[4],對于復發腦膠質瘤的治療通常包括再次外科手術治療、全身化療、局部放射等綜合治療,外科手術治療復發腦膠質瘤并非只追求全切腫瘤,而是在最大限度進行腫瘤切除的基礎上盡可能對患者的神經功能進行保護,使其生存期得到延長。對28例腦膠質瘤手術后復發再手術患者的臨床資料進行回顧性分析,再次手術治療的臨床療效用KPS(Karnofsky physical status scores)進行評估,通過影像學資料評價腫瘤切除程度、術后病理診斷對比復發腦膠質瘤的病理變化、術后輔助治療、隨訪患者生存期等總體進行療效評價,現就其手術情況及治療效果報告如下。
1 資料與方法
1.1 研究對象
選取2017 年9 月至2020 年12 月昆明某三甲醫院神經外科收住的腦膠質瘤手術后復發再手術患者的全套病歷資料,按納入及排除標準篩選腦膠質瘤復發后再手術的患者作為研究對象,共28例。28例患者,男性15例、女性13例,年齡(11~68)歲;平均年齡(45.46±12.26)歲,男性平均年齡(44.56±14.03)歲,女性平均年齡(47.79±9.45)歲,發病多集中于(40~50)歲之間。
1.2 納入標準
首次接受神經外科的顯微手術切除,病理診斷最終結果為腦膠質瘤;術后MRI 隨訪證實為腫瘤復發;針對性的進行再次手術治療,病理診斷最終結果為腦膠質瘤;臨床病歷、術后隨訪的資料完整。
1.3 排除標準
首次神經外科手術經病理診斷證實為非腦膠質瘤患者或雖為腦膠質瘤但因各種原因未行二次手術治療的患者,影像學、隨訪資料不完整;根據觀察術后的并發癥、腫瘤復發情況隨訪結果,確認有影響同時出現其他的系統疾病、或存在嚴重的臟器功能障礙。
1.4 臨床資料
研究對象首次手術病理的診斷結果:WHOⅠ-Ⅱ級患者13例;WHO Ⅲ-Ⅳ 級患者15例;膠質母細胞瘤12例;星形細胞瘤15例;少突膠質細胞瘤1例;首次手術后進行相關輔助治療(放療、化療、靶向治療等)的患者 22例、未進行 相關輔助治療(放療、化療、靶向治療等)的患者 6例,見表1。
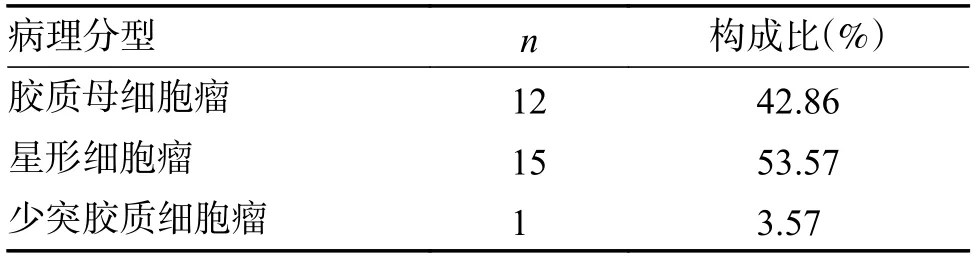
表1 臨床資料分析結果Tab.1 Clinical data analysis results
患者再次入院后,臨床表現包括頭痛頭暈、惡心嘔吐、言語功能及肢體功能障礙、癲癇發作等,其中頭暈頭痛21例;肢體功能障礙15例;言語功能障礙7例;惡心嘔吐6例;癲癇發作4例;視力下降3例;面神經功能障礙、平衡功能障礙、精神癥狀各1例;再次入院查體的陽性體征主要以肢體肌力減退、面神經功能障礙、共濟失調、病理征陽性等為主,其中肢體肌力減退15例、面癱2例、共濟失調3例、Romberg 征陽性2例、指鼻試驗陽性1例、跟膝脛試驗陽性1例,見表2。首次手術后距再手術時間,平均(31.75±43.82)月,最長時間204 月,最短時間1 月,WHOⅠ-Ⅱ級患者手術間隔時間平均(37.30±35.42)月,WHOⅢ-Ⅳ級手術間隔時間平均(25.31±50.08)月。

表2 再入院臨床癥狀分析Tab.2 Analysis of clinical symptoms of readmission
1.5 影像學檢查
本組 28例患者均行MRI 和/或CT 隨訪復查,MRI 序列在膠質瘤術后隨訪中起重要作用,膠質瘤病灶信號在T1 上低,T2 上混雜,瘤周水腫高,DWI/SWI/PWI/MRS/DTI 等多序列在膠質瘤的生長中起重要的提示作用。CT 可顯示腫瘤卒中或腫瘤伴鈣化。首次手術后MRI 診斷結果,復發部位:額葉18例(64.3%);顳葉10例(35.7%),見表3。中線移位、側腦室受各12例(42.9%);腦積水5例(17.9%);大腦鐮下疝3例(10.7%);四腦室受壓2例(7.1%);大腦中動脈被包裹、大腦前動脈被包裹各1例(3.5%)。應用多田氏體積計算法,計算腫瘤體積平均(37.15±45.90)cm3,最大體積178 cm3,最小體積 0.19 cm3。

表3 復發情況分析Tab.3 Analysis of clinical symptoms of readmission
1.6 手術治療
(1)術前處理:根據術前影像學檢查,給予患者脫水降顱壓、甲強龍等激素治療改善腫瘤周圍水腫。
(2)手術原則:瘤內分塊進行腫瘤切除,在盡量全部切除的基礎上,最大程度保護正常的腦組織。
(3)手術方式:本研究28例患者均行再手術治療,26例(92.9%)患者行開顱腫瘤切除,腫瘤活檢術及V-P 分流術(流行腦室腹腔分流術)2例(7.1%),其中患者聯合術中超聲實時指導腫瘤邊界8例(28.6%)。3 患者聯合術中超聲 MRI 融合影像技術指導腫瘤切除例(10.7%),患者行術中喚醒清醒狀態下腫瘤切除2例(7.1%),患者術中顯微鏡聯合神經內鏡技術切除腫瘤2例(7.1%),全部患者均應用術中電生理監測技術指導手術切除,術后1 周內MRI 平掃+增強+彌散證實腫瘤全切(切除率 > 90%)21例(75%),次全切(切除率 >60%,< 90%)5例(17.9%),腫瘤活檢(僅留取少量組織行病理活組織檢測)2例(7.1%)。
(4)術后處理及隨訪:對患者的血壓、神志、瞳孔等生命體征的變化情況進行密切觀察,防止術區出血、術后腦水腫、繼發性癲癇等并發癥出現。對出院患者進行定期隨訪,用KPS 進行神經功能缺損的評估。采用MR 復查,進行腫瘤切除程度及患者顱內情況判斷。對神經功能缺損、顱內感染、腦疝形成、癲癇發作、腦積水及肺部感染的并發癥發生率、患者術前術后癥狀改善率進行統計分析。
1.7 統計學處理
通過Graphpad Prism(V8.4.2.679)軟件,進行數據分析、作圖。用均數±標準差()描述連續性變量。用例數和百分比或構成比描述非連續性變量,術前及術后的KPS 評分差異性用配對t檢驗分析,檢驗水準α=0.05。
2 結果
2.1 腫瘤切除程度
本組28例患者均進行再手術治療,術后1 周內MRI 平掃+增強+彌散證實腫瘤全切(切除率 >90%)21例(75%),次全切(切除率 > 60%,< 90%)5例(17.9%),腫瘤活檢(僅留取少量組織行病理檢測)2例(7.1%)。2例(7.1%)行V-P 分流患者腦積水改善明顯,見圖1。
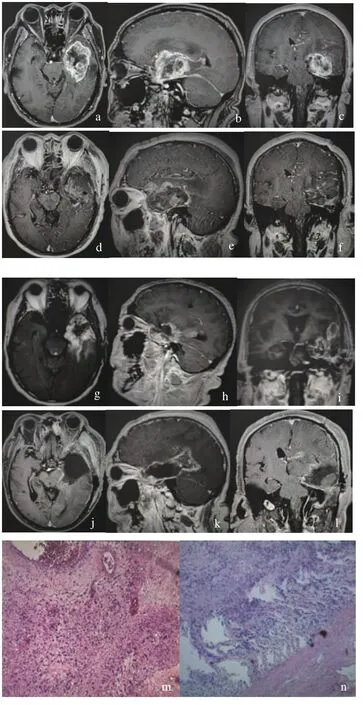
圖1 63 歲男性患者手術前后的影像學及病理資料Fig.1 Imaging and pathological data of a 63-year-old male patient before and after surgery
2.2 術后病理結果
對比首次術后患者病理檢驗結果,8例(28.6%)WHOⅠ-Ⅱ級膠質瘤患者出現病理級別增高,再手術后病理級別進展為 WHOⅢ-Ⅳ級,見圖1。11例(39.3%)WHOⅢ-Ⅳ級膠質瘤患者再手術后病理級別無變化,9例(32.1%)WHOⅡ級膠質瘤患者再手術后病理級別無變化。
2.3 術后并發癥及癥狀改善情況
術后1 周內評估研究對象,術后22例出現并發癥(78.6%),其中15例肺部感染(53.6%);3例切口愈合不良(10.7%);2例肢體肌力減退的2例(7.1%);肢體淺感覺減退、面癱1例、聽力下降、顱內感染各1例(3.5%)。顱內感染患者隨訪至出院后21 d 死亡,肺部感染及切口愈合不良患者至出院恢復良好。至離院時評估患者癥狀較前改善24例,改善率85.7%。
2.4 術后隨訪情況
所有患者進行隨訪,本研究28例患者再入院前至少已進行1 次外科手術切除腫瘤,最終病理檢測診斷為膠質瘤,首次術后進行門診、電話、微信隨訪,術后每3 月復查MRI 平掃+增強+彌散序列,9例(32.1%)患者再入院前1~3 月MRI 提示疑似復發可能,隨訪至入院前,腫瘤較前增大,患者出現輕微癥狀如頭痛等再入院行外科手術治療。對所有患者進行再入院術前的KPS 評分,平均分(66.07±7.37),術后2 周的KPS 評分,平均分(72.14±11.00),術后KPS 評分高于術前KPS評分,差異有統計學意義(P< 0.05),見表4。所有患者出院后進行隨訪,每3 月進行隨訪1 次,隨訪不足3 月按最后隨訪日期計算,9例(32.1%)患者隨訪至今,按最大隨訪日期計算生存時間,20例(71.4%)患者隨訪至出院某一時間段死亡。28例患者平均生存時間(7.98±6.42)月,最大生存時間24 月,最小生存期限0.6 月。男性、女性患者的生存期差異沒有統計學意義(P> 0.05);再次術前進行放化療的患者,中位生存期低于再術前未進行放化療的患者;再次術后病理 WHOⅡ級患者生存期高于WHOⅢ-Ⅳ級患者,WHOⅢ級患者生存期與 WHOⅣ級患者無統計學差異;再發于幕上患者生存期與幕下患者無統計學差異,見圖2。12例(42.9%)患者術后積極接受放化療、靶向治療等輔助治療,16例(57.1%)患者因腫瘤惡性的程度極高選擇放棄輔助治療。

圖2 28例患者術后生存曲線
表4 術前術后KPS 評分[(),分]Tab.4 KPS score before and after surgery [(),points]

表4 術前術后KPS 評分[(),分]Tab.4 KPS score before and after surgery [(),points]
3 討論
在顱內原發腫瘤中,腦膠質瘤約占60%左右[5]。其表現為浸潤生長,低級別膠質瘤經手術治療聯合放化療的標準模式治療后可獲得較長的無進展生存期和生存期[6],高級別膠質瘤與正常組織的邊界模糊,惡性程度極高且侵襲性很強,經過標準模式治療(手術治療聯合放化療)手但預后效果仍然不理想,膠質母細胞瘤患者的的中位生存期僅有14~16 月[7]。相關研究顯示,復發腦膠質瘤的瘤周水腫區觀察到膠質瘤細胞,為術后復發危險因素,故膠質瘤術后復發是一種必然結果[8]。雖經積極治療,但腦膠質瘤終會復發,致使其中位生存期不佳[9]。
腦膠質瘤術后復發是腦膠質瘤行手術切除術后,不論是否合并綜合輔助治療,在術區和(或)術區以外出現的單發、多發膠質瘤。為了使患者獲得最佳的預后和更長的生存期,復發腫瘤的治療是必不可少的。對于復發的膠質瘤的最佳治療方案仍存在爭議,但手術仍然是解決急性并發癥和減小腫瘤占位效應所必要的治療手段[10]。多個研究結果表明,再次手術治療可以延長腦膠質瘤復發患者的生存期[11]。本研究28例患者復發后均進行再手術治療,術后癥狀改善率高達85.7%。復發的膠質瘤往往呈侵襲性生長,完整切除腫瘤還是保留重要腦區功能均要被考慮[12]。復發腦膠質瘤行外科手術時,不能只關注是否能全切,而是應該考慮在對腫瘤進行最大限度切除的基礎上盡量對患者的神經功能進行保護,以提升患者的生活質量、使患者的生存期得到延長。本研究中的腦干膠質瘤術后復發的2例患者出現了繼發的梗阻性腦積水,對患者病情進行綜合評估后,行腦室腹腔分流術以緩解腦積水、使顱內高壓有所降低,可以使預后情況得到相應的改善。另外,有研究表明再手術對于復發腦膠質瘤患者的無進展生存期延長、相關癥狀改善有一定的作用[13]。綜合目前相關研究文獻報告結合本研究,筆者認為以下復發腦膠質瘤患者可以從手術治療中獲益。(1)手術顱骨窗外凸、顱內壓增高、存在明顯的神經系體征、腫瘤復發占位效應明顯、中線結構受壓移位;(2)患者出現癲癇(藥物難以控制);(3)腦積水(腦室系統受壓出現致命性);(4)高級別膠質瘤且對其他輔助治療效果不敏感或治療后出現急性并發癥;(5)再手術前KPS 評分≥60 分;定位腫瘤邊界的術中超聲、MRI 超聲影像融合技術;定位功能區的術中的電生理監測技術;適當的運用神經內鏡技術對顯微鏡視野盲區進行了一定程度的彌補;術中喚醒技術的應用等多模態、多技術的聯合應用[14-15],能夠為復發膠質瘤的手術治療提供更為直觀的證據,從而在最大程度切除腫瘤的基礎上盡量對患者神經功能進行保護,從而使患者的生活質量得到提高、患者生存期得到延長。本研究28例復發膠質瘤患者中,21例患者應用了術中超聲、術中超聲MRI 影像融合技術切除腫瘤,2例患者應用神經內鏡技術聯合顯微外科切除,應用術中喚醒清醒狀態下功能區腫瘤切除術的患者2例,在術中使用電生理監測的患者26例。經上述多模態、多技術的聯合應用,患者術后癥狀改善率85.7%,相較于文獻報道的未再手術治療患者改善率28%更高[16]。
隨著現代神經外科學的進步與發展,除手術治療之外的眾多輔助治療手段被用于復發腦膠質瘤的治療,例如放化療;靶向、電場、免疫治療等。多學科協作治療復發膠質瘤治療逐步成為了一種新的模式,二次放射治療,特別是立體定向放射治療,因為其精度高、副作用少、有效改善靶體積偏移、提高復發膠質瘤患者生存期等優勢而發展成為復發膠質瘤的有效治療手段被廣泛應用[17-18]。腦膠質瘤患者使用替莫唑胺時,MGMT(O6-甲基鳥嘌呤DNA 甲基轉移酶)的高甲基化可以使其效果有顯著提高,從而延長生存期[19]。有研究表明,膠質瘤再復發患者使用聯合化學治療后,中位生存期可提升26%;靶向治療時,使用貝伐單抗聯合替莫唑胺,可以提升復發性腦膠質瘤患者的治療效果,進而提高了生活質量[20];較單純化療組,電場治療聯合化療組的中位生存期明顯更長且毒性更低、更安全[21]。Cloughesy 等[22]的研究結果顯示,程序性細胞死亡蛋白1 阻滯劑對膠質母細胞瘤復發患者的中位生存期與無進展生存期有延長效果。
綜上所述,復發性腦膠質瘤治療時,首選方式是手術為主,同時輔助綜合治療法(放化療,靶向、電場、免疫治療等)。術中的超聲、MRI 超聲影像融合、神經內鏡、電生理監測、及術中喚醒等技術聯合應用的顯微外科手術是復發腦膠質瘤的相對微創且有效的治療方式,可有效提高患者的無進展生存期,可當做復發腦膠質瘤手術切除的選擇術式之一。本研究為回顧性分析,病例數量不多,隨訪時間相對較短,結果可能有一定偏倚,仍需要根據膠質瘤復發患者的不同情況,全面分析,綜合評估,制定適合不同個體的個性化診療方案。