多模態超聲在腦死亡器官捐獻移植肝術后監測中的應用
沈 燕,李永峰,肖春華,李 鴻,楊 薇,張升寧,呂燕瓊,楊皖東,丁世蘭
(昆明市第一人民醫院超聲科,云南 昆明 650224)
隨著肝移植手術技術日漸成熟,肝移植手術目前已成為治療各種終末期肝臟疾病的最佳手段,不僅可以延長患者的生存率,還可以明顯提高患者的生活質量[1]。肝臟作為DBD 的重要捐獻器官,在臨床救治中發揮了重要作用,雖然現代肝移植技術已取得較大進步,但努力提高肝移植術后的存活率仍然是影響肝移植深入發展的世界性難題,同時也嚴重制約了我國器官移植事業的發展[2]。肝移植術后并發癥是導致術后移植肝失功和受體死亡的主要原因,是影響肝移植存活的重大難題,特別是血管并發癥,其發生率高達25%,致死率約為37%,這會對患者身心健康及生命安全產生嚴重影響[3]。多模態超聲采用綜合技術作為移植肝術后監測的一種新方式,結合二維灰階超聲、CDFI、PW 和CEUS 對肝移植術后實現灰階、血流、微灌注等檢查,反映移植肝的形態結構、血流動力學及微灌注等信息,無創、便捷、實時、快速地綜合分析,本研究將多模態超聲對 DBD 肝移植術后并發癥的檢查結果與病理、其他影像學檢查、實驗室檢查或臨床手術治療進行對照,分析多模態超聲的診斷準確性,探討多模態超聲在DBD 肝移植術后監測中的應用價值。
1 資料與方法
1.1 臨床資料
選取2018 年1 月至 2021 年12 月在昆明市第一人民醫院進行DBD 肝移植術的移植肝患者57例,其中原位肝移植53例,肝腎聯合移植1例,原位肝移植合并肝左葉切除術(減體積)3例。男性44例,女性13例,年齡4~72 歲,平均46 歲。受體肝臟術前原發疾病為:肝惡性腫瘤18例,慢性乙型肝炎肝硬化16例,丙型肝炎肝硬化5例,酒精性肝硬化5例,膽汁性肝硬化2例,急性肝功能衰竭2例,自身免疫性肝病肝硬化2例,門靜脈海綿竇樣變性1例,慢性肝衰竭1例,肝豆狀核變性3例,藥物性肝硬化1例,進行性家族性肝內膽汁淤積癥1例。
1.2 儀器與方法
1.2.1 儀器采用Philips EPIQ5、東芝 Aplio500、日立Noblus 等超聲診斷儀,腹部凸陣探頭頻率為2-5 MHz。
1.2.2 研究方法將二維超聲、CDFI、頻譜多普勒定義為常規超聲。應用常規超聲監測移植肝,術后1 d 內進行首次超聲檢查,術后1 周內每天1 次,1 周后隔天1 次,2 周后每周1~2 次直至3 個月,遇異常情況可以適當增減檢查頻率。移植術后常規檢查內容包括:(1)二維超聲觀察移植肝形態大小、實質回聲及血管情況,肝內外膽管有無狹窄及擴張,移植肝周圍、胸腔及腹腔有無異常回;(2)CDFI 及PW 觀察血流通暢情況和頻譜形態,并測量血流參數。對常規超聲檢查懷疑有移植肝血管并發癥者(如血管顯示困難、血流充盈差、可疑狹窄或血栓)、移植肝內或肝周出現不能確定的異常病變進一步行CEUS 檢查。CEUS 采用東芝 Aplio500、Philips EPIQ5 超聲診斷儀,頻率為2~5 MHz,造影劑為聲諾維(Sono Vue)微泡,經左肘正中靜脈團注,每次注射2.4 mL,應用二維超聲檢查定位疑似異常區域,探頭保持不動,注入造影劑后即刻啟動計時功能,計時1 min,必要時重復注射1 次,并將全過程用實時動態存儲錄像,觀察移植肝異常血管及病變的增強模式、增強水平、增強形態、增強均勻性、增強后邊界及退出模式,直至造影劑完全排出。所有超聲檢查均由1 位具備5 a 以上工作經驗的超聲科醫師完成。多模態超聲提示并發癥后均進行了進一步影像學檢查如CT、MR、DSA(血管造影)或肝穿活檢以明確診斷。
2 結果
2.1 肝移植術后并發癥
本研究對57例DBD 移植肝術后行超聲監測,經超聲診斷各種術后并發癥的發生率見表1。本研究對15例患者行CEUS 檢查,其原因及造影特征見表2,其中6例常規超聲診斷可疑移植肝血管并發癥,經超聲造影最后確診,9例移植肝血管顯示困難,經超聲造影顯示清楚。本研究超聲漏診肝動脈假性動脈瘤1例。

表1 超聲監測肝移植術后各種并發癥的發生率(%)Tab.1 The incidence of complications after liver transplantation was monitored by ultrasound(%)

表2 超聲造影病例的原因和造影特征Tab.2 Causes and features of cases with contrast-enhanced ultrasound
2.2 門靜脈及腔靜脈系統并發癥
2.2.1 肝動脈并發癥肝動脈狹窄2例,1例常規超聲檢查肝門區未見肝動脈顯示,行CEUS 檢查肝門區肝動脈顯影,內徑纖細、間斷顯示,呈“串珠樣”,肝實質呈不均勻低增強,提示肝動脈狹窄,經DSA 證實。另1例常規超聲顯示移植肝動脈局部狹窄,狹窄處呈湍流,狹窄處血流峰值流速、RI(阻力指數)增高;CEUS:移植肝動脈吻合口狹窄,經腹部血管三維重建證實(圖1a~d)。
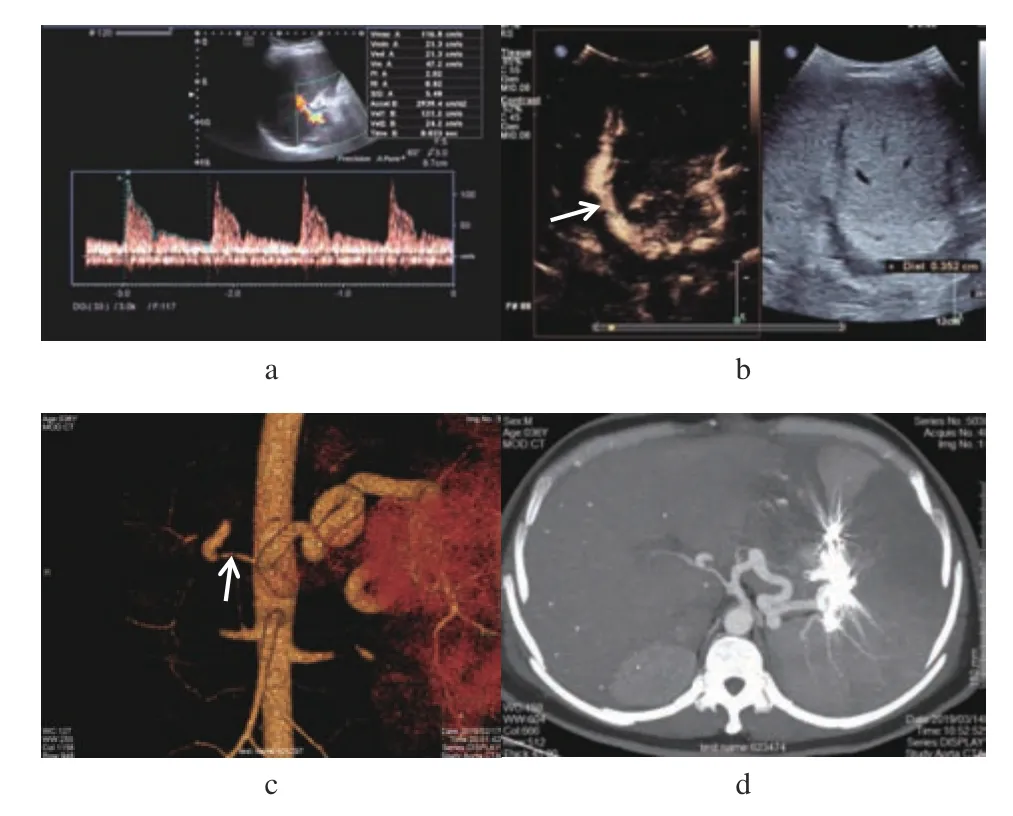
圖1 肝動脈狹窄Fig.1 Hepatic artery stenosis
2.2.2 門靜脈及腔靜脈系統并發癥(1)門靜脈血栓2例:常規超聲表現為管腔內附壁低回聲或稍低回聲,血流繞行,懷疑附壁血栓形成,CEUS顯示血栓處造影劑充盈缺損,進一步證實附壁血栓形成;(2)下腔靜脈血栓1例:術后常規超聲發現下腔靜脈內實性附壁稍低回聲,考慮附壁血栓形成,CDFI 表現管腔內局部血流信號充盈缺損;CEUS 顯示移植肝后段下腔靜脈管腔內見造影劑灌注缺損區,提示附壁血栓形成;CT 三維重建顯示:下腔靜脈管腔內見局部充盈缺損,考慮附壁血栓形成(圖2a~d);(3)下腔靜脈狹窄2例:二維超聲均表現移植肝后段下腔靜脈見局部狹窄,CDFI 表現狹窄處血流信號變細;CEUS 提示下腔靜脈吻合口處狹窄,經CT 掃描三維重建證實(圖3a~d)。

圖2 下腔靜脈血栓Fig.2 Inferior vena cava thrombosis

圖3 下腔靜脈狹窄Fig.3 Inferior vena cava stenosis
2.2.3 膽道并發癥(1)膽道狹窄3例:1例術后3a 超聲提示:膽總管吻合口狹窄并肝內外膽管擴張(圖4a~d),患者谷氨酰氨轉移酶明顯高于正常,MRCP(磁共振胰膽管造影):膽總管吻合口狹窄,匯管區膽管擴張,肝內膽管擴張。1例術后第20 日超聲提示:肝內膽管輕度擴張,肝門區膽總管顯示欠清,壁明顯增厚,內徑變窄。患者膽紅素繼續升高,行“ERCP+膽道支架置入”術,造影顯示:膽道吻合口狹窄,給放入膽道支架。另1例術后兩月常規超聲示:肝門部膽總管呈梭狀擴張,下段狹窄,肝內膽管輕度擴張;患者經膽道成形、T 管引流術手術治療,術后T 管造影示:膽總管中段狹窄;(2)膽汁瘤1例:術后3 月余常規超聲示肝右葉散在分布的不規則片狀無回聲區,大小不一,邊界欠清,其內透聲稍差,較大位于右前葉近包膜下,CDFI:無回聲區內無血流信號。CEUS 表現為無回聲區內三期均無增強,考慮膽汁瘤,行超聲引導下肝右前葉液性包塊穿刺引流術,證實為膽汁瘤。

圖4 膽總管吻合口狹窄Fig.4 Common bile duct anastomotic stenosis
2.2.4 肝膿腫形成1例術后3 月,患者發熱,有菌血癥,多模態超聲表現:常規超聲提示肝內多發不均質稍低回聲結構,邊界尚清,內部回聲不均,CDFI:病灶周邊及內部無明顯血流信號,考慮肝膿腫,超聲引導下肝右前葉液性包塊穿刺引流術,抽出膿液,術后超聲檢查治療有效(圖5)。

圖5 肝膿腫Fig.5 Liver abscess
2.2.5 一般常見并發癥本組病例中57例術后均出現胸腹腔積液,31例有血腫形成,其中肝內血腫2例,肝周血腫29例。
2.2.6 罕見并發癥超聲漏診肝動脈假性動脈瘤1例:術后常規超聲監測未檢出肝動脈假性動脈瘤,術后第38 天患者突然出現血壓下降、腹痛、心悸、氣難喘,急診床旁B 超示:腹腔大量積血,立即行剖腹探查+肝動脈瘤破裂修補術,術中診斷為肝動脈瘤破裂出血。
3 討論
超聲檢查是DBD 肝移植術后的常規檢查及監測方法,多模態超聲可觀察移植肝的形態大小、內部回聲、膽管吻合情況、肝內及肝周有無異常,胸腔及腹腔有無積液,觀察血管吻合情況及管腔內有無異常回聲,觀察血流充盈情況和頻譜形態并測量血流參數,聯合應用多模態超聲,可大大提高診斷肝移植術后并發癥特別是血管并發癥的準確性[4]。
肝移植術后血管并發癥中有4%~5%為肝動脈狹窄,基本發生在吻合口[5],本研究認為當常規超聲檢查肝動脈顯示困難或可疑狹窄時,可經超聲造影進一步檢查,超聲造影可較準確的評價血管的通暢性,判斷血管的狹窄部位,同時還能觀察肝實質的灌注情況。超聲造影可直接顯示門靜脈或下腔靜脈狹窄處管腔變細,有研究報道在少數情況下,有如門靜脈或下腔靜脈吻合口顯示不清時,而CDFI 顯示有高速湍流或渦流懷疑狹窄時,即可行超聲造影協助診斷[6]。超聲造影可避免彩色多普勒超聲的不足,有利于準確判斷門靜脈及下腔靜脈栓塞及其程度,鑒別癌栓和血栓,超聲造影還可判斷血管是否完全栓塞,建議彩色多普勒超聲診斷不明確時,應盡可能采用超聲造影進行診斷。雖然膽道狹窄最終需經皮肝穿膽道造影或逆行胰膽管造影明確診斷,本研究認為通過超聲監測移植肝的膽道,能較早且較容易發現膽管的局部狹窄及擴張,超聲檢查可作為膽管狹窄的初篩方法,還能較容易發現膽管結石或膽泥形成。有相關文獻報道,超聲造影可觀察膽管壁動脈期的灌注情況,從而了解膽管壁的血供情況[7]。當膽汁從肝膽管腔滲出到肝實質內形成包裹性膽汁淤積時,在肝臟的超聲、CT 等影像上表現為囊性腫瘤樣結構,可稱之為膽汁瘤(Biloma),手術后創面滲膽是手術后膽汁瘤的基本成因[8]。超聲上有時可見無回聲區與擴張的末梢膽管相連通,合并感染時,無回聲內可見點狀或絮狀弱回聲[9],本研究結果與其一至。另外,相關報道還認為膽汁瘤需要與肝膿腫、腫瘤復發灶、梗死灶等鑒別,一般膽汁瘤無“經時變化”的特點,即連續觀察其大小及內部回聲無明顯變化[10],必要時需超聲引導穿刺確診并抽吸治療。有關研究報道感染是DBD 肝移植術后常見的并發癥和致死的主要原因之一,常繼發于膽道并發癥后,多數由細菌引起,少數是真菌性的,腹腔的任何部位均可發生[11],當感染出現肝內外膿腫時,超聲對其診斷及治療均有幫助,超聲造影可提高診斷準確性,表現為動脈期膿腫周邊高增強,內部為無增強或低增強,門脈期及延遲期或增強晚期膿腫周邊增強消退,內部為無增強。
一般常見并發癥:胸腹腔積液,多發生在術后1 周內,超聲可動態監測術后胸腔積液的量,量多時可在超聲定位下行胸腔穿刺引流術;超聲還可根據積液的透聲判斷有無合并感染,如伴有感染時,液性暗區內透聲差,可見絮點狀回聲,當出現大量腹水時,應警惕肝靜脈流出道梗阻,急性腹腔內出血等情況。在血管、膽管周圍的血腫,可對管道造成壓迫,如其壓迫導致血管腔嚴重狹窄,可經手術清除血腫來解除其對血管的壓迫。
本研究超聲檢查漏診肝動脈假性動脈瘤1例,有研究報道肝移植術后,肝動脈假性動脈瘤十分罕見,未破裂的假性動脈瘤常無臨床表現,不易發現,目前確診的方法為動脈造影[12],常規超聲在術后常規檢查中則可作為篩選方法,但較小較深的動脈瘤容易漏診,所以DBD 肝移植術后當患者突然出現血壓下降,腹腔內積液量短期內增多時,應考慮到有肝動脈假性動脈瘤破裂出血的可能。
常規超聲在監測移植肝時,其基礎作用有著不可忽略的臨床價值,CEUS 應用到血管的灌注,能夠從不同側面提供更多的診斷信息,提高常規超聲診斷的準確性,輔以CEUS 可顯著提高移植肝術后血供異常的診斷效率,但其圖像質量也受限于患者自身條件的干擾,如肥胖、腸氣、腹水等,復雜的側枝小血管重疊、畸形等空間位置關系難以準確判斷,金屬支架會產生嚴重的反射回聲干擾,均會使CEUS 確診存在局限性。聯合應用多模態超聲檢查可實時、動態全程監測腦死亡器官捐獻移植肝患者,具有價格低廉、方便快捷、無創無放射、可重復等優點,清晰、直觀的顯示異常部位、性質及程度,聯合診斷、綜合分析,大大增強診斷信心,為移植肝術后異常的診斷和鑒別診斷提供線索,為臨床做到早診斷、早預防、早治療提供重要的依據,多模態超聲可作為腦死亡器官捐獻移植肝術后連續監測的一種更敏感、更有效的影像學檢查方法,能顯著提高并發癥的診斷率,延長患者術后生存時間,具有廣闊的應用前景和臨床價值。