溶質載體超家族50蛋白在乳腺癌中的表達及其臨床意義
張海智,溫曉芬,黃彬亮,林 慧,薛文武,曾 德,林丹霞,*
(1.高州市人民醫院腫瘤內科一區,廣東 茂名 525000;2.汕頭大學醫學院附屬腫瘤醫院腫瘤內科,廣東 汕頭515041)
乳腺癌是影響女性健康最常見的惡性腫瘤,2020年全球有約226萬新增確診女性乳腺癌患者,發病人數超越肺癌成為第一,它是癌癥死亡的主要原因之一[1]。在我國,乳腺癌發病率也處于女性惡性腫瘤的第1位,且近年來迅速上升[2-3]。目前乳腺癌的預后監測方式與治療靶點仍較局限,臨床上廣泛應用的有CA153、CEA、CA125等腫瘤標志物,這些腫瘤標志物在乳腺癌患者中的預后價值較為肯定,但其敏感性與特異性仍有爭議[4-5]。有研究分析了癌癥基因組圖譜(The Cancer Genome Atlas,TCGA)數據庫中730例乳腺癌組織和82例癌旁組織的數據,通過建立癌癥基因組學數據的概率整合(Probabilistic Integration of Cancer Genomics Data,PINCAGE)模型分析,發現溶質載體超家族50蛋白成員1(solute carrier family 50 member 1,SLC50A1)基因在乳腺癌組織與癌旁正常組織中的表達水平具有顯著差異[6]。后來Wang等[7]對血液SLC50A1蛋白濃度的研究發現,乳腺癌患者的血清中SLC50A1蛋白含量明顯升高,SLC50A1水平升高的特異性為100%,敏感性為75.3%,ROC曲線下面積為0.915(P<0.01)。為進一步了解SLC50A1在早期及晚期乳腺癌患者中的預后價值,本研究通過動態檢測早期和晚期乳腺癌患者的SLC50A1水平,為SLC50A1蛋白在乳腺癌的預后監測、療效評估以及治療等方面的應用作初步探索。
1 材料與方法
1.1 研究對象
選取2019年6月8日—2020年3月18日汕頭大學醫學院附屬腫瘤醫院新收治的病理確診為乳腺癌的患者39例;其中26例為晚期乳腺癌,13例為早期乳腺癌,記錄患者臨床信息,對周期性返院行抗腫瘤治療的晚期乳腺癌患者進行動態記錄及電話隨訪,隨訪時間截止至2021年4月1日,隨訪結果:死亡5例(12.8%),存 活34例(87.2%),復 發 或 進 展25例(64.1%),隨訪率100%。入組的乳腺癌患者均為浸潤性導管癌,其中早期乳腺癌患者均通過手術切除腫瘤病理確診;入組標準主要包括留取血漿樣本期間患者無感染征象、無合并其他原發惡性腫瘤、預計生存期大于3個月的患者。本研究入組的39例乳腺癌患者臨床特征數據見表1。
1.2 研究方法
經本院倫理委員會審批及患者知情同意,收集患者治療前空腹時的外周靜脈血10 mL,棄去前1 mL,標本存于EDTA管中,使用離心機600 g離心5 min,取上清液分裝置于-80℃保存備用。使用酶聯免疫吸附法(enzyme-linked immunosorbent assay,ELISA)對患者血漿SLC50A1蛋白進行定量測定,ELISA試劑盒購自Andy Gene Biotechnology公司,該試劑盒應用雙抗體夾心法測定SLC50A1水平,用純化的人SLC50A1抗體包被微孔板,制成固相抗體,往包被單抗的微孔中依次加入血漿樣本,每個樣本作復孔3個,形成抗體-抗原-酶標抗體復合物,經過徹底洗滌后加入底物顯色。用酶標儀在450 nm波長下測定吸光度,通過標準曲線計算血漿中SLC50A1含量。本試驗測定過程遵循試劑盒說明書操作步驟要求,記錄測定結果用于后續統計學分析。
從基因組數據共享(genomic data commons,GDC)官網下載TCGA數據庫截至2021年4月25日更新的1 109例浸潤性乳腺癌和113例癌旁組織的mRNA數據,使用Activeperl 5.26軟件進行識別并轉換成矩陣數據,R3.6.2軟件提取其中SLC50A1基因表達數據后,采用Wilcoxon秩和檢驗進行差異分析。
1.3 統計學分析
使用SPSS 26.0軟件對入組患者的臨床數據進行統計學分析,采用非參數檢驗中的Mann-WhitneyU檢驗及配對樣本的Wilcoxon符號秩檢驗對SLC50A1濃度進行不同分組間的差異性分析。采用線性相關分析SLC50A1水平與CA153、CEA水平的相關性后,進一步使用Kendall’s tau-b作相關性分析。預后分析主要采用無病生存期(disease free survival,DFS)時間繪制Kaplan-Meier曲線,并參考各單因素的log-rank檢驗結果與P值,篩選有統計學意義的變量進行多因素Cox回歸比例風險模型分析。P<0.05為差異有統計學意義。
2 結果
2.1 乳腺癌患者血漿中SLC50A1蛋白水平的差異
經正態性檢驗,本研究入組患者的SLC50A1濃度水平不服從正態分布,根據患者的臨床特征分組,使用Mann-WhitneyU檢驗作差異性分析,結果如表1所示,SLC50A1蛋白水平在乳腺癌雌激素(ER)高表達(≥10%)與低表達(<10%)、早期(M0)與晚期組(M1)、Ki67高表達(≥15%)與低表達組(<15%)間的差異有統計學意義(P<0.05),其中早期乳腺癌患者,ER高表達患者和Ki67低表達患者的SLC50A1水平較低,預后較好。SLC50A1濃度在不同年齡組、孕激素(PR)高表達與低表達組、不同腫瘤家族史組、不同母乳喂養時長組、人表皮生長因子受體2(Her-2)陽性與陰性組間的差異均無統計學意義(P>0.05)。
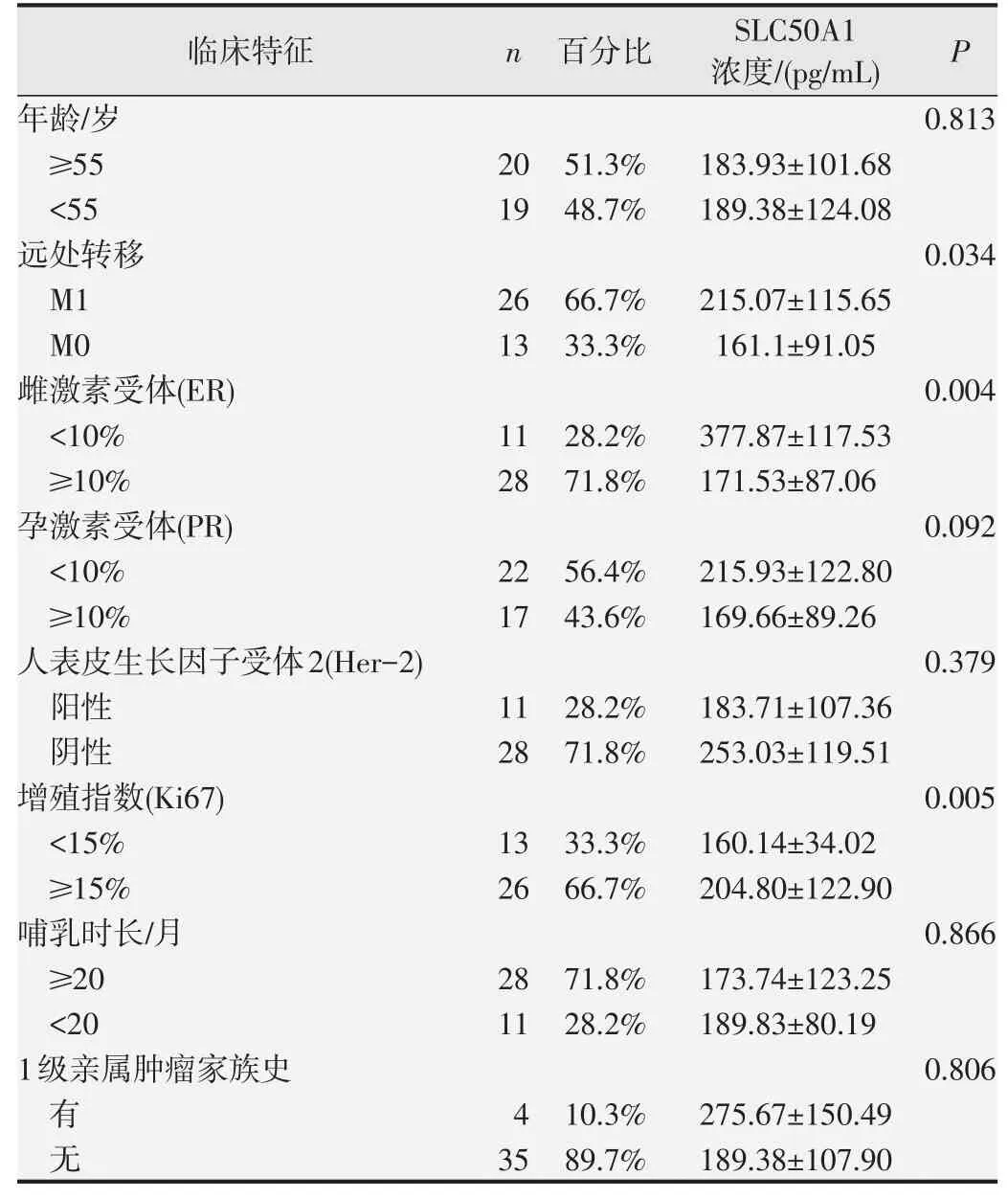
表1 不同臨床特征組的乳腺癌患者血漿中的SLC50A1蛋白水平
使用Recist 1.1實體瘤療效評估標準對晚期乳腺癌患者隨診期間(25人次,有患者未返院隨訪)的血漿SLC50A1蛋白濃度進行分組,復診期間療效評估結果符合疾病穩定(stable disease,SD)組共17人次、符合疾病進展(progressive disesse,PD)組共6人次、符合部分緩解(partial response,PR)組2人次,因僅有2人次療效評估符合PR標準,故僅分析了SD組及PD組情況。采用配對樣本的Wilcoxon符號秩檢驗對不同組治療前、后的SLC50A1蛋白水平進行差異性分析。結果提示,SD組治療前及治療后的SLC50A1水平中位數分別為253.04和275.07 pg/mL,差值的中位數為21.42 pg/mL,Wilcoxon符號秩檢驗顯示,Z=-1.491,P=0.136,說明晚期乳腺癌患者抗腫瘤治療后的療效評估為SD時,SLC50A1水平變化不明顯(圖1A)。PD組治療前及治療后的SLC50A1水平中位數分別為220.29和267.11 pg/mL,差 值 的 中 位 數 為10.83 pg/mL,Wilcoxon符號秩檢驗顯示,Z=-1.153,P=0.249,說明晚期乳腺癌患者抗腫瘤治療后的療效評估為PD時,SLC50A1水平變化差異無統計學意義(圖1B)。

圖1 晚期乳腺癌患者疾病穩定組和疾病進展組治療前后SLC50A1水平變化
2.2 SLC50A1水平與腫瘤標志物的相關性分析
首先對相關分析的配對指標(SLC50A1與CA153、SLC50A1與CEA、SLC50A1與CA125)進行雙變量正態分布檢驗,結果提示均不符合雙變量正態分布;通過繪制散點圖發現SLC50A1水平與CA153、CA125、CEA水平無顯著單調線性相關關系,使用Kendall’s tau-b相關分析對上述配對的指標進行分析,結果如表2所示,在上述相關性分析的因素中,SLC50A1水平與CA153濃度存在較弱的正相關關系。
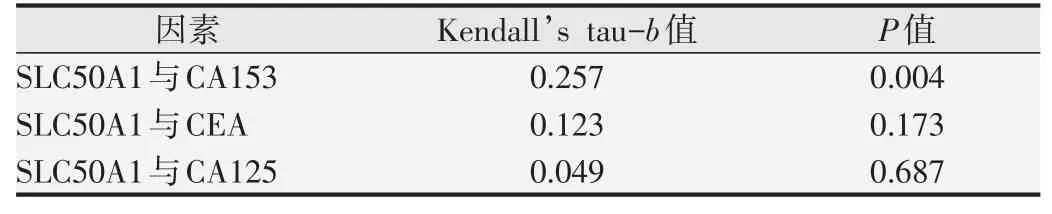
表2 SLC50A1水平與CA153、CEA、CA125的相關性分析
2.3 影響乳腺癌預后的多因素Cox回歸分析
使用患者的一般臨床特征(包括SLC50A1水平、年齡、腫瘤分期、ER、PR、Her-2、Ki67、哺乳史)繪制Kaplan-Meier曲線并進行log-rank檢驗,篩選出單因素分析有統計學意義的變量為SLC50A1水平、Ki67(P<0.05),對這兩個變量進一步作多因素Cox回歸分析,結果顯示,SLC50A1水平、Ki67指標是影響乳腺癌預后的獨立因素(P<0.05),與血漿SLC50A1水平升高組相比,低SLC50A1水平組的術后復發或進展的風險 降 低[HR=0.385,95%CI(0.163,0.912),P=0.03];與免疫組化結果的Ki67低表達組(Ki67<15%)相比,高Ki67表達組的術后復發或進展的風險升高[HR=2.918,95%CI(1.023,8.324),P=0.045],提示Ki67預后預測價值與SLC50A1一致。
2.4 TCGA數據庫的SLC50A1表達數據分析
為了解大樣本數據關于SLC50A1表達的情況,對相關數據庫收錄的乳腺癌數據下載并分析。因目前尚無公開的血漿SLC50A1蛋白濃度的數據庫信息,選擇TCGA數據庫(https://portal.gdc.cancer.gov/)中的mRNA數據分析作參考。從TCGA數據庫(https://portal.gdc.cancer.gov/)下載截至2021年4月25日更新的1 109例浸潤性乳腺癌和113例癌旁組織的SLC50A1基因表達量數據,采用Wilcoxon秩和檢驗作差異性分析結果如圖2所示,乳腺癌組織中SLC50A1表達量較癌旁正常組織明顯升高,差異有統計學意義(P<0.01)。

圖2 癌旁正常組織與乳腺癌組織SLC50A1表達的差異分析
3 討論
乳腺癌已成為女性最常見的惡性腫瘤,且發病率仍在不斷上升,對女性健康威脅極大[8],目前臨床上用于乳腺癌隨訪的檢查仍以影像學檢查為主,相對而言通過血液中的腫瘤標志物檢測隨訪與指導治療具有更高的可及性。乳腺癌的腫瘤標志物主要包括CA153、CA125、CEA,它們主要用于晚期乳腺癌的預后判斷[9]。癌細胞的活動與增殖離不開糖的轉運與代謝,有薈萃分析認為乳腺癌的預后與糖代謝異常密切相關[10],糖的轉運代謝有賴于細胞膜上的糖轉運蛋白來實現[11]。
隨著糖跨膜轉運蛋白研究的不斷深入,Chen等[12]利用HEK293T細胞的胞內傳感器識別了在人類細胞中具有7個跨膜螺旋結構的同系物,命名為SLC50A1,又稱SWEET1、RAG1AP1,他們的研究認為SLC50A1蛋白在人卵母細胞中主要參與調控糖的外排,這種單向的對胞外進行糖轉運,是目前已知的人SLC50A1蛋白的主要功能。還有學者研究認為SLC50A1蛋白能參與特異性免疫中V(D)J重排的激活,這一激活過程涉及RAG1的特異性免疫信號傳導[13],提示它與臨床上乳腺癌的免疫治療可能存在相關性。SLC50A1蛋白在糖轉運功能上跟其他糖轉運體相互配合[14],但目前關于該蛋白的作用機制尚未明確。Wang等[7]研究認為,在正常人的血清中也可檢測到SLC50A1的表達,但乳腺癌患者的血清中SLC50A1蛋白的含量明顯升高,若ROC曲線特異性為100%時,敏感性為75.3%,ROC曲線下面積達0.915(P<0.01)。該研究的樣本量不大,為繼續摸索血液中SLC50A1蛋白的預后價值,我們留取了潮汕地區乳腺癌患者不同疾病狀態的血漿樣本,通過檢測發現晚期乳腺癌患者的SLC50A1蛋白濃度為(215.07±115.65)pg/mL,早期乳腺癌患者為(161.1±91.05)pg/mL,差異具有統計學意義(P<0.05)。且SLC50A1水平在ER、Ki67表達不同的分組中也具有統計學差異,反映出SLC50A1水平與ER之間存在關聯性,這些結果與Wang等[7]的研究結果具有一致性。不同的是,我們的研究側重于探索SLC50A1的預后價值,通過動態隨訪、監測同一患者不同治療反應狀態下的SLC50A1濃度來研究它與臨床指標的關聯。對于SLC50A1蛋白的檢測研究目前還處于探索階段,選擇血清與血漿尚無定論,早期的研究報道認為,血漿與血清相比,血漿檢測更能代表患者的疾病狀態[15]。為避免SLC50A1蛋白在血液的凝血過程中發生的相關反應干擾檢測結果[16],故我們留取患者血漿進行檢測。通過對入組患者動態復查的CA153、CA125、CEA水平與相應時期SLC50A1水平進行相關性分析,結果表明SLC50A1水平與CA153濃度存在一定的正相關關系(Kendall’s tau-b=0.257,P=0.004)。將入組的晚期乳腺癌患者血漿SLC50A1水平根據每次返院治療期間的療效評估結果進行分組,由于樣本量不大,晚期乳腺癌治療后療效評估為PR組的僅2人次,我們將SD組、PD組的數據進行治療前后的差異性分析。結果顯示,晚期乳腺癌患者抗腫瘤治療后的療效評估為SD時,SLC50A1水平變化無統計學差異,符合SLC50A1的預后價值,但治療后的療效評估為PD時,雖中位數提示治療后PD的乳腺癌患者SLC50A1水平升高,但差異仍無統計學意義,可能與樣本量少有關。Cox回歸分析結果顯示,SLC50A1水平是乳腺癌患者的獨立預后因素,與SLC50A1水平升高組相比,低SLC50A1水平組的術后復發或進展的風險降低。進一步表明SLC50A1水平可作為乳腺癌的預后判斷因素。我們的研究不足之處主要在于樣本量較少,且早期乳腺癌患者組僅收集了術后的血漿,有待后續的研究進一步完善。
另外,通過TCGA數據庫的大樣本數據分析表明,該基因在乳腺癌組織中的表達量明顯高于正常的癌旁組織(P<0.01),提示了以SLC50A1作為靶點的靶向治療對癌細胞可能具有更高的選擇性。目前也有研究發現SLC50A1基因與Abelson鼠白血病病毒致癌基因同源物1(ALB1)基因共突變的乳腺癌患者的總生存期相對延長,并認為這種突變類型的乳腺癌患者對博舒替尼的敏感性增高相關[17]。惡性腫瘤的生物標志物從研究到應用經歷了大量的研究試驗,這個過程中也有一部分生物標志物在藥物精準治療方面作出了重要貢獻,糖轉運體作為近年的研究熱點,為了限制癌細胞的糖酵解,已先后開發了很多以糖轉運體或代謝酶為作用靶點的靶向藥物[18-19],以SLC50A1作為治療靶點值得進一步探索。
綜上所述,本研究探索了SLC50A1表達水平在乳腺癌中的預后價值,初步分析認為SLC50A1是乳腺癌的獨立預后指標,SLC50A1表達水平升高提示乳腺癌患者的預后不良。雖然本研究的樣本量較少,通過下載TCGA數據庫的數據進行分析驗證,已初步表明了我們的研究結果與大樣本檢測結果的一致性。以SLC50A1為作用靶點的靶向藥物能否為乳腺癌患者帶來新的選擇,有待進一步的作用機制研究與臨床試驗探索。

