采用體內堿性彗星試驗檢測兩種聚醚醚酮材料的遺傳毒性
孫令驍,劉香東,劉增祥,王鸞鸞,朱福余,孫曉霞,劉成虎*
(山東省醫療器械和藥品包裝檢驗研究院,國家藥品監督管理局生物材料器械安全性評價重點實驗室,山東省醫療器械生物學評價重點實驗室,山東 濟南250101)
體內堿性彗星試驗是一項直接檢測核DNA損傷的敏感試驗方法,可以在強堿性條件下(pH≥13)檢測DNA單鏈和雙鏈的斷裂。由于體內堿性彗星試驗可以檢測單細胞水平的DNA損傷,因此具有很高的靈敏度,而且該方法所需的樣本量少、操作簡便,在食品、藥品和化學品的遺傳毒性檢測中均有廣泛的應用,2014年經濟合作與發展組織(Organization for Economic Co-operation and Development,OECD)發表了針對化學品進行體內堿性彗星試驗的指導原則,但是目前國內尚無針對醫療器械及其材料進行體內堿性彗星試驗的標準方法。
本研究結合醫療器械臨床使用的特性,采用0.9%氯化鈉注射液(0.9% sodium chloride injection,SC)和棉籽油(cottonseed oil,CSO)兩種介質制備聚醚醚酮(polyether ether ketone,PEEK)材料的極性和非極性試驗液,分別采用靜脈和腹腔注射對受試動物進行染毒,參考《OECD化學品測試指南489:體內堿性彗星試驗》對兩種PEEK材料試驗液的遺傳毒性進行初步評價,為醫療器械及其材料遺傳毒性體內堿性彗星試驗標準化的建立提供可靠的依據。
1 材料與方法
1.1 動物
SPF級健康SD大鼠70只,購自北京維通利華實驗動物技術有限公司,實驗動物生產許可證號:SCXK(京)2016-00060。大鼠10~13周齡,雌雄各半,在20~26℃,濕度40%~70%,控制循環燈光(12 h亮,12 h暗)的屏障環境[許可證號:SYXK(魯)20190013]下采用大鼠飼料[購自北京科澳協力飼料有限公司,許可證號:SCXK(京)2019-0003]按性別分籠群飼,每籠5只,自由飲水和攝食。
1.2 主要試劑和儀器
PEEK材料A(適用于加工齒科種植體等醫療器械,批號R202001),PEEK材料B(適用于加工椎間融合器等醫療器械,批號21060202);0.9%氯化鈉注射液(辰欣藥業股份有限公司);棉籽油(河北百靈威超精細材料有限公司);甲基磺酸甲酯(methyl methanesulfonate,MMS,Sigma);彗星試驗試劑盒(英國Abcam公司,型號ab238544);PBS(不含Ca2+、Mg2+和酚紅,Sigma);無水乙醇(分析純,國藥集團化學試劑有限公司);10%磷酸鹽緩沖中性福爾馬林固定液(濟南百博生物技術股份有限公司);Labtub真空采血管(0.109 mol/L檸檬酸鈉溶液,力因精準醫療產品有限公司)。
壓力蒸汽滅菌器(德國Systec公司,型號VE-75);電子天平(瑞士梅特勒-托利多公司,型號XPE105);水平電泳槽、電泳儀(美國Bio-Rad公司,型號Power Pac);倒置熒光顯微鏡(日本Olympus公司,型號IX73);離心機(德國Sigma公司,型號1-14);恒溫水浴鍋(常州國華電器有限公司,型號HH-1);制冰機(日本Sanyo公司,型號SIM-F140AY65)。
1.3 實驗方法
1.3.1 試驗液和對照溶液制備[1]參考GB/T 16886.12規定,基于0.2 g/mL的比例,將兩種PEEK材料分別置于SC和CSO中,于(121±2)℃浸提(1.0±0.1)h,取浸提液作為試驗液。陰性對照為不含試驗樣品的SC和CSO,同法制備。試驗液在制備后立即使用,以防止吸附在浸提容器上或成分發生其他變化。陽性對照為MMS,將MMS(1.3 g/mL)用SC稀釋至1 mg/mL,配制完成后在2 h內使用。
1.3.2 動物分組及處理將70只SD大鼠隨機分為7組,分別為:①SC陰性對照組;②CSO陰性對照組;③PEEK材料A生理鹽水試驗組(PEEK SCA試驗組);④PEEK材料A棉籽油試驗組(PEEK CSOA試驗組);⑤PEEK材料B生理鹽水試驗組(PEEK SCB試驗組);⑥PEEK材料B棉籽油試驗組(PEEK CSOB試驗組);⑦陽性對照MMS組,每組10只,雌雄各半。SC陰性對照組、PEEK SC試驗組和MMS組分別按照10 mL/kg的劑量由靜脈途徑染毒,CSO陰性對照組和PEEK CSO試驗組分別按照5 mL/kg的劑量由腹腔途徑染毒。第1次染毒24 h后進行第2次染毒,末次染毒3 h后取材。
動物一般觀察:分別在第1次染毒前一天、第1次染毒和第2次染毒后對所有動物稱體質量,并在染毒期間每天對所有動物進行兩次觀察,包括動物是否死亡、皮膚與被毛、眼與黏膜的改變,以及呼吸、循環、自主和中樞神經系統、軀體運動神經活動性和行為模式等狀況[2]。
1.3.3標本制備將動物處死后從腹主動脈采血1 mL,轉移入采血管內反轉振搖數次,迅速摘取大鼠肝臟和腎臟,稱取質量后分別剪下肝臟和腎臟的一小塊組織,每只動物剪下的組織塊大小應盡量一致,將剪下的組織塊放入提前預冷的PBS(不含Ca2+、Mg2+和酚紅)中充分清洗以清除殘留的血液。清洗干凈的肝臟和腎臟組織塊放入5 mL預冷的PBS中,使用眼科剪將組織塊盡量剪碎以釋放細胞,放置5 min后去掉組織碎片進行離心,離心后收集細胞。制備肝臟、腎臟和外周血的單細胞懸液,調整細胞濃度為1×105個/mL,將單細胞懸液置于冰上保存待用[3-4]。
另取一部分肝臟和腎臟組織置于固定液中用于組織病理學分析。
1.3.4 制片、裂解、解旋與電泳單細胞懸液制備后在低溫條件下1 h內完成制片。取潔凈載玻片,在磨砂面一側滴加75 μL瓊脂糖,常規涂片,在4℃環境下放置15 min凝固后備用。將單細胞懸液與瓊脂糖按1∶10(V/V)比例混勻,在制備好的瓊脂糖凝膠層上滴加75 μL細胞與瓊脂糖的混合液,在4℃環境下避光放置15 min,每個樣本制備3張玻片備用。
根據彗星試驗試劑盒的操作說明,將玻片浸沒于預冷的裂解液,在4℃環境下避光作用至少1 h后使用PBS漂洗玻片2次,每次2 min,除去殘留的洗滌劑和鹽類物質。漂洗后將玻片浸沒于預冷的電泳緩沖液(pH≥13),置于冰上避光解旋30 min,將玻片轉移到置于冰上的水平電泳槽中,緩緩加入預冷的新鮮配制的電泳緩沖液,采用電勢1 V/cm、啟動電流300 mA、電泳時間為20 min的電泳條件進行避光電泳。電泳結束后用預冷的純水漂洗玻片2次,每次2 min,將玻片放入預冷的70%乙醇中固定5 min,空氣中自然干燥。
1.3.5 染色、閱片與數據處理每張玻片加入試劑盒提供的DNA鏈熒光染料100 μL,室溫孵育15 min,在倒置熒光顯微鏡下用適當的放大倍數(100倍或200倍)觀察玻片。DNA結合熒光染料后受到激發產生綠色熒光,未受損的DNA電泳時無法遷移太遠從而留在細胞核中,而損傷的DNA片段會在電場作用下從細胞核中遷出形成可視的彗星尾形狀。在熒光顯微鏡下可以觀察到DNA片段從細胞的“彗頭”移到“彗尾”,“彗頭”為圓形光斑,邊緣整齊,“彗尾”呈散點狀拖尾。彗星顯微圖像中的細胞可分為3類,可評分細胞(細胞的“彗頭”、“彗尾”輪廓清晰,且未受鄰近細胞干擾)、不可評分細胞(細胞的“彗頭”、“彗尾”不清晰或重疊的細胞等)和“刺猬”狀細胞(顯微圖像下由小或不存在的頭部以及大的彌漫性尾部組成的細胞)[5]。選擇玻片中間位置且密度適中的區域進行閱片,確保細胞無重疊,避免在玻片的邊緣進行閱片。
采用OpenComet軟件分析細胞圖像[6],以尾部DNA百分比、尾矩和Olive尾矩作為分析指標衡量DNA的損傷程度,每個樣本對150個可評分細胞進行分析,計算每個樣本每張玻片可評分細胞尾部DNA百分比、尾矩和Olive尾矩中位數的平均數,得出每個樣本可評分細胞的尾部DNA百分比、尾矩和Olive尾矩,每個樣本計數150個細胞來單獨記錄“刺猬”狀細胞的發生頻率。計算每只大鼠肝臟和腎臟的質量與體質量之比作為肝臟系數和腎臟系數。
1.4 統計學方法
采用SPSS 17.0軟件進行統計分析,試驗結果用xˉ±s表示,對每個樣本可評分細胞的尾部DNA百分比、尾矩、Olive尾矩和“刺猬”狀細胞發生頻率進行獨立樣本t檢驗,如果P<0.05則認為兩組之間差異有統計學意義。
2 結果
2.1 PEEK的全身毒性
2.1.1 大鼠的臨床觀察和體質量變化在研究過程中,各試驗組和對照組的大鼠均未見死亡和明顯的異常癥狀,所有動物體質量均有增加。各試驗組、陽性對照組大鼠的平均體質量分別和SC、CSO陰性對照組相比差異均無統計學意義(P>0.05)。
2.1.2 大鼠肝臟系數、腎臟系數和病理學檢查各試驗組和陽性對照組的大鼠肝臟系數、腎臟系數與SC和CSO陰性對照組相比差異均無統計學意義(P>0.05),結果見表1。所有大鼠的肝臟和腎臟均未見肉眼可見的大體病理學改變,組織病理學檢查發現各組大鼠的肝細胞形態結構正常,未見肝細胞腫脹,肝細胞間界線清晰,肝細胞核未見固縮、溶解、消失,未見肝細胞變性壞死,肝鎖排列整齊呈條索狀,間質未見炎性細胞浸潤,未見肝血竇擴張,肝被膜未見增厚,各組大鼠的腎小球形態結構正常,系膜細胞未見增生,未見基底膜增厚,腎小管上皮細胞未見變性、壞死,腎小管未見擴張,管腔內未見蛋白管型等病變,間質未見炎性細胞浸潤和纖維組織增生,腎臟被膜未見增厚,各組大鼠的肝臟和腎臟未見明顯的組織病理學改變,結果見圖1和圖2。
表1 連續染毒2 d后各組大鼠肝臟系數和腎臟系數(%,±s,n=5)

表1 連續染毒2 d后各組大鼠肝臟系數和腎臟系數(%,±s,n=5)
?

圖1 各組大鼠肝臟組織病理檢查結果(HE染色)
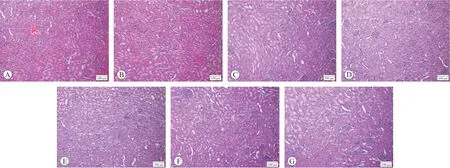
圖2 各組大鼠腎臟組織病理檢查結果(HE染色)
2.2 體內堿性彗星試驗結果
2.2.1 彗星顯微圖像觀察結果圖3~圖5是大鼠肝細胞、腎細胞和外周血淋巴細胞的彗星顯微圖像,分別從SC陰性對照組、PEEK SCA試驗組、PEEK SCB試驗組和MMS陽性對照組的肝細胞、腎細胞和外周血淋巴細胞中各選擇一張圖片進行比較。與SC陰性對照組相比,MMS陽性對照組細胞出現明顯的拖尾現象,表明細胞產生較多的受損DNA片段,“刺猬”狀細胞數量明顯增多,各試驗組肝細胞、腎細胞和外周血淋巴細胞未出現明顯的拖尾現象。

圖3 大鼠肝細胞彗星顯微圖像觀察結果

圖4 大鼠腎細胞彗星顯微圖像觀察結果

圖5 大鼠外周血淋巴細胞彗星顯微圖像觀察結果
2.2.2 細胞尾部DNA百分比、尾矩和Olive尾矩分析結果與SC陰性對照組相比,MMS陽性對照組大鼠的肝、腎和外周血的細胞尾部DNA百分比值、尾矩和Olive尾矩明顯升高,與SC陰性對照組間的差異具有統計學意義(P<0.01)。兩種PEEK試驗組大鼠的肝、腎、外周血的尾部DNA含量百分比值、尾矩、Olive尾矩和“刺猬”狀細胞發生頻率分別與SC和CSO陰性對照組相比,差異均無統計學意義(P>0.05),見表2~表4。結果表明在本研究體系中兩種PEEK材料的試驗液未誘導SD大鼠肝臟組織細胞DNA鏈斷裂。
表2 各組大鼠肝細胞體內堿性彗星試驗分析結果(±s,n=10)

表2 各組大鼠肝細胞體內堿性彗星試驗分析結果(±s,n=10)
與陰性對照組比較,*P<0.05.
?
表3 各組大鼠腎細胞體內堿性彗星試驗分析結果(±s,n=10)

表3 各組大鼠腎細胞體內堿性彗星試驗分析結果(±s,n=10)
與陰性對照組比較,*P<0.05.
?
表4 各組大鼠外周血淋巴細胞體內堿性彗星試驗分析結果(±s,n=10)

表4 各組大鼠外周血淋巴細胞體內堿性彗星試驗分析結果(±s,n=10)
與陰性對照組比較,*P<0.05.
?
3 討論
截至2021年,我國已有八萬八千多個國產醫療器械取得注冊證,其中大部分醫療器械使用時直接或間接與患者接觸并帶來一定的風險,為保證醫療器械不對患者造成生物學毒害,上市前必須開展生物學評價。遺傳毒性是生物材料和醫療器械生物學評價的重要內容,對評價生物材料和器械的生物安全性尤其是潛在的致癌可能性有重要意義。根據相關規定,具體的遺傳毒性試驗方法建議按照GB/T 16886.3進行[7-8]。
哺乳動物體內堿性彗星試驗是一種體內遺傳毒性試驗方法,目前大部分研究均按照OECD發布的體內堿性彗星試驗的指導原則進行,該指導原則是針對化學品特性制定的,試驗介質為極性溶劑,而醫療器械在發揮治療/輔助治療疾病的過程中,可通過多種途徑(如腸道、血液、吸入、植入、生殖器官、皮膚等)與人體接觸,單一介質并不能反映醫療器械的臨床使用特性,同時該指導原則并未給出醫療器械及其材料試驗液制備的方法,在染毒劑量等方面與醫療器械及其材料也有較大的差異,因此該指導原則不適宜直接用于醫療器械/材料的檢測。但是適用于醫療器械及其材料進行遺傳毒性試驗的GB/T 16886.3標準并未給出哺乳動物體內堿性彗星試驗的詳細試驗方法,目前國內也沒有關于醫療器械及其材料進行哺乳動物體內堿性彗星試驗的相關文獻可以參考,因此本研究依據醫療器械臨床使用的特點,對常用的體內堿性彗星試驗方法進行了改良,給出了樣品制備、試驗液和陽性對照物的染毒劑量等詳細的試驗步驟,建立了適用于醫療器械及其材料的哺乳動物體內堿性彗星試驗的關鍵檢測技術并獲得了相關的數據,填補了該方法在醫療器械及其材料檢測應用中的空缺,為其他醫療器械及其材料進行哺乳動物體內堿性彗星試驗提供了參考依據。
聚醚醚酮(PEEK)是一種聚芳香族半結晶熱塑性高分子材料,其彈性模量與人皮質骨的彈性模量接近,可有效降低應力遮擋引起的骨吸收風險,是生物假體植入物的理想材料之一,被廣泛地應用于脊柱外科、矯形外科、頜面外科等領域[9]。GB/T 16886.1規定對醫療器械進行生物學評價時,與組織/骨接觸的植入類醫療器械均需要進行遺傳毒性評價。本研究參考GB/T 16886.12的規定,選擇0.2 g/mL的浸提比例,采用極性溶劑SC和非極性溶劑CSO兩種介質在(121±2)℃下浸提(1.0±0.1)h,取浸提液作為PEEK的試驗液,對PEEK中是否含有潛在遺傳毒性物質進行了研究。
目前彗星試驗大多采用定性分析和定量分析兩種方法進行結果評價,本研究認為定性分析人為干擾影響較大,可能導致試驗結果不準確。尾部DNA百分比、尾矩和Olive尾矩是目前比較常用的彗星試驗的分析指標,有研究表明這3個指標具有良好的相關性且無顯著差異,尾矩和Olive尾矩可以將DNA損傷量和遺傳物質在尾部的遷移距離用一個數字來表示,而同一個細胞的尾部DNA百分比在不同的彗星圖像分析軟件中的值基本相同,因此本研究決定采用定量分析的方法,以尾部DNA百分比、尾矩和Olive尾矩作為分析指標[10-12]。由表2~表4可以看出,本研究中各組的尾部DNA百分比、尾矩和Olive尾矩均具有良好的相關性。本研究對醫療器械及其材料試驗液的制備、陽性對照物、染毒劑量、取材時間等關鍵變量作了明確,將SD大鼠的體質量變化、臟器的相對質量、臨床觀察、病理學檢查等指標與體內堿性彗星試驗結果相結合,對PEEK的全身毒性和遺傳毒性進行綜合分析,建立了適用于醫療器械及其材料哺乳動物體內堿性彗星試驗的研究體系。
從彗星顯微圖像觀察結果圖3~圖5中可以看出,MMS陽性對照組的肝臟、腎臟和外周血中均出現較多的“刺猬”狀細胞,大鼠肝細胞、腎細胞和外周血淋巴細胞的體內堿性彗星試驗分析結果也顯示MMS陽性對照組和SC陰性對照組相比“刺猬”狀細胞的發生頻率存在顯著性差異(如表2~表4所示)。“刺猬”狀細胞被認為是嚴重受損的細胞,但其成因目前尚不明確,有研究表明“刺猬”狀細胞是由可修復的DNA損傷造成的[13],也有研究認為“刺猬”狀細胞是由樣品相關的細胞毒性或樣品制備過程中開始的機械/酶誘導損傷導致的[14]。考慮到細胞毒性也可能導致DNA遷移程度增加,而且已知的遺傳毒性物質也大都存在低等或中等的細胞毒性,因此本研究對所有動物的肝臟和腎臟進行了組織病理學檢查[15],圖1和圖2的結果顯示陽性對照組的肝臟和腎臟未觀察到明顯的組織病理學改變,陽性對照組和陰性對照組相比未見明顯異常。本研究結果顯示所有試驗動物未見明顯的全身毒性,陽性對照組和陰性對照組間的差異有統計學意義,表明試驗體系成立。
彗星試驗可分為中性彗星試驗和堿性彗星試驗,一般認為中性彗星試驗能夠檢測DNA雙鏈的斷裂,而堿性彗星試驗能夠檢測DNA單鏈和雙鏈的斷裂以及大部分的脫嘌呤嘧啶(apurinic/apyrimidinic,AP)位點,因而具有更高的靈敏度。由于肝臟和腎臟是物質在體內代謝、吸收和排泄的主要器官,同時也是高頻致癌靶組織,而本研究采用靜脈和腹腔途徑染毒,因此將肝臟、腎臟和外周血作為靶組織。除此之外,體內堿性彗星試驗還可根據醫療器械/材料預期的臨床用途選擇胃、十二指腸、空腸、皮膚或膀胱等作為合適的靶器官[16-18]。
由于未檢索到兩種PEEK材料的毒代動力學數據,本研究采用了連續兩次染毒(間隔24 h)的染毒方法。根據OECD發布的體內堿性彗星試驗的指導原則,體內堿性彗星試驗的染毒時間應根據血藥濃度達到峰值的時間來確定,因此不同醫療器械/材料的染毒時間可能會有差異,從而對試驗結果產生影響。為滿足動物福利要求,減少動物使用量,體現“3R”原則(減少、優化、替代),體內堿性彗星試驗可與體內微核試驗、重復接觸全身毒性試驗等研究進行結合,實現多終點的檢測[19-20]。但是在與其他毒性研究結合時應特別注意體內彗星試驗的取材時間,取材時間應選在DNA鏈被誘導斷裂之后,且在斷裂被去除/修復之前,有研究表明一些導致DNA鏈斷裂的損傷持續時間可能非常短[21-23],但大部分毒性研究的取材時間為末次染毒后24 h取材,這就導致體內彗星試驗與其他毒性研究結合時可能會漏檢此類DNA損傷,因此應根據試驗樣品和靶器官仔細設計體內彗星試驗的染毒時間和取材時間。下一步,我們將研究不同醫療器械及其材料的染毒時間對DNA損傷的影響,并通過將體內彗星試驗與體內微核試驗、重復接觸全身毒性試驗相結合來更加科學合理地進行醫療器械及其材料的遺傳毒性評價。
隨著“后疫情時代”的到來,生物技術與多學科交叉匯聚融合發展的態勢越來越明顯,前沿生物技術引領醫療器械領域的創新突破加速演進,大批新型的生物材料和醫療器械例如動物源性材料、可吸收/可降解材料、復合材料、3D打印生物材料、納米材料等層出不窮。某些傳統的生物學評價方法對這些新型材料已經不再適用,例如由于納米材料的攝取和DNA接觸的不確定性,常用的細菌回復突變試驗就不適用于納米材料的致突變性檢測。因此迫切需要更全面、準確的檢測方法來科學合理的評價醫療器械及其材料的臨床前安全性。本研究為體內堿性彗星試驗在醫療器械及其材料遺傳毒性評價中的應用提供了基礎數據,提升了醫療器械及其材料遺傳毒性評價的研究水平,具有重要的參考價值。

