下肢骨折切開復位術中手術室主動保溫干預效果研究
黃 昭 君
(鄭州大學附屬鄭州市中心醫院消毒供應中心 鄭州 45000)
下肢骨折是臨床常見病及多發病之一,多發生于中老年人群,臨床為改善患者癥狀,促進預后改善,多給予切開復位內固定術治療,但由于手術時間較長,且受到室溫低等因素影響,手術麻醉可對體溫調節功能產生抑制,一旦手術過程中受到冷刺激,就可導致體溫下降[1]。麻醉患者最易出現術中低體溫,可提高切口感染風險,甚至引起心肌缺血、凝血功能障礙等,進而延長患者住院時間[2]。資料顯示,術中低體溫在骨折手術患者中發生率超過50%,且術中低體溫是死亡率增加的一項重要危險因素,而低體溫癥發展的危險因素包括損傷類型、手術時間、年齡及液體量等[3]。由此,需采取有效、安全體溫保護措施,以避免體溫過度降低。主動保溫干預用于手術室護理,指圍手術期采用多種體溫保護措施,以減少低體溫對機體影響[4]。本次選取我院于2019年9月-2021年9月收治的82例下肢骨折患者,研究下肢骨折切開復位術中手術室主動保溫干預的應用效果,報道見下。
1 資料與方法
1.1 一般資料
選取河南省人民醫院于2019年9月-2021年9月行切開復位內固定術的82例下肢骨折患者,納入標準:(1)符合診斷標準,經X線、CT檢查確診;(2)均為單側下肢骨折;(3)病歷資料完整。排除標準:(1)單側患肢有兩處及以上骨折者;(2)開放性骨折者;(3)病理性骨折者;(4)伴創面感染者;(5)合并凝血功能障礙者。按隨機數字表法分組,對照組41例中男25例,女16例,年齡38歲-75歲,平均(54.29±3.27)歲。試驗組41例中男23例,女18例,年齡41歲-72歲,平均(54.32±3.16)歲。兩組資料比較,P>0.05。
1.2 方法
對照組行常規保溫干預,術中采用手術巾單將患者胸腹部覆蓋,全程控制室溫為22℃,不使用保溫毯,所需輸注液體或沖洗液均維持室溫。試驗組行手術室主動保溫干預,術前30min控制室溫為24℃-26℃,待手術開始后調節體溫為22℃-24℃,手術結束后立即調節溫度為24℃-26℃;采用3M充氣式保溫毯將患者胸腹部覆蓋,設置目標體溫為38℃,對輸注液體、沖洗液等進行保溫處理,控制溫度為37℃。
1.3 觀察指標
1.3.1 舒適度
手術前后開展舒適度評分量表(GCQ)評估,包括心理(25分)、生理(25分)及環境舒適度(25分),評分與舒適度成正比。
1.3.2 耳溫變化情況
測量患者耳溫,時間為入室時(T1)、手術開始時(T2)、手術開始后1h(T3)、手術結束后1h(T4)。
1.3.3 血栓彈力圖指標測定血栓彈力圖,時間為入室時(T1)、手術開始時(T2)、手術開始后1h(T3)、手術結束后1h(T4)。
1.3.4 凝血功能血凝儀采用賽科希德SF-8200型,術前后采集3ml空腹靜脈血,離心(半徑14cm,轉速3500r/min,時間10min)取上清液測定凝血酶時間(TT)、活化部分凝血活酶時間(APTT)、纖維蛋白原(FIB)、凝血酶原時間(PT)。
1.3.5 圍術期指標
記錄術中出血量及術后24h引流量。
1.4 統計學分析
2 結果
2.1 兩組舒適度評分對比
試驗組術后生理、心理及環境舒適度評分均高于對照組(P<0.05),見圖1。
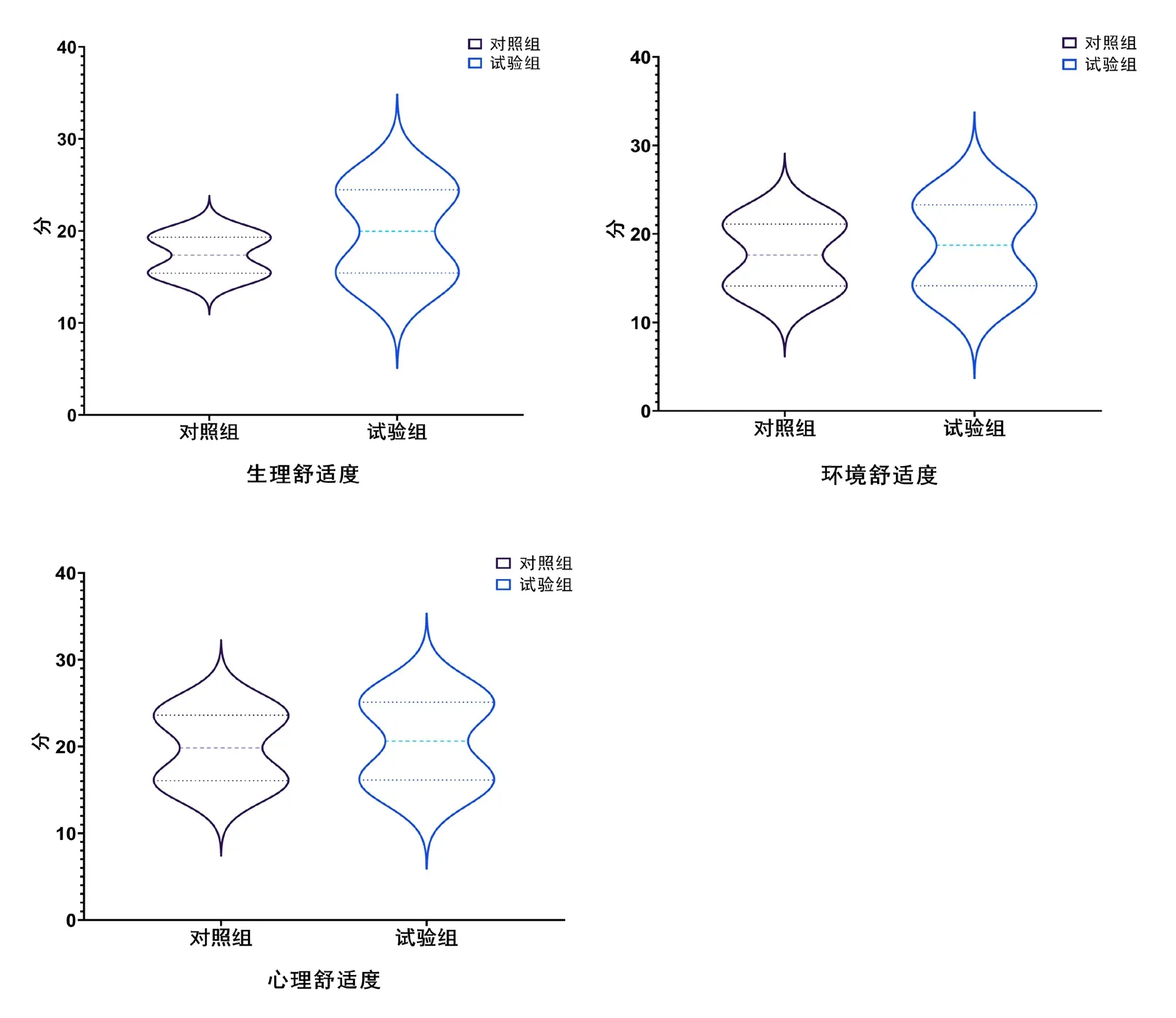
圖1 舒適度評分
2.2 兩組耳溫變化情況對比
試驗組T3、T4時刻均高于對照組(P<0.05),見圖2。
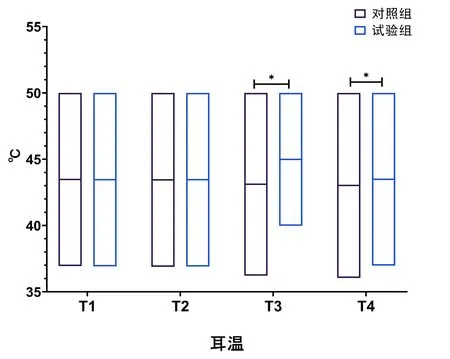
圖2 耳溫變化情況
2.3 兩組血栓彈力圖指標
與對照組比較,試驗組T3、T4時刻R值、K值更短,T4時MA值更長(P<0.05),見圖3。
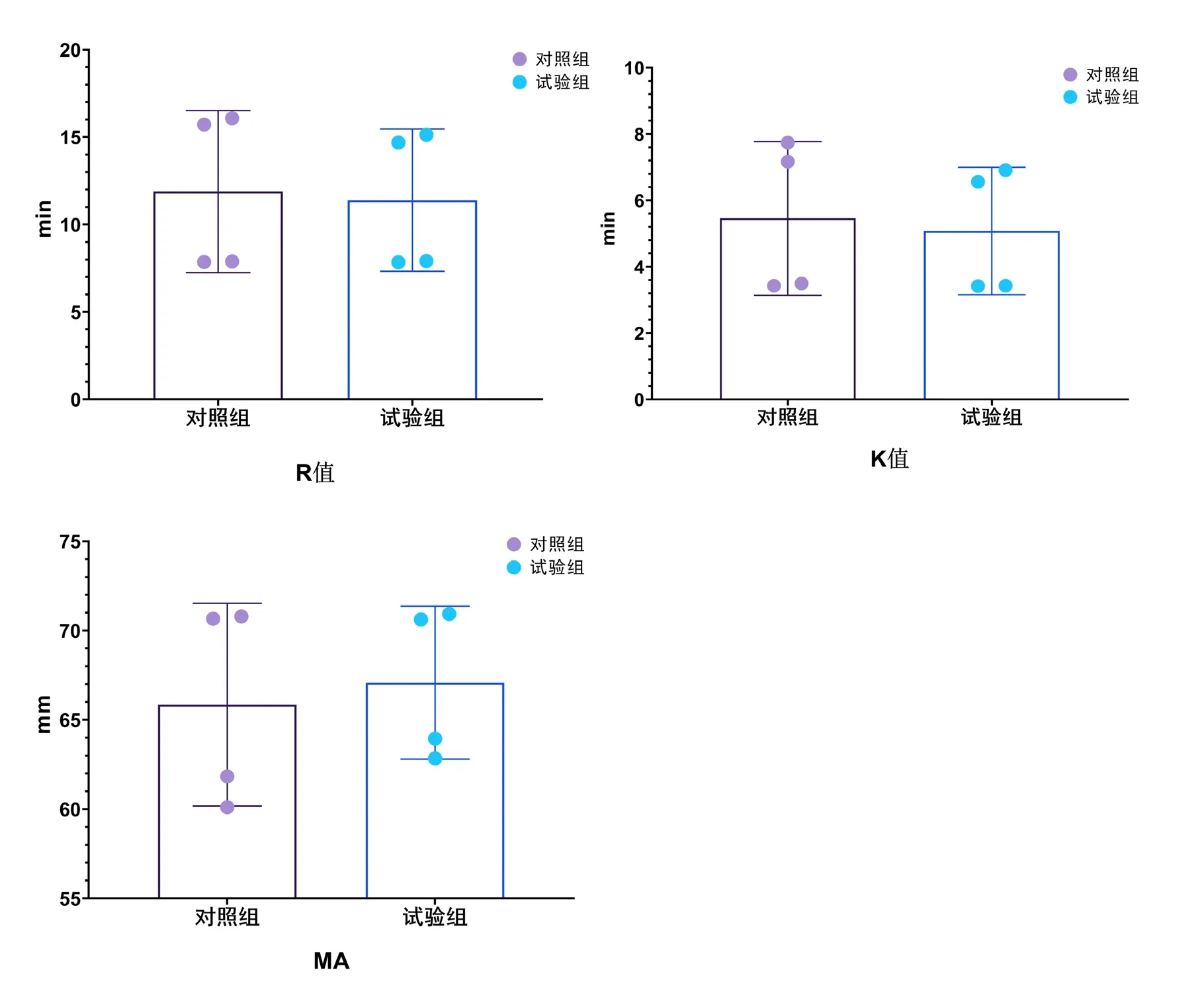
圖3 血栓彈力圖指標
2.4 兩組凝血功能指標對比
試驗組術后PT、TT、APTT水平均高于對照組,FIB水平低于對照組(P<0.05),見表1。
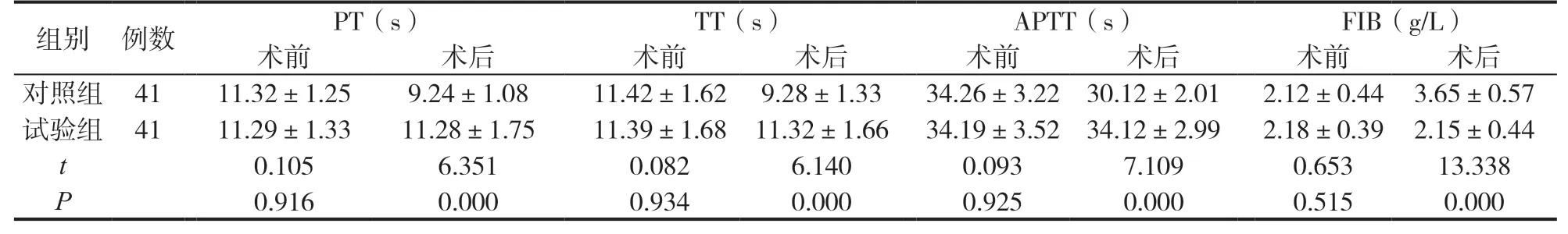
表1 兩組凝血功能指標比較( ±s)
2.5 兩組圍術期指標對比
與對照組比較,試驗組術中出血量、24h引流量均更低(P<0.05),見表2。

表2 兩組圍術期指標比較( ±s,mL)
3 討論
下肢骨折多采用手術治療,以切開復位內固定術為常用術式,可于短時間內改善患者疼痛、腫脹等癥狀,但由于術中靜脈輸液、長時間暴露機體等因素影響,可導致機體體溫下降,而過低體溫可對機體凝血功能產生不利影響,甚至增加出血量,提高并發癥發生風險[5-7]。圍術期低體溫的誘發因素復雜,以麻醉最為常見,熱量于機體內分配可對血管收縮產生促進作用,并可維持核心體溫。一旦接受麻醉,可能抑制溫度感覺傳導通路,對體溫調節功能產生不利影響,加速血管擴張,進而降低血液流速[8]。椎管內麻醉是切開復位內固定常用麻醉方式,可對下肢體溫調節性血管收縮產生抑制作用,且中心體溫可隨著腰麻平面提高而不斷降低[9]。一般來說,機體于術前30min可重新分配熱量,即將體內熱量進行轉移,而溫差一旦提高可加速轉移,而手術開始30min后由于熱量大量喪失、機體產熱少等,體溫不斷下降,資料顯示,在總損失熱量中患者皮膚散失熱量占比高達90%[10-12]。低體溫一旦發生,可對血液系統產生直接影響,通過對V、IX、VII等凝血因子活性產生抑制作用,并對血小板功能產生影響。同時,低體溫可對纖溶酶原產生激活效應,不僅可對FIB降解產生促進作用,還可提高纖溶活性,達到減少FIB目的。同時,體溫過低不僅可影響血小板聚集情況,還可對其釋放、黏附等產生抑制,降低血小板變形能力,不僅可降低氧消耗量,還可影響基礎代謝率,以達到減少凝血因子生成的目的。此外,過低體溫可對機體代謝產生不利影響,導致代謝紊亂,嚴重者可引起酸中毒,而一旦機體處于酸性條件,凝血因子活性受到抑制,凝血酶原被激活速率不斷降低,而酸中毒可激活纖溶系統,由此加重病情,出血量明顯增加,
進而提高病死率。由此,需對下肢骨折切開復位內固定術治療患者開展手術室主動保溫干預,以避免低體溫發生,達到促進患者恢復的目的。
本研究中試驗組行手術室主動保溫干預,結果顯示,術后試驗組生理、心理及環境舒適度評分較之對照組更高;試驗組T3、T4時刻耳溫均高于對照組;與對照組比較,試驗組T3、T4時刻R值、K值更短,T4時MA值更長;試驗組術后PT、TT、APTT水平均高于對照組,FIB水平低于對照組;與對照組比較,試驗組術中出血量、24h引流量均更低(P<0.05);提示主動保溫干預用于臨床可促進患者舒適度提高,減少引流量及出血量,對凝血功能影響較小。分析原因,手術室主動保溫干預于術前30min調高室內溫度,并于手術開始后調低溫度,手術結束后立即提高溫度,有利于維持患者體溫穩定,避免低體溫發生,以減少患者出血量[13]。同時,加溫裝置設定目標體溫為38℃,給予3M充氣式保溫毯,在不增加體表壓力情況下,可將常規巾單與衣服對保溫毯進行阻隔,以避免燙傷發生。其次,對術中所需輸注液體或用于沖洗的液體保持室溫,可避免空氣栓塞等并發癥發生,并減少患者熱量散失,維持血壓穩定,以大奧降低熱量大幅流失的目的,以維持患者圍術期體溫。此外,主動保溫干預給予患者保溫毯,可減少患者皮膚暴露,有利于促進患者舒適度提高[14]。
綜上所述,手術室主動保溫干預應用于下肢骨折切開復位內固定術,有利于提高舒適度,減少并發癥,并減輕對凝血功能影響。

