采用液相色譜-質譜/質譜法(配APCI和ESI源)檢測核桃中的井岡霉素
井岡霉素,也被稱為有效霉素,是一種水溶性抗生素,其由吸水鏈霉菌井崗變種而產生,于20世紀末由上海農藥研究所在江西井岡山地區土壤中采用篩選分離技術得到[1]。井岡霉素屬于七碳氨基環醇類抗生素,主要通過抑制真菌和昆蟲中海藻糖酶的活性來展現其出色的抗真菌活性以及抗蟲活性[2]。井岡霉素已經被廣泛用于水稻紋枯病立枯絲核菌的殺菌和防治[3-4]。井岡霉素除了具有良好的防治植物病蟲害的作用外,還表現出良好的生物安全性,在植物、農作物以及土壤中殘留較少,且殘留的微量井岡霉素不會被人體腸道吸收,可直接被排出體外,這一特性有助于減少農藥殘留對人體健康的損害[5-7]。目前,已經有近300種井岡霉素在我國獲得農藥登記,鑒于其在農業方面突出的作用,井岡霉素的檢測對于分析農作物上的農藥殘留量至關重要。
井岡霉素的傳統檢測方法主要有薄層色譜法[8]、毛細管電泳法[9-10]、氣相色譜法[11]、液相色譜法[12]以及液相色譜-串聯質譜法[13-15]等。其中,毛細管電泳法檢出限為0.2 μg·mL-1,靈敏度較低;氣相色譜法測定井岡霉素需要衍生,過程煩瑣,實驗過程耗時長,需要操作人員對實驗設備及實驗操作都有較高程度的掌握,實驗結果容易受人員因素影響;液相色譜法檢測井岡霉素時,在210 nm處有最大吸收,但多數物質在該波長下有一定程度的吸收,容易引起基質干擾,導致定性能力較差。因此,建立一種簡單高效的井岡霉素檢測方法對于井岡霉素以及其他農藥殘留分析具有重要的意義。超高效液相色譜-串聯質譜法(Ultra Performance Liquid Chromatography Tandem Mass Spectrometry,UPLC-MS/MS)作為一種有效的檢測方法,受到研究人員的廣泛關注。該法可以將質譜的高選擇性、高靈敏度與液相分離相結合,近年來在農藥檢測中被廣泛應用。目前現行有效的食品安全法規定的方法為GB 23200.74—2016,標準中規定的儀器設備為液相色譜-質譜/質譜儀,配大氣壓化學電離源(APCI源)。但各檢測單位對APCI源的使用頻率較低,大部分單位都很少配置,主要使用電噴霧離子源(ESI源)。如果ESI源也能用于井岡霉素的檢測,則不限制檢測儀器的科學實驗就可以減少成本,方便科學研究的分析檢測。
本文分別使用APCI源和ESI源同時對核桃中井岡霉素進行了檢測分析,以期為井岡霉素的檢測分析提供技術依據。
1 材料與方法
1.1 材料與試劑
核桃,新疆阿克蘇。
井岡霉素(純度99%,DRE);乙腈、甲醇(色譜級,德國默克);去離子水;HLB小柱,6 mL/200 mg,上海安譜。
1.2 儀器與設備
Q-sight 4500 PE液 相 色 譜-質 譜/質 譜 儀;QTRAP 6500三重四極桿-線性離子肼質譜系統,美國AB Sciex公司;UPLC液相色譜系統,PE公司,美國AB Sciex公司。
1.3 實驗方法
1.3.1 標準曲線的繪制
(1)標準溶液的配制。準確稱取標準品井岡霉素10 mg(精確至0.01 mg),用水溶液溶解并定容至10 mL容量瓶中,稀釋溶解得到濃度為1 mg·mL-1的標準儲備液,待用部分需冷藏避光保存。
(2)標準工作液的配制。準確吸取適當體積的上述標準儲備液,用水溶液根據不同濃度需要給予稀釋,分別得到濃度為2 ng·mL-1、5 ng·mL-1、10 ng·mL-1、20 ng·mL-1、50 ng·mL-1、100 ng·mL-1和200 ng·mL-1的標準工作溶液。
(3)標準工作曲線。將上述工作液一式兩份分裝樣品瓶,待上機檢測,以井岡霉素濃度值為橫坐標,目標物峰面積為縱坐標,繪制標準工作曲線。
1.3.2 樣品處理
實驗采用相同的前處理過程。稱取約2.5 g核桃樣品(精確至0.01 g),置于聚四氟乙烯離心管中,加入25 mL CH3OH溶液,用均質器高速勻漿提取2 min,5 000 r·min-1離心7 min,收集上清液于另一個離心管中。離心后的殘渣用5 mL CH3OH溶液重復上述提取步驟1次,合并上清液,在45 ℃水浴下氮吹濃縮至2.5 mL以下,待凈化。取氮吹濃縮后的待凈化溶液轉移到活化過的HLB固相萃取柱中,調整流速為1滴/s,過固相萃取柱,待溶液剛要全部流出,液面馬上要消失還沒有消失的時候,用2 mL水淋洗柱子,將全部的流出溶液和淋洗溶液收集到適當體積的刻度試管中,加水定容至5.0 mL,混勻,過0.22 μm濾膜,分別供配備APCI源及ESI源的液相色譜-串聯質譜儀進行測定。
1.3.3 儀器條件
前處理完成后,將經過相同步驟處理的樣品溶液分裝到不同樣品瓶中,上機待測。實驗使用相同填料及規格的色譜柱(色譜柱為安捷倫C18色譜柱100 mm×2.1 mm,1.7 μm),柱溫均為40 ℃,流動相A均為CH3OH,流動相B均為0.05%的CH3COONH4緩沖溶液。根據實驗儀器狀態的不同,參數略有差異,APCI源流速為0.8 mL·min-1,進樣量為2 μL,APCI源洗脫梯度見表1。ESI源流速為0.4 mL·min-1,進樣量為5 μL,ESI源洗脫梯度見表2。
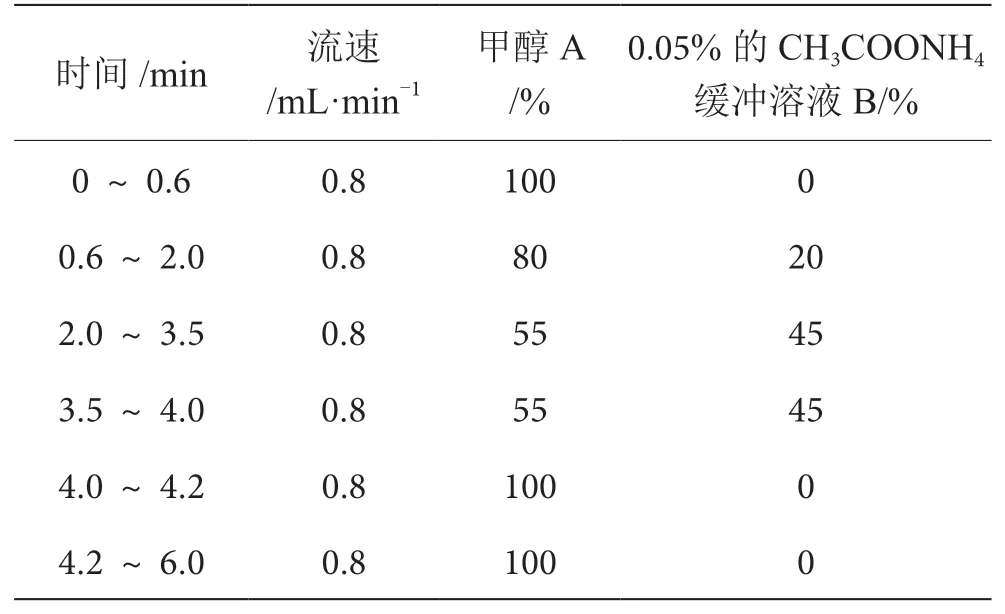
表1 APCI源梯度洗脫條件表
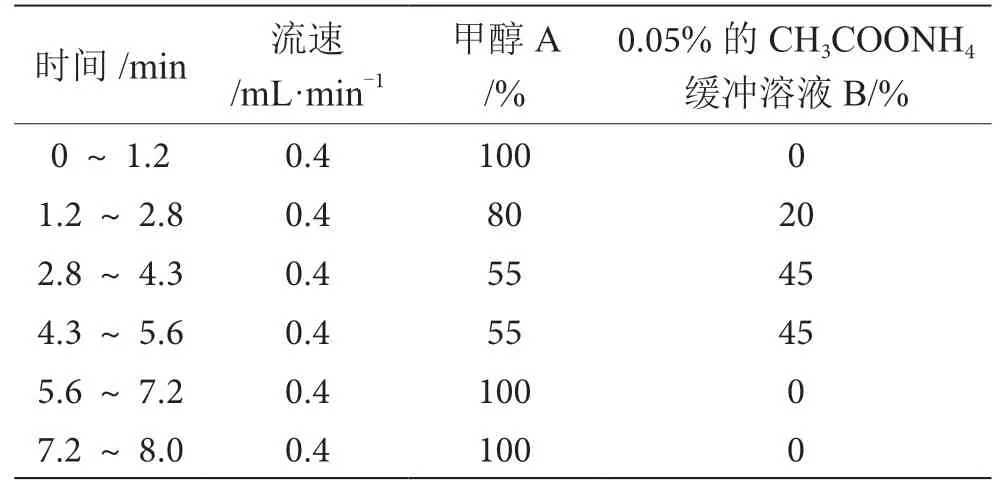
表2 ESI梯度洗脫條件表
2 結果與分析
2.1 定性信息確認
實驗通過對比標準品和待測物的儀器保留時間和離子對豐度比進行定性分析。ESI離子對譜圖見圖1,APCI離子對譜圖見圖2(圖中濃度為2.0 ng·mL-1)。APCI源及ESI源的保留時間及結果偏差見表3,相對離子豐度比及結果偏差見表4。從結果可見標準品與待測物之間的保留時間與出峰狀態足夠相近,偏差均能夠滿足定性要求。

表4 APCI源及ESI源相對離子豐度比結果及偏差表
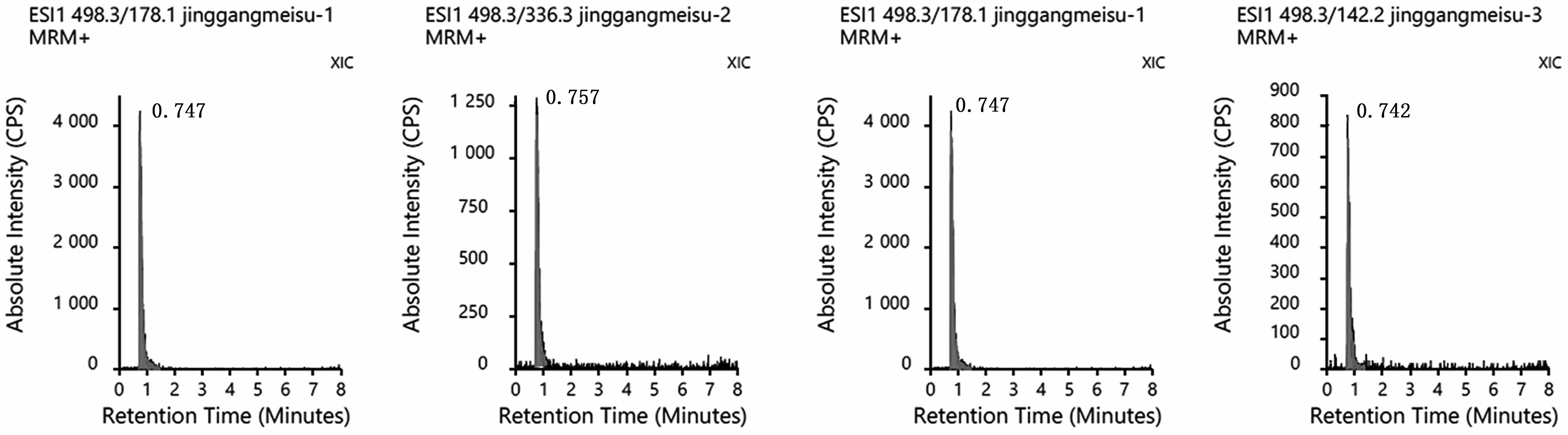
圖1 ESI離子對譜圖

圖2 APCI離子對譜圖

表3 APCI源及ESI源保留時間及偏差表
2.2 線性方程
按照1.3.1實驗方法配制2~200 μg·L-1濃度范圍的溶劑標準溶液,分裝樣品瓶分別上機檢測。APCI源及ESI源均在2~200 μg·L-1性關系良好,相關系數R2均大于0.99,具體結果見表5。

表5 標準曲線結果表
2.3 方法的靈敏度、準確度和精密度
在10 μg·kg-1、20 μg·kg-1、100 μg·kg-13個加標濃度下進行加標回收實驗驗證,3個濃度水平分別重復3次、7次、3次。如表6所示,APCI源井岡霉素在核桃中的平均回收率為81.8%~87.2%,標準偏差為2.8%~7.0%,定量限為5.79 μg·kg-1;ESI源井岡霉素在核桃中的平均回收率為81.8%~86.1%,標準偏差為5.1%~12.0%,定量限為8.66 μg·kg-1。
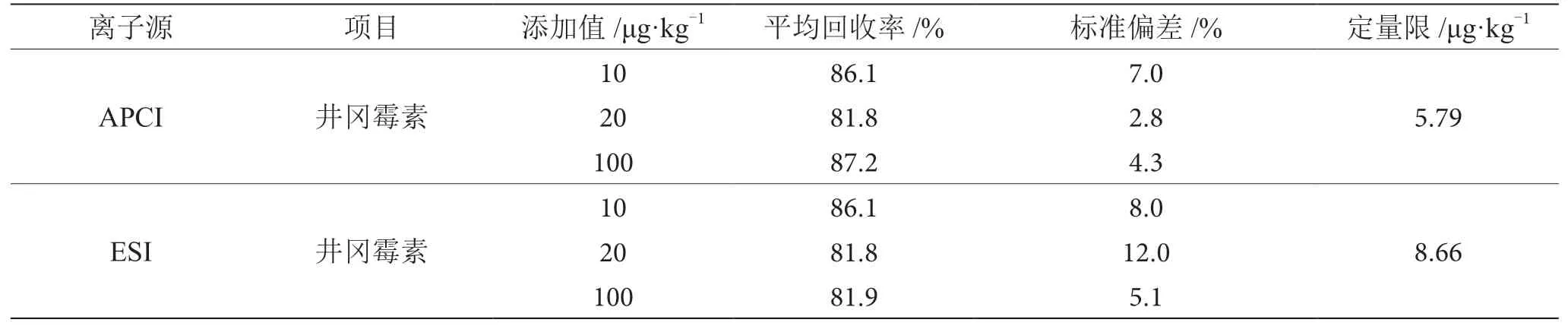
表6 APCI源及ESI源檢出限、準確度結果表
3 結論
APCI源與ESI源均適用于核桃中井岡霉素的檢測。實驗在APCI源進樣量更小的情況下,APCI源的定量限依然明顯低于ESI源,靈敏度更高,但不完全是離子源的原因,可能還與色譜條件、儀器狀態等其他因素有關。若實驗對靈敏度要求較高,則選用APCI源更合適。
兩種離子源的質譜儀檢測下,待測物在2~200 ng·mL-1線性關系均能夠滿足相關,R2均大于0.99;在不同加標水平下平均回收率在60%~120%(APCI源方法檢測回收率為78.4%~98.8%;ESI源方法檢測回收率為80.7%~107.9%);偏差結果均小于22%(APCI源方法檢測偏差為2.0%~7.8%;ESI檢測方法偏差為1.1%~12.0%),多項指標均滿足《實驗室質量控制規范 食品理化檢測》(GB/T 27404—2008)的技術要求。實驗過程中發現,相同的樣品處理操作下,ESI源結果的穩定性盡管同樣滿足要求,但是相比于APCI源較差些(偏差結果也同樣反映此問題,ESI源偏差值更大);同樣樣品小瓶移至APCI源檢測,結果重現性更好。但是并不能完全歸因于離子源原因,可能還與儀器設備的廠家不同、硬件原理各有差別、質譜優化參數各不相同以及每臺儀器狀態也具有一定的隨機性等有關,因此ESI源結果穩定性較差的原因有待進一步研究。

