組蛋白甲基化酶SUV39H1過表達對C2C12細胞成骨分化的影響
王乾 黃晨 黃廷銳 孫攀 趙永見,3 施杞,3 王擁軍,3 唐德志,3*
1.上海中醫藥大學附屬龍華醫院,上海 200032 2.上海中醫藥大學脊柱病研究所,上海 200032 3.教育部筋骨理論與治法重點實驗室,上海 200032
隨著我國交通事業的蓬勃發展,交通事故引起的創傷性骨折患者發病率逐年增高,由于交通事故通常暴力巨大,常導致骨不連和骨缺損等并發癥[1-3]。這嚴重影響著患者的肢體功能和術后康復。如何提高患者的治愈率,改善患者的功能,成為每位骨科醫師必須思考的問題。肌肉干細胞作為間充質干細胞的一員,由于來源廣泛,易于取材且在一定條件下可向成骨細胞分化,因此逐漸成為骨組織工程研究極具潛力的種子細胞[4-5]。組蛋白甲基化作為組蛋白密碼的重要組成部分,深刻影響著表觀遺傳學的調控[6-7]。而目前組蛋白甲基化酶SUV39H1對成肌細胞成骨分化影響的機制尚不明確。本實驗將含有小鼠SUV39H1基因的慢病毒感染C2C12細胞,旨在探討外源性SUV39H1基因對BMP2誘導的C2C12細胞成骨分化的影響,從而為進一步闡明SUV39H1調節成肌細胞成骨分化機制以及C2C12成肌細胞為代表的種子細胞早日在體內應用提供理論與實驗依據。
1 材料和方法
1.1 實驗細胞
實驗細胞采用C2C12細胞,購自中國科學院細胞庫。
1.2 主要試劑與儀器
DMEM高糖培養基購自Hyclone公司;Recombinant Human/Mouse/Rat BMP-2購自蘇州近岸蛋白質公司;SUV39H1過表達慢病毒及GFP對照慢病毒購自吉滿生物科技公司;總RNA提取,反轉錄及實時熒光定量PCR試劑盒購自EZBioscience公司;Western blot裂解液、BCA蛋白定量試劑盒及茜素紅S試劑盒購自上海碧云天公司;BCIP/NBT堿性磷酸酶顯色試劑盒,Runx2、ALP、H3、SUV39H1、GAPDH一抗購自CST公司;H3K9me3一抗購自Abcam抗體公司;相關二抗購自CST公司;PCR引物由上海華大基因合成。具體引物序列見表1。

表1 Real-Time PCR 引物序列Table 1 Primer sequences for real-time PCR
1.3 成骨誘導液配置
C2C12細胞采用DMEM高糖培養基培養,其內含有體積分數為5 %的胎牛血清,1 %的青霉素和鏈霉素。隨后50 mL培養基內加入5 μg重組骨形態發生蛋白2,確保最終成骨誘導液最終濃度為100 ng/mL。
1.4 實驗方法
1.4.1SUV39H1過表達穩轉株的構建與篩選:實驗首日取對數生長期的C2C12細胞均勻接種于24孔板內,采用常規培養方法培養。第二日取出-80 ℃凍存的慢病毒懸液,待病毒液冰浴融化后按照感染復數為50(MOI=50)加入SUV39H1過表達慢病毒及帶有GFP的對照慢病毒。感染病毒24 h后,加入2.5 μg/mL的嘌呤霉素進行抗性篩選。連續進行6 d的抗性篩選,隨后倒置熒光顯微鏡下觀察感染效率。
1.4.2SUV39H1過表達穩轉株的鑒定:將抗性篩選6 d后的SUV39H1過表達穩轉株和GFP陰性對照組分別進行qRT-PCR實驗和Western blot實驗在基因和蛋白表達層面進行驗證。
1.4.3成骨分化誘導:將胰酶消化好的對數生長期的C2C12過表達細胞和帶有GFP的對照細胞,用新鮮培養基調整細胞密度為2.5×104個/mL,吸取2 mL細胞懸液接種于6孔板中,十字交叉搖勻法確保均勻接種,常規培養24 h。隨后棄掉培養液加入含有BMP2(100 ng/mL)成骨誘導液繼續培養。連續培養7 d后進行后續實驗操作。
1.4.4形態學觀察:倒置熒光顯微鏡下每日觀察SUV39H1過表達穩轉株的生長及誘導情況。
1.4.5堿性磷酸酶染色:C2C12細胞成骨誘導7 d后,棄掉6孔板中的培養基,用PBS沖洗兩遍,隨后每孔加入1 mL 4 %多聚甲醛固定液固定15 min,棄掉固定液,蒸餾水沖洗兩遍后,按照堿性磷酸酶試劑說明書6孔板每孔加入1 mL染液,避光染色30 min。棄染液蒸餾水洗滌兩遍后終止染色,隨后進行拍照。
1.4.6茜素紅染色:C2C12細胞成骨誘導12 d后,棄掉6孔板中的培養基,用PBS沖洗兩遍,隨后每孔加入1 mL 4 %多聚甲醛固定液固定15 min,棄掉固定液,蒸餾水沖洗兩遍后,按照茜素紅試劑說明書6孔板每孔加入1 mL染液,避光染色30 min。棄染液蒸餾水洗滌兩遍后終止染色,隨后進行拍照。
1.4.7qRT-PCR檢測成骨相關基因的表達情況:C2C12細胞成骨誘導7 d后,棄掉培養基,用預冷的PBS洗滌兩遍后,根據EZBioscience 總RNA提取試劑盒說明書提取RNA,測定RNA濃度并監測提取RNA的質量是否符合進行下一步反轉錄的要求。將符合要求的RNA按照1 μg/20 μL 的體系采用EZBioscience反轉錄試劑盒將其反轉錄成cDNA。以cDNA為模板,GAPDH為內參,按照EZBioscience實時熒光定量檢測試劑盒說明書進行擴增。采用2-△△ct法計算SUV39H1過表達穩轉株Runx2、ALP、OPN、OCN、MYOD的mRNA相對表達量水平。表1為擴增所需引物,PCR反應條件為:第1步,95 ℃ 5 min;第2步,95 ℃ 10 s,60 ℃ 30 s,共進行40個循環。
1.4.8免疫熒光檢測RUNX2蛋白表達情況:將C2C12細胞過表達穩轉株和GFP對照組按照2 000個細胞/孔的密度均勻接種于24孔板內,待細胞貼壁后加入成骨誘導液誘導培養。培養5 d后,用4 %的多聚甲醛進行固定20 min,棄固定液,PBS搖床洗3遍,每次5 min。隨后加入0.3 %的Triton X100通透液透膜,PBS搖床洗3遍,每次5 min。封閉液室溫封閉1 h,隨后加入Runx2一抗4 ℃孵育過夜,孵抗兔二抗1 h,倒置熒光顯微鏡下拍照觀察。
1.4.9蛋白免疫印跡法(Western blot)檢測成骨相關蛋白表達:C2C12細胞成骨誘導7 d后,棄掉培養基,用預冷的PBS洗滌兩遍后,根據總蛋白提取試劑盒說明書和核蛋白提取試劑盒說明書,6孔板中加入蛋白裂解液提取總蛋白和核蛋白。隨后用BCA蛋白濃度檢測試劑盒測定蛋白濃度,按照20 μg/20 μL的上樣體系進行蛋白配置并熱變性,隨后加入分離膠濃度為12 %的SDS-PAGE中,80~100V電泳。濕轉法轉移至0.22 μm的PVDF膜上,采用快速封閉液室溫封閉15 min,隨后加入抗Runx2、ALP、H3K9me3、H3、GAPDH的一抗(Runx2、ALP、H3K9me3和GAPDH按照1∶1 000比例稀釋;H3按照1∶2 000稀釋),4 ℃反應過夜,隨后用TBST洗膜5 min1次,連續6次,加入偶聯HRP的山羊抗兔二抗(按照1∶1 000比例稀釋)室溫孵育1 h,隨后TBST繼續洗膜6次每次5 min。隨后用ECL顯影液曝光拍照。
1.5 統計學處理
2 結果
2.1 細胞形態及轉染效率觀察
倒置相差顯微鏡下,SUV39H1轉染的C2C12細胞和帶有GFP的對照組細胞在形態上沒有發現明顯差異,細胞均表現為呈梭型。在綠色激發光下,SUV39H1過表達組和GFP對照組均呈現綠色。這說明C2C12細胞慢病毒轉染效率較高,見圖1。
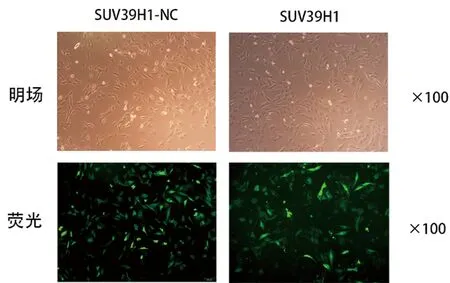
圖1 C2C12細胞SUV39H1轉染后細胞形態及轉染效率觀察Fig.1 Observation of cell morphology and transfection efficiency of C2C12 cells after SUV39H1 transfection
2.2 C2C12細胞SUV39H1過表達穩轉株鑒定情況
為了驗證C2C12細胞穩轉株的表達情況,我們首先進行qRT-PCR驗證,發現SUV39H1過表達組較對照組可以明顯提高SUV39H1的mRNA相對表達水平(P<0.05)。蛋白質免疫印跡結果同樣顯示SUV39H1過表達組與對照組比較可以明顯提高SUV39H1的蛋白表達水平(P<0.05)。這說明SUV39H1過表達穩轉株構建成功,見圖2。
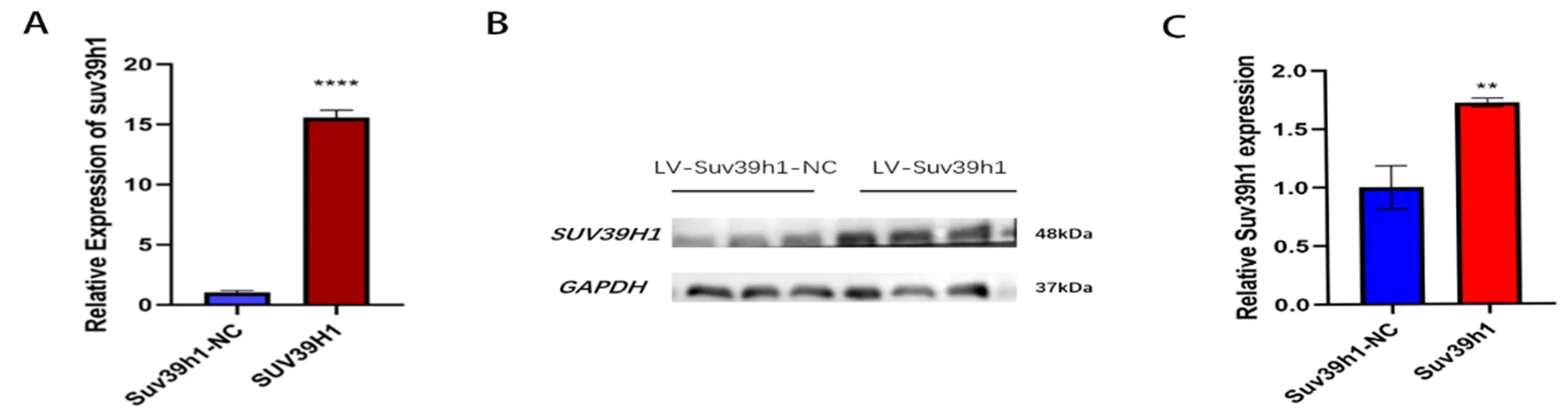
注:與SUV39H1-NC相比,**P<0.01,****P<0.0001。圖2 SUV39H1過表達穩轉株qRT-PCR和Western blot鑒定結果Fig.2 Identification of SUV39H1 over-expression strains by qRT-PCR and Western blotting
2.3 堿性磷酸酶染色
SUV39H1過表達組細胞和對照組細胞,在BMP2(100 ng/mL)成骨誘導液中誘導7 d,ALP染色顯示,SUV39H1過表達組染色較對照組明顯減弱,見圖3。

圖3 SUV39H1過表達對BMP2誘導的C2C12細胞堿性磷酸酶表達的影響Fig.3 Effect of SUV39H1 over-expression on BMP2-induced alkaline phosphatase expression in C2C12 cells
2.4 茜素紅染色
SUV39H1過表達組細胞和對照組細胞,在BMP2(100 ng/mL)成骨誘導液中誘導12 d,茜素紅染色染色顯示SUV39H1過表達組鈣化結節形成量較對照組少,見圖4。

圖4 SUV39H1過表達對BMP2誘導的C2C12細胞鈣鹽沉積的影響Fig.4 Effect of SUV39H1 over-expression on BMP2-induced calcium salt deposition in C2C12 cells
2.5 qRT-PCR檢測成骨及成肌相關基因的表達情況
qRT-PCR結果顯示SUV39H1過表達組Runx2、OCN基因的mRNA相對表達量均較對照組降低(P<0.05),其中ALP、OPN、MYOD基因的mRNA相對表達量較對照組顯著降低(P<0.01),見表2。
表2 qRT-PCR法檢測成骨及成肌相關基因mRNA表達結果
2.6 免疫熒光檢測RUNX2蛋白表達情況
兩組細胞成骨誘導7 d后進行免疫熒光檢測。檢測結果顯示SUV39H1過表達組Runx2蛋白表達熒光強度低于對照組(P<0.05),見圖5。
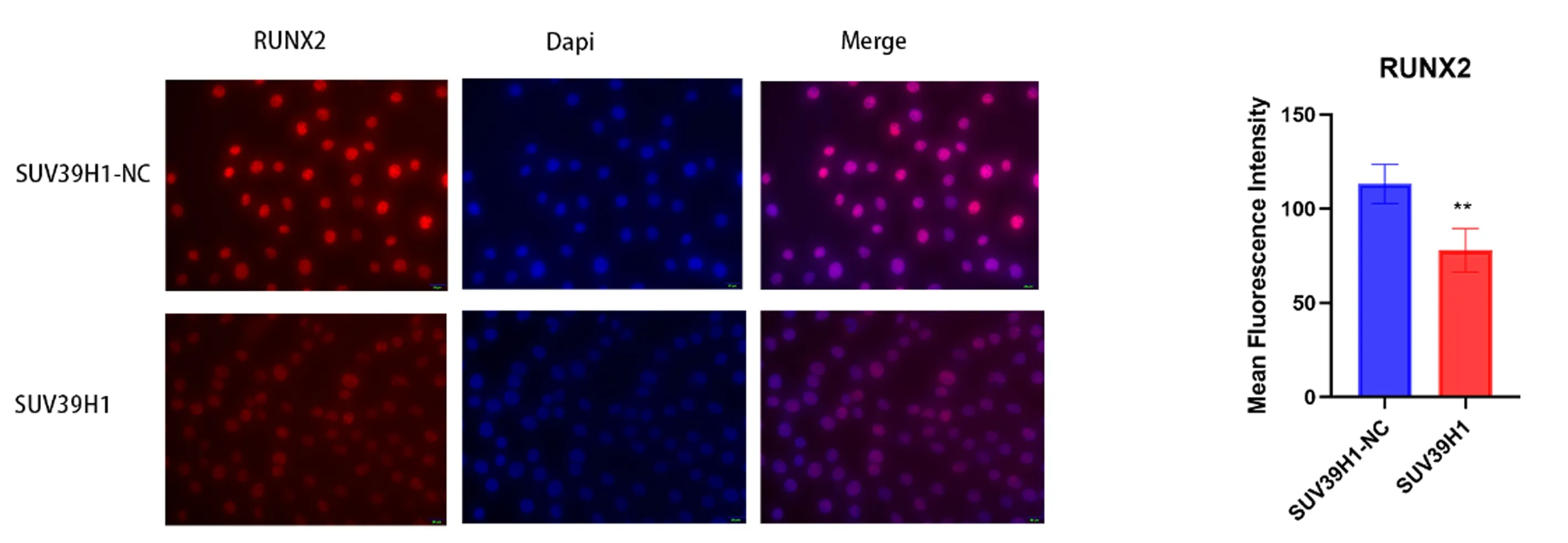
注:與SUV39H1-NC相比,**P<0.01。圖5 兩組細胞Runx2免疫熒光及熒光強度分析Fig.5 Runx2 immunofluorescence and fluorescence intensity analysis of two groups of cells
2.7 蛋白免疫印跡法(Western blot)檢測成骨相關蛋白表達情況
蛋白免疫印跡結果顯示,SUV39H1過表達以后成骨分化相關蛋白Runx2和ALP相對于過表達對照組表達明顯減弱,而H3K9me3表達增強。以上結果顯示隨著組蛋白H3的三甲基化水平增高會抑制相關成骨蛋白的表達,見圖6。
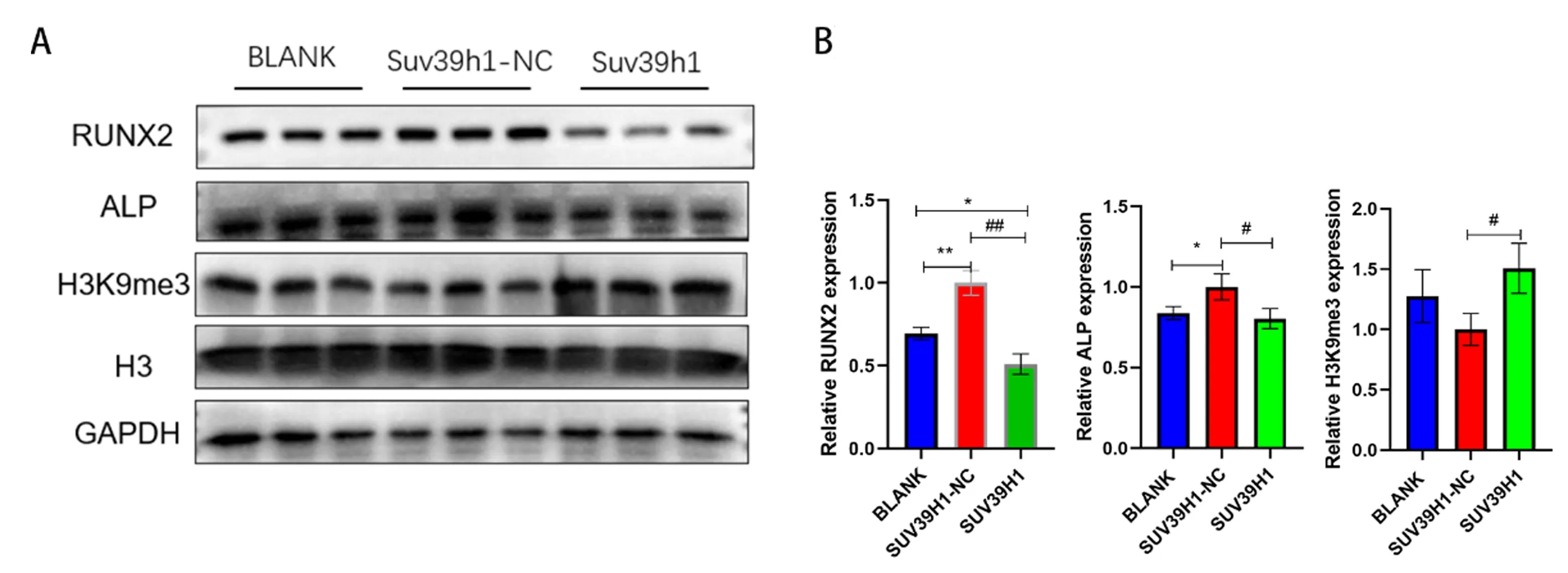
注:與 BLANK相比,*P<0.05,**P<0.01;與SUV39H1-NC相比,#P<0.05。圖6 蛋白免疫印跡法檢測成骨相關蛋白表達情況Fig.6 Protein immunoblotting for osteogenesis-related protein expressions
3 討論
既往對于骨缺損、骨不連的研究多關注自體骨移植和生物材料的應用[8-9],但是受制于供骨供應不足,移植物易于感染,生物材料應用的高失敗率等缺點,骨缺損和骨不連的臨床治療一直未能取得較大進展[10]。因此尋找合適的骨組織工程干細胞種子促進內源性修復是一種有前途的替代方案。肌干細胞作為間充質干細胞的一員,其成骨分化功能和治療潛質的研究進展讓我們看到了新的治療方向[11]。最新的研究[12-13]顯示肌源性干細胞不僅可以分化成軟骨和骨,直接參與骨折愈合,并且在骨膜損傷嚴重的情況下可以發揮更大作用。這可能是由于骨折產生的信號通過起旁分泌因子作用進而促進肌源性干細胞向成骨細胞分化[14]。肌肉不僅可以促進骨折端血管重建、提供骨生長因子來源、甚至本身可作為干細胞的來源潛在地影響骨折愈合[15]。相反通過A型肉毒毒素引起股四頭肌短期萎縮則可以導致大鼠股骨骨折愈合不良情況的出現[16]。鑒于肌肉在骨折愈合中發揮著重要作用,我們可以形容肌肉是骨折愈合中的第二層骨膜。因此,促進肌源性干細胞的成骨分化是治療骨折愈合不良的潛在方向。
SUV39H1作為組蛋白賴氨酸甲基轉移酶,能夠三甲基化修飾組蛋白H3第9位的賴氨酸殘基(H3K9me3),使目的基因的啟動子處于緊密折疊的狀態,從而不利于目的基因與轉錄因子、RNA聚合酶接觸,引起被修飾基因的轉錄沉默,常與異染色質形成有關[6,17]。組蛋白甲基化酶SUV39H1在成肌分化及癌癥領域的作用研究已經相當深入。組蛋白H3甲基轉移酶SUV39H1可以通過降低C2C12細胞MEF2C的表達抑制肌源性終末分化[18]。SUV39H1 在 MLL-AF9 誘導的 AML 進展中起腫瘤抑制作用[19]。SUV39H1 的抑制劑F5446 可以抑制人類結腸癌細胞的生長[20]。但是其在成骨誘導中的作用特別是肌干細胞成骨誘導中的作用還有待探索。
本研究中我們首先在C2C12細胞中構建SUV39H1過表達的穩轉株,使其能夠持續過表達SUV39H1。因此可以避免質粒瞬轉引起的假陽性結果。隨后用BMP2對C2C12過表達穩轉株進行成骨誘導。其形態有梭型逐漸轉變為圓形,并呈鵝卵石樣生長。說明成骨誘導成功。在隨后的Western blot、qRT-PCR、免疫熒光、ALP和茜素紅染色中我們發現SUV39H1高表達會降低Runx2、ALP等相關成骨蛋白的表達。這提示SUV39H1對BMP2誘導的C2C12細胞的成骨分化有一定的抑制作用。
綜上所述,本研究表明SUV39H1過表達可以抑制BMP2誘導的C2C12細胞相關成骨蛋白的表達,這為肌干細胞成骨分化表觀遺傳學的研究提供了相關實驗數據和理論支持。但是組蛋白甲基化酶SUV39H1具體通過調控哪些反式作用因子引起成骨表觀遺傳學改變的分子機制,以及如何應用SUV39H1促進肌干細胞向成骨分化的臨床應用是我們亟待回答的問題也是我們后面研究的重點。

