頸動脈粥樣硬化治療用藥規律及作用機制探析*
李珊珊,喻正科,趙夢雪,陳靜
1 湖南中醫藥大學 湖南長沙 410208
2 湖南中醫藥研究院附屬醫院 湖南長沙 410006
《中國心血管健康與疾病報告2020》[1]表明目前我國心血管疾病患病率仍有逐年上升的趨勢。動脈粥樣硬化是一種全身性疾病,是導致心腦血管疾病的病理基礎,涉及一條甚至多條血管,以血管內膜出現粥樣沉積物,管壁增厚,管腔狹窄為主要特征,早期雖無明顯臨床表現[2],但隨著病情進展,可能會危及生命。動脈粥樣硬化其危險因素較多,包括年齡、性別、吸煙史、飲酒史等,與高血壓、糖尿病、血脂異常、肥胖等疾病均有較大關聯[3]。現動脈粥樣硬化保守治療手段包括抗血小板聚集、降脂穩斑等,若管腔狹窄嚴重,則需手術治療。
頸動脈粥樣硬化(Carotid Atherosclerosis,CAS)是全身動脈粥樣硬化性疾病形成及演變的反應窗口[4],與心腦血管疾病存在相關性。其主要病位為頸部血管。CAS早期進展較為緩慢,通過控制危險因素、中醫藥干預等手段于疾病初期可逆轉病情,如若頸部動脈狹窄嚴重,斑塊不穩則可能危及生命。故而減輕動脈粥樣硬化及斑塊程度,有利于減少心血管系統疾病的發生,改善預后,降低危急重癥發生率及致死率。
資料與方法
1 數據來源及檢索方式
以“頸動脈粥樣硬化”“頸動脈斑塊”中英文為主題詞,“中醫”“中藥”“中西醫”中英文為副主題詞,主副主題詞之間以“AND”連接。檢索中國知網自2002年01月至2021年12月期間的所有相關文獻。
2 入組標準
2.1 納入標準 ①文獻明確符合頸動脈粥樣硬化診斷標準[5];②文獻為臨床隨機對照試驗,臨床療效明確,治療組患者療效優于單純常規西醫治療的對照組,且有統計學意義;③中藥口服治療,明確方劑的組成及用法,包含中藥湯劑及中成藥。
2.2 排除標準 ①排除非臨床研究試驗,如綜述類文獻、動物實驗研究類文獻、病例分析、專家經驗總結類文獻等;②藥物組成不完整的文獻;③雖有明確藥物組成,但屬敷貼、定向透藥等外治法的文獻;④療效評價標準不合理,研究結果無統計學意義的文獻;⑤中藥治療方案為同一中成藥的文獻或中藥湯劑藥物組成完全相同的文獻,僅取1篇。
3 中藥數據規范
參照《中華人民共和國藥典2020年版》[6]及《中藥學》[7]對文獻中所出現的中藥進行規范處理:①處方中應用簡化名稱、別名:如薏米、薏仁、苡仁等均統一為薏苡仁,仙靈脾統一為淫羊藿等;②中藥經炮制后,若為同一類藥物,則不予區分,如姜半夏、清半夏、法半夏統一為半夏等;若為非同一類藥物,如生地黃、熟地黃,則分別統計。③中藥性味歸經按《中華人民共和國藥典2020年版》統一規范。
4 數據處理
由兩人“背對背式”通過CNKI搜索文獻,閱讀初步篩選出的文獻,依照數據納入、排除及剔除標準獲得符合條件的文獻,進行預處理,如涉及爭議文獻則交由第三人處理,一人應用Excel記錄篩選與規范后的數據,后由三方共同校對查驗數據的正確性及非主觀性。
5 數據挖掘分析
將數據錄入中醫傳承輔助平臺v2.50“方劑管理”模塊,分別進行單藥分析、關聯規則分析及聚類分析,并獲得核心藥物組合。
6 獲取核心藥物靶點信息
通過TCMSP數據庫查找核心藥物的分子信息,以口服生物利用度(OB)≥30、類藥性(DL)≥0.18為標準篩選藥物活性成分,預測藥物可能作用靶點,并于Uniprot蛋白質數據庫規范靶點信息,獲得藥物作用靶點集合。
7 建立疾病相關靶點集合
以“Carotid atherosclerosis”為檢索詞在Genecards數據庫獲取CAS疾病的所有相關靶點,建立Excel文檔,以關聯系數(Relevance score)降序排序,關聯系數越大,則表明兩者間相對關聯度越大,設定關聯系數≥中位數,獲得合適的CAS疾病基因靶點集合。
8 構建藥物-活性成分-靶點-疾病網絡
利用jevnn平臺繪制venn圖并得到藥物及疾病靶點集合的交集靶點,將交集靶點與藥物活性成分相對應,應用Cytoscape 3.9.1構建藥物-活性成分-靶點-疾病網絡。
9 構建PPI網絡及核心靶點網絡
交集靶點導入String平臺,要求最低互動分數為0.40,刪除游離節點,構建PPI網絡,并得到相應信息tsv文件,文件導入Cytoscape 3.9.1,利用插件CytoCNA構建核心靶點網絡,以靶點≥Degree、Betweenness(BC)、Closeness(CC)、Eigenvector(EC)、LAC、Neighborhood Connectivity(NC)中位數為標準篩選2次,獲得核心靶點。
10 富集分析
在David平臺錄入藥物及疾病交集靶點,選擇智人類別,通過富集分析,探討CAS主要生物學過程及通路。
數據挖掘結果
本次研究分析共納入228個有效方劑,其中主要治療CAS的方劑為163個,主要治療CAS合并高血壓、腦梗死、糖尿病、冠心病的的方劑分別為35個、20個、12個、8個。
1 單味藥物分析
1.1 藥物頻次分析 所有處方共涉及214味中藥,總使用頻次為2080次,使用頻次前20的藥物分別為丹參、黃芪、川芎、半夏、水蛭、茯苓、甘草、三七、山楂、當歸、地龍、赤芍、澤瀉、白術、陳皮、牛膝、紅花、何首烏、天麻、葛根。見表1。
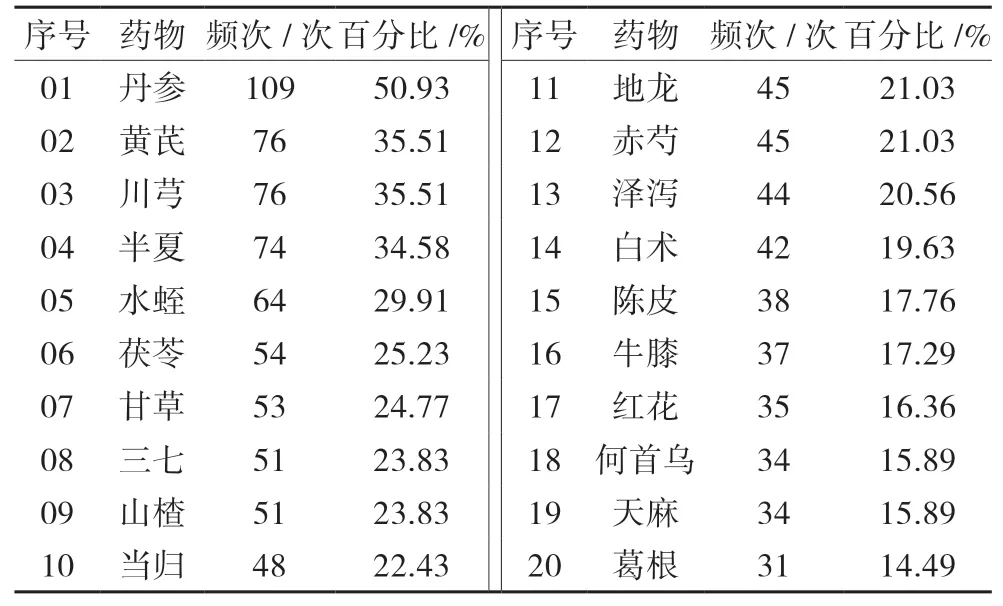
表1 治療CAS處方中使用頻次為前20的高頻中藥
1.2 藥物性味歸經分析 治療CAS處方中涉及的中藥:藥性以溫性為最多,藥味以甘、苦、辛為主,歸經以肝經(23%)、脾經(17%)、心經(13%)、胃經(12%)、肺經(11%)為主。見表2。
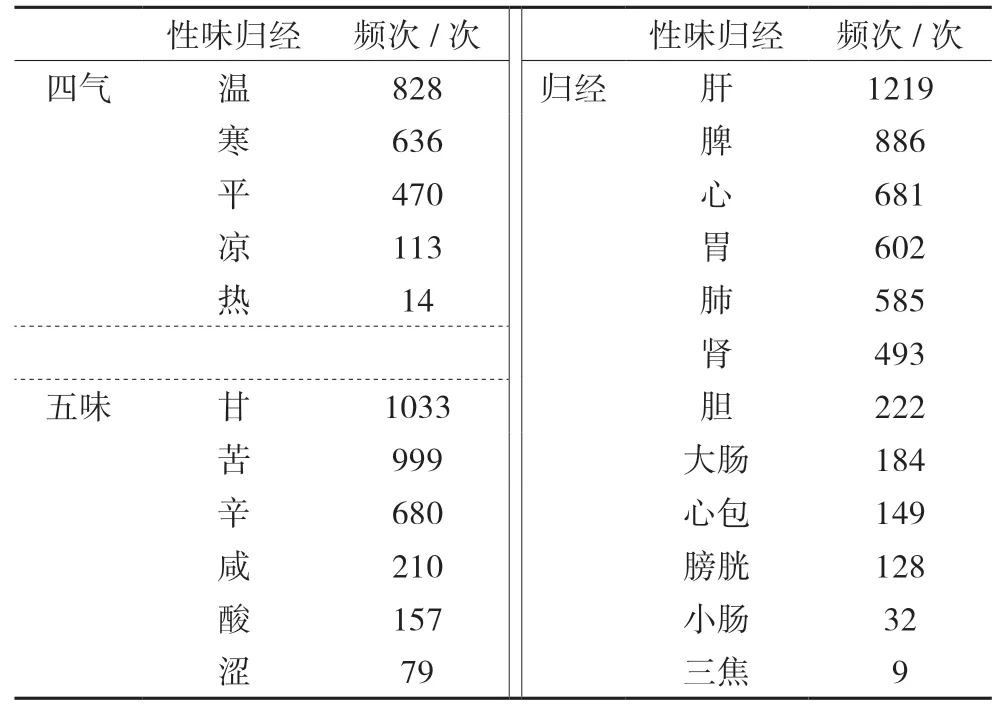
表2 治療CAS處方中中藥性味歸經頻次分布
1.3 關聯規則分析 設置支持度個數為23,置信度0.6,得到27個同時出現頻次≥23次的藥物組合,包括“丹參-黃芪”“川芎-丹參”“半夏-丹參”“半夏-茯苓”等。見表3。

表3 治療CAS處方中頻次≥23(次)的中藥組合
其中共涉及丹參、黃芪、川芎、半夏、茯苓、水蛭等16味中藥,可認為此16味中藥較為核心,其關聯關系經由網絡分析展示。見圖1。

圖1 藥物組合網絡分析圖
在此基礎上行進一步關聯規則分析,置信度越高,代表“->”左右的藥物于中藥處方中同時出現的概率越大。見表4。

表4 治療CAS處方中中藥關聯規則分析
1.4 聚類分析 設置相關度為8,懲罰度為8,通過聚類分析后得到潛在藥物組合14個。見表5。

表5 治療CAS處方中中藥潛在藥物組合
潛在藥物組合共組潛在處方7個,借由網絡分析圖展示。見圖2。
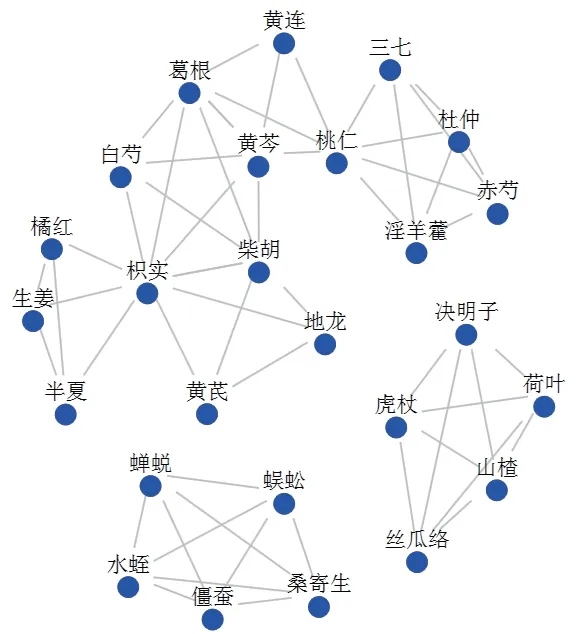
圖2 潛在組方網絡分析圖
2 網絡藥理學分析結果
基于數據挖掘分析,選取“丹參、黃芪、半夏、川芎、茯苓”組成核心藥物,以此進行網絡藥理學分析。
2.1 核心藥物作用靶點 核心藥物組合共獲得活性成分120個,剔除重復及未查詢到靶點的活性成分23個,總計97個活性成分,其中以丹參最多,包含59個活性成分。應用Uniprot蛋白質數據庫規范靶點信息,共獲得人源非重復的藥物可能作用靶點253個。
2.2 疾病基因靶點 以“Carotid atherosclerosis”為檢索詞在Genecards數據庫共獲取CAS疾病的所有相關靶點2099個,以靶點關聯系數≥其中位數“1.63”為標準獲得CAS疾病基因靶點1052個。
2.3 藥物-活性成分-靶點-疾病網絡 藥物作用靶點及疾病基因靶點分別導入jevnn平臺,并繪制venn圖。見圖3a。據此獲得藥物靶點及疾病靶點的交集128個,依交集靶點查詢五藥總計90個藥物活性成分起抗CAS作用,通過Cytoscape3.91構建藥物-活性成分-靶點-疾病網絡,圖中各節點面積越大,則代表其連接度越大,所起作用愈加顯著。丹參治療CAS的有效成分最多,其次為黃芪、半夏,其中以Mol000098(槲皮素)、Mol000006(木犀草素)、Mol000422(1.7-二羥基-3.9-二甲氧基紫檀烯)、Mol007154(丹參酮IIA)等活性成分作用較為顯著。見圖4。
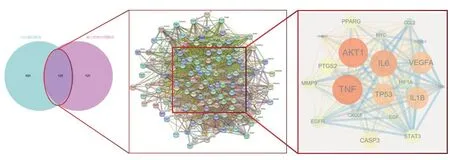
圖3 a venn b基于String平臺的PPI網絡 c核心靶點網絡
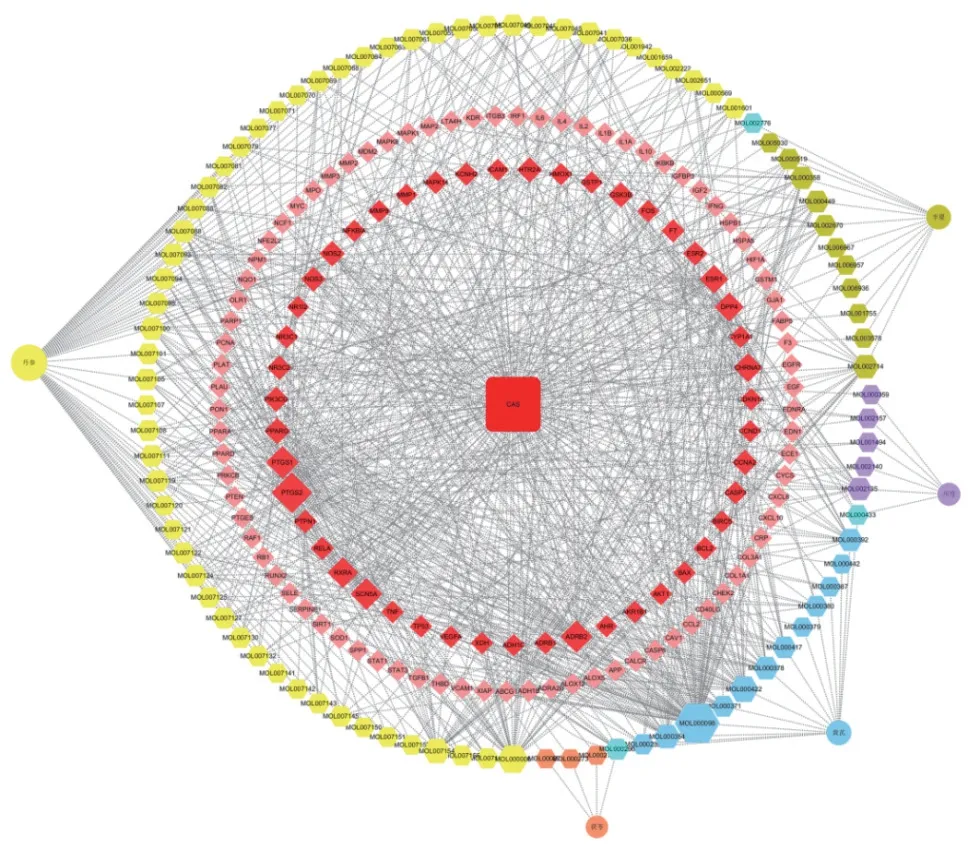
圖4 藥物-活性成分-靶點-疾病網絡
2.4 PPI及核心靶點網絡 通過String數據庫平臺構建PPI網絡,分析靶點蛋白與蛋白間相互作用,其中未見游離節點,包含128個節點,2624條無向連線。見圖3b。應用Cytoscape 3.9.1插件CytoCNA分析構建核心靶點網絡,計算得到Degree、BC、CC、EC、LAC、NC中位數行兩次篩選,共得到核心靶點20個,可合理認為靶點其Degree值越大,則與其他靶點的關聯度越大,愈加重要,其中最為核心的靶點包括TNF(腫瘤壞死因子)、AKT1(絲氨酸/蘇氨酸蛋白激酶)、IL6(白細胞介素6)、VEGFA(血管內皮生長因子A)等。見圖3c,表6。

表6 核心靶點
3 富集分析
3.1 生物進程分析 2.3中獲取的交集靶點進一步分析,共得到生物學過程(biological process,BP)、細胞組分(cellular component,CC)、分子功能(molecular function,MF)986條,以P<0.05且FDR<0.05篩選后余518條,以P值升序排序,BP前10條目包括:細胞因子介導的信號通路(cytokine mediated signaling pathway)、凋亡過程負調控(negative regulation of apoptotic process)、細胞增殖正性調節(positive regulation of cell proliferation)等;由CC可見CAS疾病主要是發生在細胞外,前10通路中extracellular space、extracellular region、cell surface均屬此意;此外該病也作用于大分子復合物(macromolecular complex)、核質(nucleoplasm)等;MF富集較為顯著的包括蛋白質結合(protein binding)、轉錄因子結合(transcription factor binding)、酶結合(enzyme binding)等。見圖5。
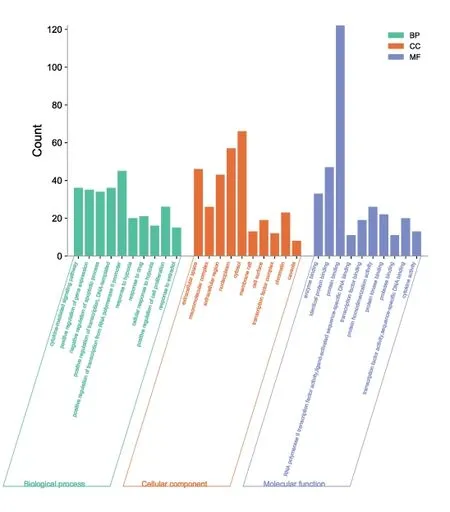
圖5 生物進程分析圖
3.2 KEGG分析 KEGG分析共得到162條通路,以P<0.05且FDR<0.05篩選后共計151個通路,以P值升序為序可見篩選前20條通路,可見:核心藥物較為富集化的通路包括癌癥的途徑(Pathways in cancer)、AGE-RAGE信號通路在糖尿病并發癥中的作用(AGE-RAGE signaling pathway in diabetic complications)、脂質和動脈粥樣硬化(Lipid and atherosclerosis)、流體剪切應力和動脈粥樣硬化(Fluid shear stress and atherosclerosis)等。見圖6。
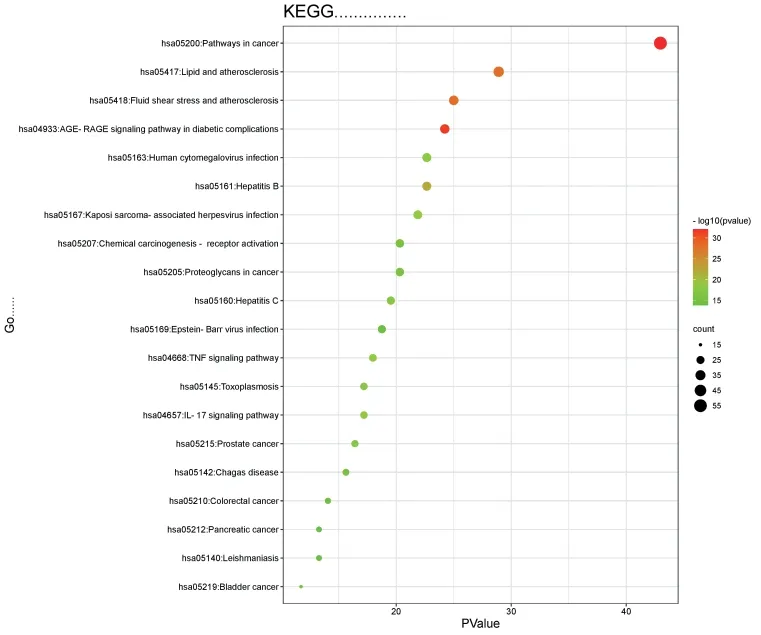
圖6 KEGG分析氣泡圖
討 論
1 病因病機
《靈樞·經脈第十》言“脈道以通,氣血乃行”“經脈者,所以能決死生,處百病,調虛實,不可不通”,脈道通利對人機體有著重要作用,脈管阻塞,血液運行不暢,五臟六腑無充足的血液滋養,則生理機能受損。心主血脈,脈道通利為心臟正常生理功能運行的必要條件之一。古代中醫學沒有明確提出頸動脈粥樣硬化并斑塊形成這一疾病,國醫大師朱良春認為其屬于“脈痹”范疇,乃“本虛標實”之證:本虛為脾腎虧虛,脾氣不足,氣血生化乏源,水液輸布代謝失常[8];標實為痰瘀互結,朱老認同痰濕瘀致病學說,指出動脈硬化及斑塊形成的核心與痰瘀二邪緊密相關。《動脈粥樣硬化中西醫防治專家共識(2021年)》[2]認為CAS是由于先天稟賦不足、久食肥甘厚味、七情內傷、勞倦等多種因素致使五臟生理機能受損,氣血陰陽虧虛,即本虛,繼而形成痰濕、血瘀、氣滯、寒凝、熱毒等病理因素,痰、濕、瘀血又再次成為機體的致病因素,日久則邪氣聚于脈道,不散而結聚成塊,此為標實。本研究在此病因病機基礎上,通過分析臨床治療CAS的用藥規律,進一步討論不同病理因素致病的針對性用藥,以期提供參考。
2 數據挖掘分析
治療CAS的中藥藥性以溫寒平為主,藥味以甘苦辛為主。寒邪收引筋脈、熱毒生風動血,均為導致CAS的病機,寒涼者熱之寒之,溫熱者寒涼治之,為辨證論治基礎,平味藥物作用和緩,若寒熱病機不甚明顯,不失為良好選擇。甘味藥補益和中,CAS本屬虛癥,氣虛為根本,甘味藥如黃芪、甘草等,多甘溫或甘平,補中氣,行血有力,益脾氣,水液輸布暢達。利水消腫類如茯苓、澤瀉等亦甘淡為主。苦味藥能泄能燥,疏理條暢氣機,苦寒清濕熱,苦溫除寒濕。辛味藥行散之力峻,行氣、行血,治療氣血阻滯功效較強,理氣藥、活血化瘀類藥物多味辛,三棱、莪術、水蛭、虻蟲等破血消癥類藥物走而不守,藥味均屬辛苦。歸經以肝、脾、心、胃、肺經多見。肝疏泄全身氣機,促進血液津液運行;脾主運化,運化水谷,通調水道;心主血脈,推動血液行于脈中,助脈道通利,血流順暢;肺朝百脈,肺氣宣發肅降推動一身之氣、水液及血液的正常運行;胃又稱“水谷氣血之海”,為機體的一切生理活動提供能量。
治療CAS的藥物中使用頻次較多的藥物為丹參、黃芪、川芎、半夏、茯苓、水蛭等。丹參屬活血化瘀類中藥,《本草綱目》謂其能“破宿血,生新血”,主治“寒熱積聚,破癥除瘕”。現代藥理學研究認為丹參可通過多成分多靶點起到抗CAS作用。黃芪性甘溫,歸脾肺二經,為補益脾氣之要藥,兼行滯通痹。氣虛則行血無力,血行不暢,流滯脈絡,日久則生瘀血及斑塊。《本經疏證》言黃芪“利營衛之氣,故凡營衛間阻滯,無不盡通”,補益脾氣,行血化瘀,故標本同治。川芎善治氣滯血瘀,古稱其“血中氣藥”。茯苓健脾利水,脾氣居中樞運轉津液,脾氣充足,水液方能運行順暢。水蛭、地龍均為蟲類藥物,善于走竄,通經活絡力強,水蛭亦可破血逐瘀,消癥積。水蛭主要成分為水蛭素,地龍主要成分為蚓激酶、蚓膠質酶、纖維蛋白溶解酶等,兩種藥物可通過不同的代謝途徑阻止凝血因子的活化,均能有效抑制血小板聚集、抗凝抗栓、改善血液流變學、降低血脂等[9-10]。
藥物組合分析圖中共涉及到16味中藥,據藥物功效,大致分為7類:1)活血化瘀類:丹參、川芎、水蛭、三七、紅花、赤芍;2)補益氣血類:黃芪、甘草、當歸、白術;3)利水滲濕類:茯苓、澤瀉;4)理氣類:陳皮;5)化痰類:半夏;6)消食類:山楂;7)通經活絡類:地龍。可見CAS的治療以補氣、活血化瘀為主,同時根據兼證的不同,輔以行氣、利濕、化痰等。其中“丹參”“半夏”“川芎”“黃芪”“茯苓”五種藥物與其他關聯較多。近半數藥物組合含有丹參,“丹參-黃芪”為使用頻率最高的藥物配伍,可用于氣虛血瘀證型CAS。川芎、丹參、黃芪為三藥組合,在補氣活血基礎上加以行氣,以防過補反致氣滯。“黃芪-當歸”,這一藥對見于李東垣名方當歸補血湯,方中當歸及黃芪含有阿魏酸、黃芪甲苷及毛蕊異黃酮等藥理成分,可以促進并調控大鼠體內脂質代謝,促進膽固醇的排泄,抑制頸動脈粥樣硬化及斑塊的形成[11]。
聚類分析后共得到7個潛在藥物組方:方1:黃芩、黃連、葛根、桃仁:乃葛根黃芩黃連湯去甘草加桃仁,此方可用于治療熱毒血瘀證型,其中葛根、黃芩、黃連均具清熱解毒之功,桃仁活血,可治瘀血蓄積之癥瘕痞塊;方2:白芍、黃芩、葛根、枳實、柴胡:為大柴胡湯的基礎用藥,本方較方2清熱力弱,但消斑塊功用更甚,枳實為行氣通塞要藥,與葛根、白芍配伍,破氣活血,通經活絡;方3:半夏、枳實、橘紅、生姜:半夏白術天麻湯之基礎方,半夏、橘紅、生姜皆可燥濕化痰,橘紅,枳實都屬理氣藥物,善治氣滯痰凝所致CAS;方4:水蛭、蜈蚣、蟬蛻、僵蠶、桑寄生:《素問·陰陽應象大論》“血實者宜決之”,本方多為蟲類藥物,功擅化瘀消癥,搜絡剔邪,藥性峻猛。但是蟲類藥多屬有毒之品,臨床應用時應對藥物用量予以把握,不可過量反戕伐正氣;方5:決明子、虎杖、山楂、荷葉、絲瓜絡:方中虎杖、決明子潤腸通便,山楂、荷葉化濁降脂,對于形體肥胖的CAS患者具有良好的治療效果;方6:三七、桃仁、赤芍、淫羊藿、杜仲:方中杜仲、淫羊藿溫陽,補益肝腎,配以活血化瘀,本方可用于陽虛血瘀證型CAS。
3 網絡藥理學分析
基于數據挖掘分析,合理認為CAS多見“氣虛血瘀、痰濕內停”證型,故擬“丹參-黃芪-川芎-半夏-茯苓”這一核心藥對。
中藥具有多成分、多靶點的治療優勢,中藥復方可通過不同成分間的相互作用治療疾病。西醫認為CAS發病機制包括脂質浸潤學說、血小板聚集及血栓形成學說、內皮損傷-反應學說、炎癥學說等。TNF、IL-6、IL1B均為炎性因子,三者在血管內協同作用促使血管內皮因子的產生[12],山柰酚、槲皮素、隱丹參酮、木犀草素等均可作用于TNF,槲皮素為黃芪抗CAS重要活性成分之一,江揚[13]等研究認為槲皮素可以抑制LDL誘導的內皮細胞氧化損傷,亦可以通過ceRNA調控氧化應激情況,多方干預動脈粥樣硬化的形成及發展。丹參活性成分木犀草素可以抑制炎癥生成、抑制氧化應激反應、抑制TLR-4/NF-κB信號通路,起到抗CAS作用[14-15];丹參酮IIA其分子結構與膽固醇高度相似,通過競爭機制抑制膽固醇在血管內的沉積,降脂及保護血管內皮細胞,從而抑制CAS形成[16]。VEGFA為VEGF家族的一個亞型,能促進血管內皮細胞的分裂與增生,在CAS形成過程中具有較強的調節作用[17],研究認為VEGF在人體多脂組織中的表達顯著高于低脂組織,更易致動脈硬化及斑塊形成[18]。
核心藥物作用于機體主要作用于細胞外組分,調控細胞增殖、細胞凋亡、細胞因子介導反應等以抗CAS形成。通過分析KEGG通路,認為大部分通路均與炎癥相關,如:IL-17信號通路、NF-κB信號通路,慢性炎癥持久刺激血管內表皮細胞,使其增生,內膜增厚;脂質和動脈粥樣硬化通路、脂肪細胞中脂解的調節等部分通路屬脂質代謝性,LDL將脂質由肝臟轉移至血管內,血管內脂肪代謝障礙,沉積于血管內皮,導致粥樣斑塊形成;補血及凝血通路作用于血栓調節素(THBD)、凝血因子VII(F7)、尿激酶型纖溶酶原激活鏈(PLAU)、內皮纖溶酶原激活物抑制劑(SERPINE1)、組織型纖溶酶原激活鏈(PLAT)、凝血因子III(F3),血管內皮細胞受損時,血小板凝集于血管局部,凝血酶作用使纖維蛋白原轉化為纖維蛋白,而形成血栓[19],核心藥物可通過該通路調控體內凝血系統,而抑制粥樣硬化的形成。此外還有流體剪切應力和動脈粥樣硬化通路、血管內皮生長因子信號通路、鈣信號通路等多種通路。
核心藥對“丹參-黃芪-川芎-半夏-茯苓”主要是通過調控體內脂質代謝及炎癥反應抗CAS,而其中起到最主要功效當屬“丹參-黃芪”藥對。

