用硝酸從電解質廢渣中浸出鋰試驗研究
馬興娟,費發源,雷占昌,馬福寶,李學蓮
(青海省核工業檢測試驗中心 青海省核工業核地質研究院,青海西寧 810016)
工業上,鋁是通過冶金級氧化鋁和冰晶石在電解槽內熔融電解得到的[1-4]。為提高鋁電解電流效率,降低能耗,電解體系內通常需要添加氟化鋰等鹽[5-6],由此會產生含鋰的電解質廢渣,其中鋰質量分數在2%左右,具有回收價值。
目前,從電解質廢渣中浸出鋰,通常采用硫酸[7-8],但鋰回收率相對較低。試驗針對某電解鋁企業的電解質廢渣,研究了用硝酸浸出鋰,并探討了浸出動力學,以期為電解鋁企業電解質廢渣中鋰的綜合回收提供可行方法。
1 試驗部分
1.1 試驗原料、試劑及儀器
電解質廢渣:取自國內某鋁廠,其中鋰質量分數1.96%,化學組成見表1,物相組成如圖1所示。電解質廢渣的主要物相為氟化鋰、冰晶石及氟化鈣。氟化鋰難溶于水,但可溶于酸。

表1 電解質廢渣的化學組成 %
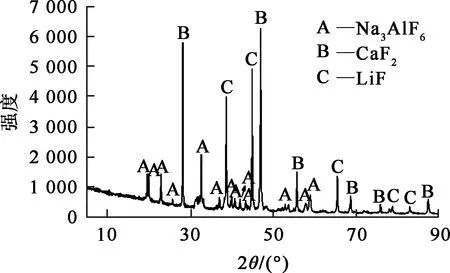
圖1 電解質廢渣的物相分析結果
主要試劑:硝酸,分析純。
主要儀器:X射線衍射儀(X’Pert MPD型,荷蘭帕納科公司),電感耦合等離子發射光譜儀(6300型,賽默飛世爾科技公司)。
1.2 試驗原理與方法
氟化鋰在硝酸溶液中可以溶解,化學反應為

(1)
冰晶石也會與硝酸反應生成硝酸鋁,但冰晶石與酸之間的反應不影響鋰的浸出,只增加硝酸耗量。
浸出試驗在玻璃三口燒瓶中進行,溫度由恒溫水浴控制。將電解質廢渣與不同濃度硝酸溶液按一定液固體積質量比混合后,攪拌同時加熱,在40~80 ℃條件下反應一段時間后,懸浮液降溫并過濾。濾液稀釋后采用電感耦合等離子體發射光譜儀測定鋰質量濃度,計算鋰浸出率。
2 試驗結果與討論
2.1 硝酸濃度對鋰浸出率的影響
在溫度40 ℃、液固體積質量比10 L/1 kg、浸出時間2 h條件下,用硝酸浸出鋰,硝酸濃度對鋰浸出率的影響試驗結果如圖2所示。
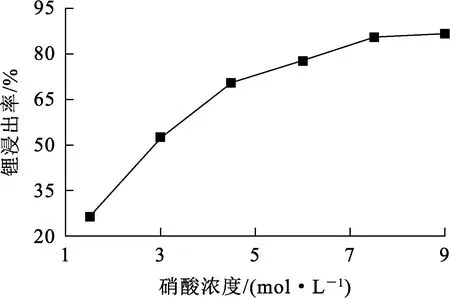
圖2 硝酸濃度對鋰浸出率的影響
由圖2看出:隨硝酸濃度增大,鋰浸出率升高;硝酸濃度增大至7.5 mol/L時,鋰浸出率達85.27%;之后繼續增大硝酸濃度,鋰浸出率略有升高,變化不大。考慮到硝酸濃度增大會增加生產成本,所以,確定硝酸濃度以7.5 mol/L為宜。
2.2 液固體積質量比對鋰浸出率的影響
在溫度40 ℃、硝酸濃度7.5 mol/L、浸出時間2 h條件下,液固體積質量比對鋰浸出率的影響試驗結果如圖3所示。
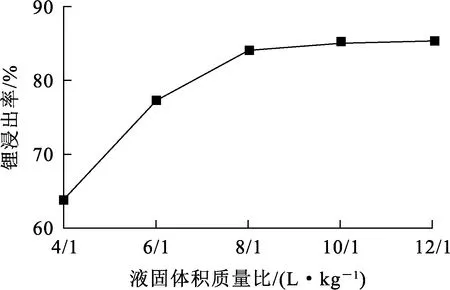
圖3 液固體積質量比對鋰浸出率的影響
由圖3看出:隨液固體積質量比增大至8 L/1 kg,鋰浸出率提高至84.27%;液固體積質量比繼續增大,鋰浸出率提高幅度不大。隨液固體積質量比增大,體系黏度降低,有利于反應傳質;但液固體積質量比增大會增加后續液固處理成本:綜合考慮,確定液固體積質量比以8 L/1 kg為宜。
2.3 浸出溫度與時間對鋰浸出率的影響
在硝酸濃度7.5 mol/L、液固體積質量比8 L/1 kg 條件下,浸出溫度與時間對鋰浸出率的影響試驗結果如圖4所示。

圖4 浸出溫度與時間對鋰浸出率的影響
由圖4看出:鋰浸出率隨反應時間延長、溫度升高而升高;在反應前45 min內,隨溫度升高,鋰浸出率迅速升高;反應60 min后,鋰浸出率變化不大;而隨溫度升高,鋰浸出率有所提高。升溫有利于分子擴散,加快反應速率;但溫度過高,硝酸會揮發,會增大能耗:綜合考慮,確定適宜溫度和浸出時間分別為70 ℃和60 min,此時鋰浸出率為91.90%,浸出效果較好。
2.4 浸出動力學
硝酸浸出鋰的反應屬于液-固相反應,適于采用縮芯模型解釋。液-固反應通常受表面化學反應控制或內擴散控制。當反應過程受內擴散控制或表面化學反應控制時,其浸出率x與反應時間t之間的關系分別見式(2)、(3)[9-13]:
(2)
(3)
反應溫度為40 ℃時,對不同浸出時間條件下鋰的浸出率分別用式(2)、(3)擬合,得到擬合曲線如圖5所示。
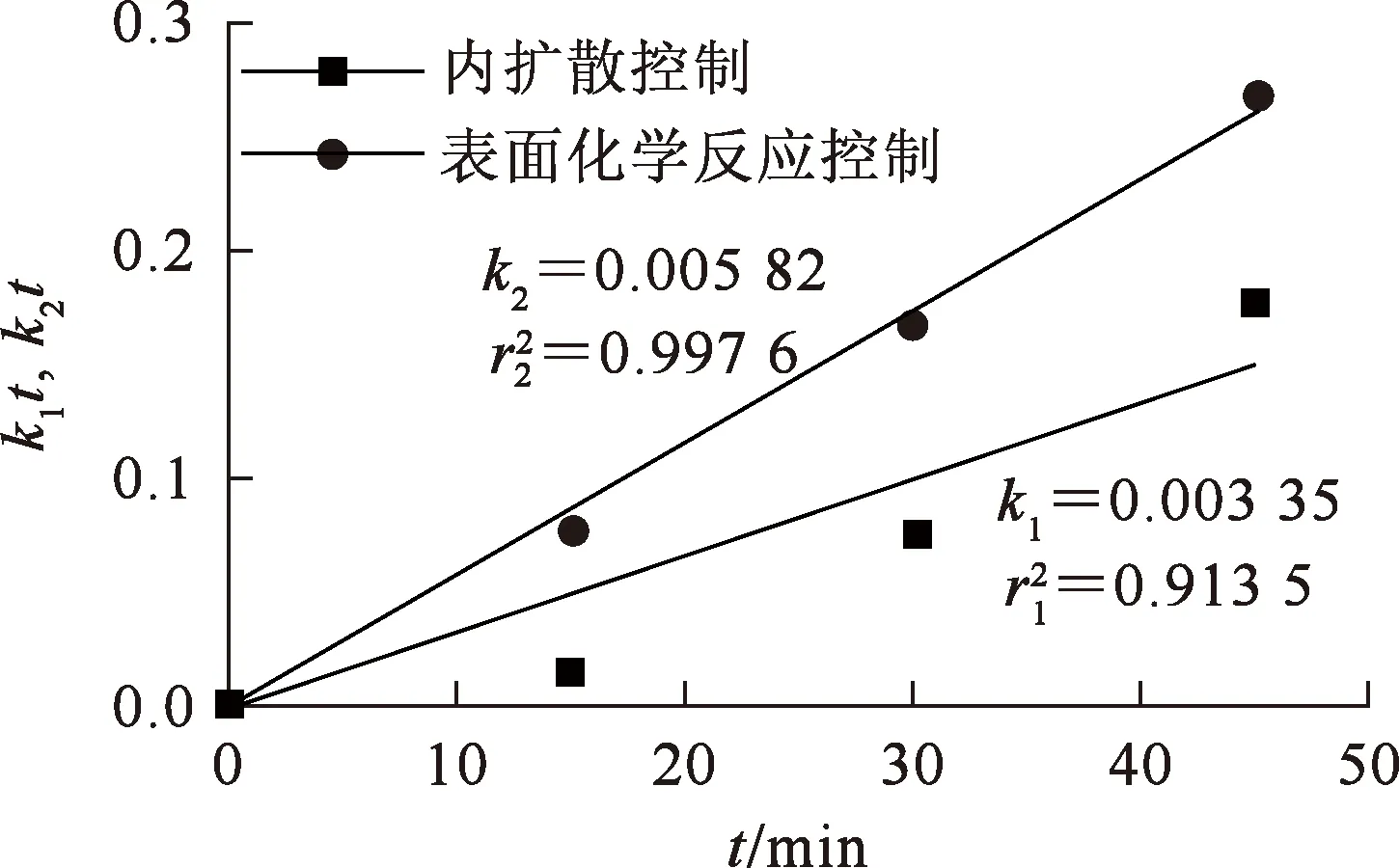
圖5 表面化學反應控制和內擴散控制動力學擬合曲線
由圖5看出:式(3)曲線的擬合度為0.997 6,明顯高于式(2)曲線的擬合度,可以初步判定浸出反應過程受表面化學反應控制。根據Arrehenius方程:
(4)
(5)
由反應速率常數k與熱力學溫度T之間的關系,可以計算反應活化能Ea。根據式(3),不同溫度下浸出率x與浸出時間t的擬合曲線如圖6所示,圖中曲線斜率為反應速率常數k。lnk與1/T的擬合曲線如圖7所示。

圖6 不同溫度下與t之間的擬合曲線
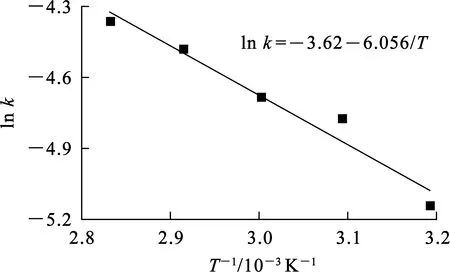
圖7 ln k與1/T之間的擬合曲線
根據曲線斜率和截距,Ea=50.3 kJ/mol,A= 0.026 8;Ea>40 kJ/mol[14],可以推斷浸出過程受表面化學反應控制。因此,硝酸浸出鋰的動力學方程為
(6)
3 結論
用硝酸從電解鋁中產生的電解質廢渣中浸出鋰是可行的,適宜條件下,鋰浸出率可達91.90%,浸出反應受表面化學反應控制,反應活化能為50.3 kJ/mol。

