晚期高級別漿液性卵巢癌患者血清sCD276水平與腫瘤免疫浸潤及預后的關系
周葉,邢秀月,李曉麗,王麗娜,陳美君,溫林燕
[1.瓊海市人民醫院 婦科,海南 瓊海 571400; 2.海南省人民醫院(海南醫學院附屬海南醫院) 婦產科,海南 海口 570311; 3.中南大學湘雅醫學院附屬海口醫院 婦產科,海南 海口 570208]
卵巢癌是全球女性第七大最常見的癌癥類型,也是我國女性癌癥相關死亡的主要原因之一[1]。在診斷時多數上皮性卵巢癌(EOC)患者已進展至中晚期,腹腔內腫瘤負荷高且廣泛,常伴有惡性腹水,導致5年總生存率僅為20%~30%[1- 2]。與其它多種實體癌一樣,EOC患者也表現出強烈的免疫反應[3]。最近的研究表明,腫瘤浸潤淋巴細胞(TILs),例如從血管滲出進入實體瘤微環境的CD8+T細胞,可能是黑色素瘤[4]、結直腸癌[5]、食管癌[6]等腫瘤的陽性預測因子。TILs同樣影響EOC患者的預后[7]。調節性叉頭狀轉錄因子P3+(Foxp3+)T細胞(Treg)和B7家族與腫瘤免疫逃逸有關,然而目前關于B7家族成員與EOC臨床結局的關系尚存有爭議[8],這為免疫檢查點抑制劑的臨床應用帶來了困難。其中B7- H3(即CD276)被證實能夠增加活化T細胞γ- 干擾素(IFN- γ)的分泌以及Foxp3產物白細胞介素- 10(IL- 10)、轉化生長因子- β(TGF- β)和腫瘤壞死因子- α(TNF- α)的產生[9]。雖然TILs與相關細胞因子之間存在相關性,但對它們之間的相互作用尚未達成共識。因此,為了評估局部和全身的術前免疫反應,我們研究高級別漿液性卵巢癌(HGSOC)患者TILs的表現與血清細胞因子水平的關系,以確定血清可溶性CD276(sCD276)是否在HGSOC中起作用,探討其對HGSOC患者免疫環境的影響。
1 對象與方法
1.1 研究對象
本項臨床研究按照《赫爾辛基宣言》中概述的原則進行。在獲得書面知情同意后,從入組人群中采集血樣。該研究獲得了瓊海市人民醫院機構審查委員會的批準。對2015年7月至2016年7月期間收集的87例晚期卵巢癌患者的臨床資料進行回顧性分析,包括51例晚期HGSOC,16例子宮內膜樣亞型,9例黏液性亞型,7例透明細胞亞型,4例低級別漿液性卵巢癌。所有血液樣本均在診斷時(治療前)采集。59例患者在樣本采集后進行新輔助化療和間隔去瘤術,28例患者在首次減瘤術后進行輔助化療。手術標本在病理科進行組織學評估。所有患者均根據FIGO分期系統進行分期[10],包括FIGO ⅢC期61例,Ⅳ期(即癌轉移期或更高)26例;術后所有患者均接受標準卡鉑+紫杉醇方案化療。無進展生存期(PFS)定義為從卵巢癌診斷到復發或死亡的時間。總生存期被定義為從診斷為卵巢癌到死亡的時間。對于無復發的患者,在死亡時或最后1次隨訪時對數據進行審查。另外納入同時期20例年齡與晚期HGSOC患者相匹配的健康志愿者作為健康對照組。
1.2 血清sCD276和其他細胞因子水平檢測
采用ELISA法測定所有研究對象血清sCD276、IL- 6、IL- 10、IL- 17A、IFN- γ、TNF- α及TGF- β水平。
1.3 組織標本獲取及免疫組化染色
手術標本用4%福爾馬林固定,石蠟包埋,蘇木精- 伊紅- 藏紅花(HES)染色。由兩名經驗豐富的病理學專家對每個組織學標本的切片進行審查以確認診斷和分級。每例患者選擇具有代表性的HES玻片,必須包含腫瘤組織和相鄰基質。將福爾馬林固定的石蠟包埋塊切成5 μm的切片,檢測細胞表面CD3、CD4、CD8、CD80(B7- 1)、CD86(B7- 2)、CD276(B7- H3)和FoxP3(Treg標記物)。將玻片去蠟后滴加檸檬酸緩沖液(pH6.0)后,用高壓法進行抗原熱修復。用ABC試劑盒進行組織化學染色。滴加單克隆抗體后在4 ℃下孵育載片。用0.3%過氧化氫阻斷內源性過氧化物酶活性。所有抗體的反應性均通過辣根過氧化物酶(HRP)標記的聚共軛二級抗體和二氨基聯苯胺顯示。切片用蘇木精反染,脫水,用蓋玻片封片。
1.4 組織樣本評估[11]
所有染色組織樣本由兩名研究人員在不知道患者的臨床記錄的情況下進行評估。一個樣本隨機分成4個腫瘤區域,放大倍數為400倍。染色細胞百分率以陽性細胞計數除以陽性細胞與陰性細胞計數之和的平均百分率計算。使用NIS Elements軟件(Nikon)分析所有區域,并計數陽性染色細胞。根據染色情況將標本分為低表達組和高表達組兩組。CD3、CD4、CD8的臨界值設為20%,CD80、CD86、CD276和Foxp3臨界值設為10%。CD276以腫瘤細胞膜免疫反應陽性為標志。
1.5 統計學處理

2 結 果
2.1 血清sCD276水平與晚期卵巢癌患者預后的關系
與健康對照組相比,晚期卵巢癌患者血清sCD276水平顯著升高[(429±73.8) pg·ml-1vs.(234.6±28.1) pg·ml-1,P<0.05]。根據晚期卵巢癌患者血清sCD276水平中位值將患者分為<516 pg·ml-1亞組和≥516 pg·ml-1亞組,繪制Kaplan- Meier生存曲線,對于全部晚期卵巢癌患者,2個亞組患者無病生存期比較,差異無統計學意義(P>0.05,圖1A)。然而對于晚期HGSOC患者,≥516 pg·ml-1亞組患者無病生存時間和總生存時間短于<516 pg·ml-1亞組患者(P<0.05,圖1B、C),且無病生存時間<12個月的晚期HGSOC患者血清sCD276水平高于無病生存時間≥12個月的晚期HGSOC患者[337(97.85~739.60) pg·ml-1vs. 236.05(75.23~487.90) pg·ml-1,P=0.009,圖1D]。

A.血清sCD276水平與晚期卵巢癌患者的Kaplan- Meier分析;B.血清sCD276水平與晚期HGSOC患者無病生存的Kaplan- Meier分析;C.血清sCD276水平與晚期HGSOC患者總生存的Kaplan- Meier分析;D.晚期HGSOC患者根據無病生存時間(<或≥12個月)分層的血清sCD276水平(a P<0.05)圖1 晚期卵巢癌患者血清sCD276水平與預后的關系
2.2 單因素和多因素COX回歸分析影響晚期HGSOC預后的指標
單因素分析顯示,累及淋巴結、術后殘余病灶、Foxp3+≥10%、血清sCD276水平≥516 pg·ml-1與復發和死亡風險相關(P<0.05)。多因素分析顯示,術后殘余病灶、Foxp3+≥10%、血清sCD276水平≥516 pg·ml-1是晚期HGSOC患者復發和死亡風險增加的獨立危險因素(P<0.05)。見表1。
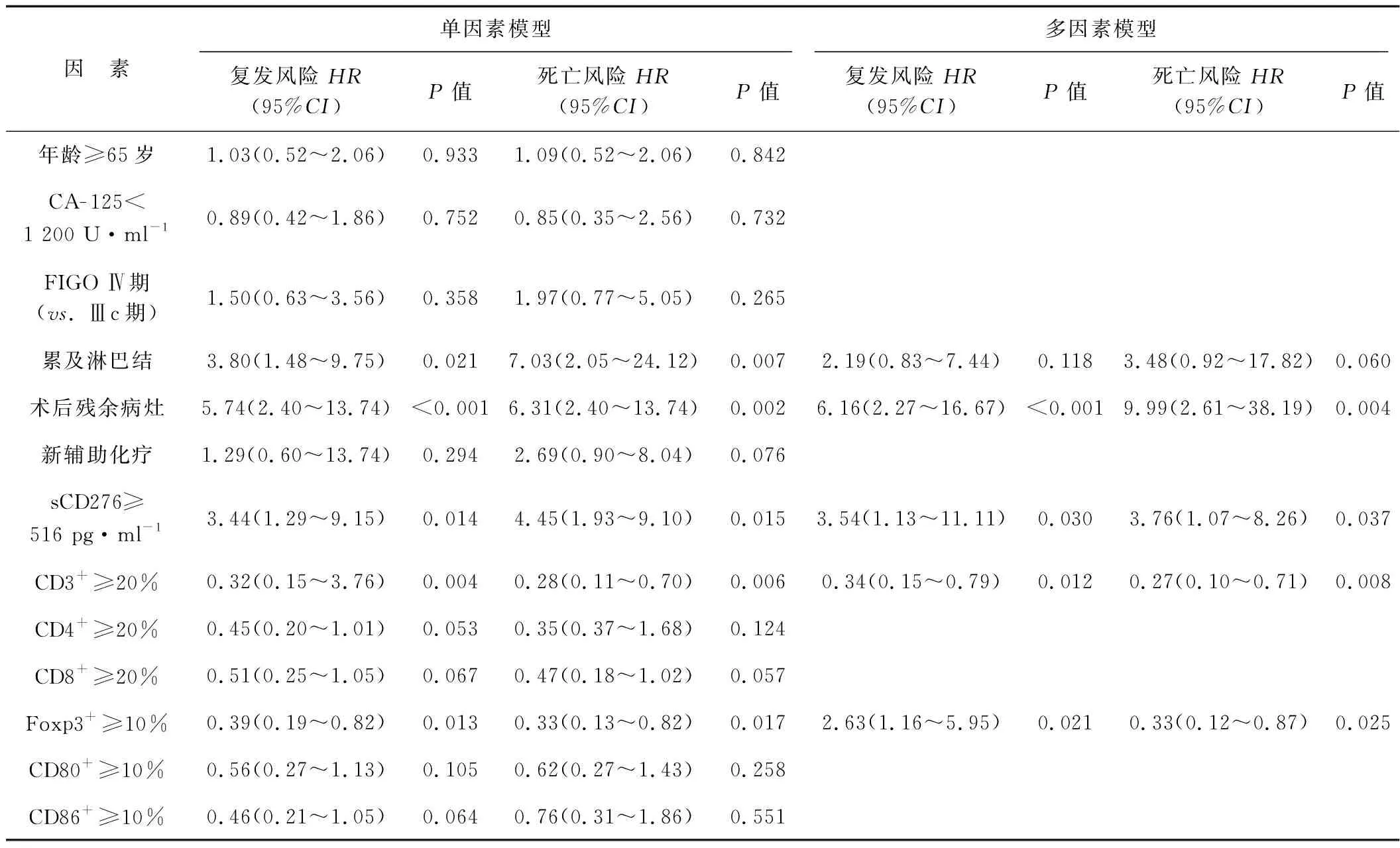
表1 晚期HGSOC患者復發或死亡風險的單因素和多因素COX回歸模型分析
2.3 晚期HGSOC患者血清sCD276水平與臨床特征的關系
血清sCD276水平≥516 pg·ml-1的晚期HGSOC患者淋巴結受累率更高(P=0.023,表2)。

表2 血清sCD276水平與晚期HGSOC患者臨床特征的關系
2.4 晚期HGSOC腫瘤組織膜CD276表達與血清sCD276水平、TILs的關系
通過對腫瘤切片進行免疫組化分析,41例(80.39%)晚期HGSOC患者發現了CD276膜表達陽性。膜CD276+表達與血清sCD276水平升高和Foxp3+表達有關(P<0.05,圖2、表3),與CD3+、CD4+、CD8+、CD80+、CD86+表達無關(P>0.05,表3)。
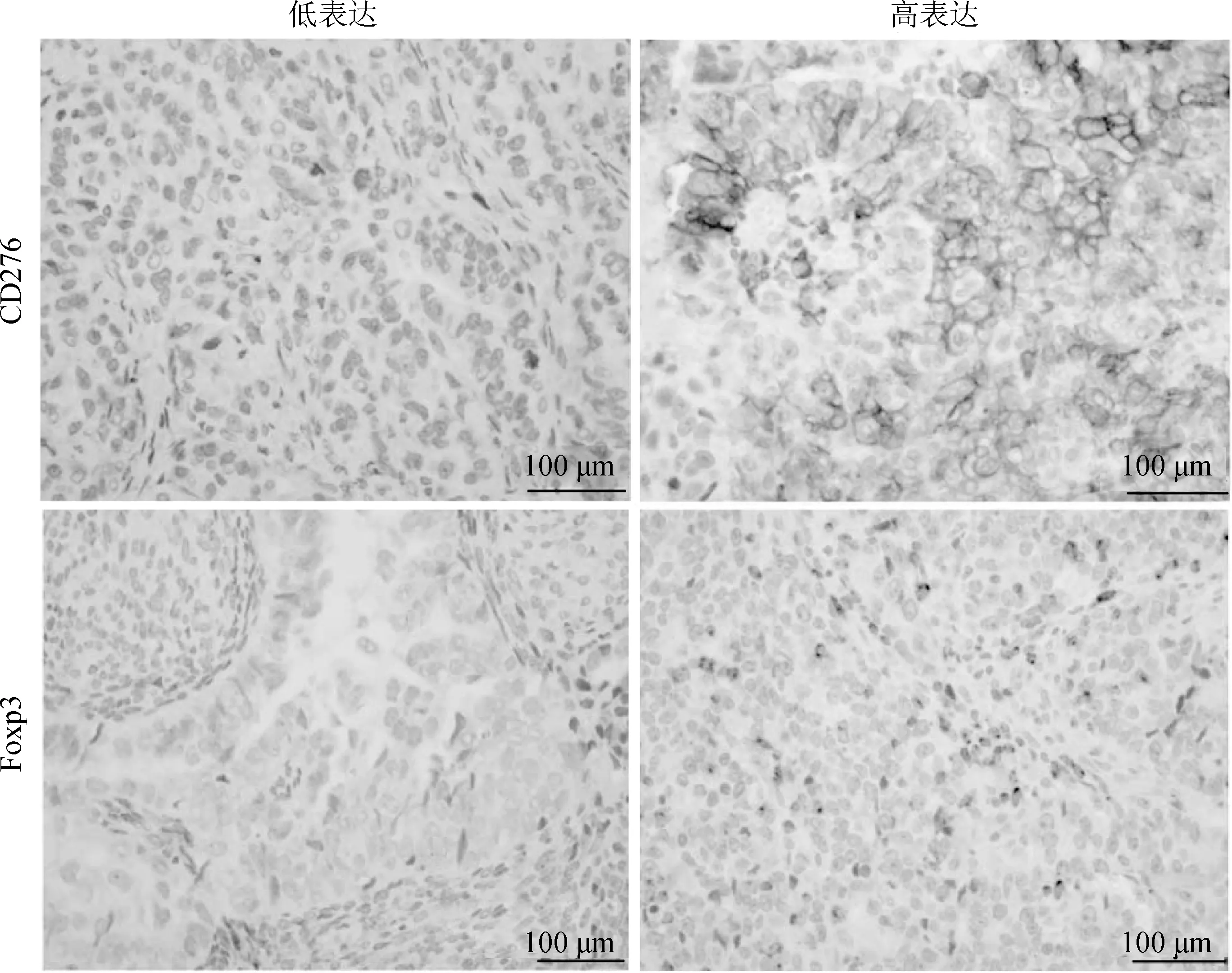
圖2 CD276和Foxp3在晚期HGSOC腫瘤組織中的表達情況 ×200
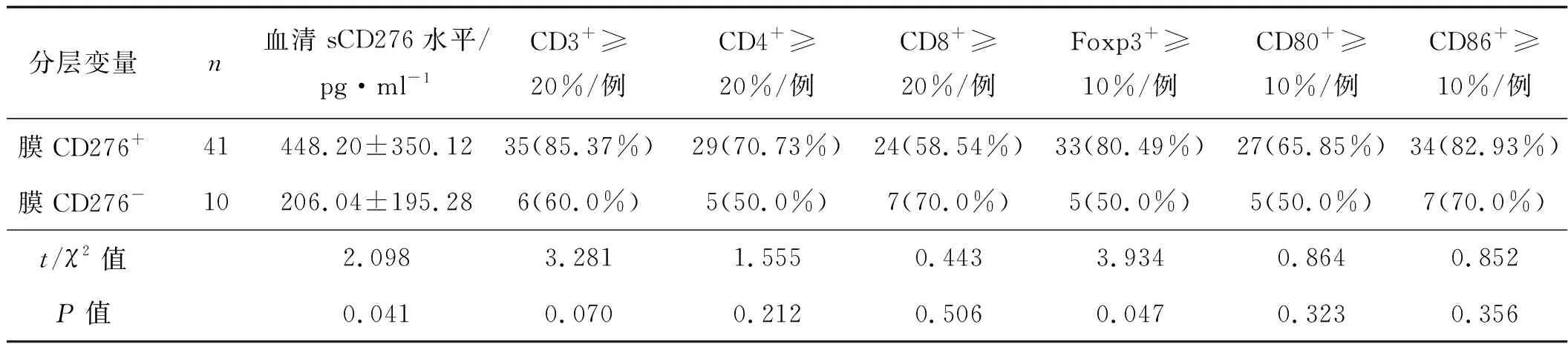
表3 基于CD276膜表達免疫組化結果分析晚期HGSOC腫瘤組織TILs計數情況
2.5 晚期 HGSOC腫瘤組織CD276表達與血清細胞因子水平的關系
根據免疫組化分析結果,膜CD276+表達與血清TNF- α、IFN- γ水平增加有關(P<0.05,表4)。
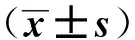
表4 晚期HGSOC腫瘤組織CD276膜表達與患者血清細胞因子水平的關系 pg·ml-1
3 討 論
在本研究中,我們發現腫瘤組織中CD276+表達是晚期HGSOC患者復發或預后不良的獨立危險因素。此外,高sCD276水平與腫瘤組織Foxp3+細胞浸潤數量增加以及血清TNF- α、IFN- γ水平升高相關。結果表明血清sCD276在HGSOC患者的腫瘤免疫反應中起調節作用,因此可能是腫瘤免疫浸潤的無創性標志物。這樣的標志物檢測可以避免腫瘤活檢,在患者復發時組織活檢是很困難的。
免疫檢查點調節劑,如PD- 1/PD- L1或CTLA4抗體不會募集淋巴細胞,但會破壞免疫抑制,從而恢復細胞毒性T細胞活性。事實上,PD- 1/PD- L1阻斷對免疫浸潤的腫瘤更有效。PD- 1/PD- L1抗體僅在20%~30%的復發性卵巢癌患者中觸發客觀腫瘤反應[12]。到目前為止,沒有生物標志物與高應答率密切相關,盡管腫瘤細胞和免疫細胞上的PD- L1表達可用于選擇對PD- 1/PD- L1治療更有可能應答的患者[13]。然而,需要病理學樣本來評估這些生物標志物。此外,由于癌癥的異質性,此類樣本可能無法反映疾病。因此在將來可以設想一種個性化方法,在HGSOC患者初始治療后根據免疫因子的表達擬定個體化治療方案。sCD276作為腫瘤免疫浸潤的替代標志物,可用于選擇HGSOC患者進行免疫治療試驗。PD- 1/PD- L1檢查點抑制劑對于免疫細胞浸潤程度高的卵巢癌患者的臨床療效優于免疫反應低的患者這一結論仍有待證明[14]。到目前為止,卵巢癌免疫治療試驗的結果仍然令人失望。Mesnage等[15]研究表明,新輔助化療增加了某些HGSOC患者的腫瘤免疫浸潤。因此血清sCD276作為腫瘤免疫浸潤的標志物可能使我們能夠監測新輔助化療期間的免疫反應,并在新輔助化療后觀察到強烈的腫瘤免疫浸潤時選擇患者進行免疫治療。
盡管我們的數據樣本量較少,但本研究的一個優勢是我們只選擇了HGSOC和FIGO Ⅲ~Ⅳ期(即癌病期或腫瘤腹膜擴散)患者,這避免了與其他具有不同分子突變的卵巢癌亞型的混淆(如黏液性、子宮內膜樣或透明細胞卵巢癌)。我們觀察到HGSOC、黏液癌或子宮內膜樣癌患者的生存率與血清sCD276水平之間無相關性,這與其他一些研究[7,16]結論有差異,推測可能是這些研究缺乏免疫細胞標志物和異質性。此外,采用免疫組化實驗從這些嚴格納入患者的腫瘤組織中鑒定了幾種類型的免疫表型標志物,即Foxp3、CD4、CD8以及B7家族分子。結果顯示膜CD276+表達與Foxp3+表達有關,而Foxp3+≥10%和血清sCD276水平≥516 pg·ml-1均與晚期HGSOC患者復發和死亡風險相關。
Foxp3屬于轉錄因子叉頭盒家族,是Treg分化的主基因,也是在Treg中特異性表達的轉錄因子。Foxp3存在于腫瘤微環境中,是一種通過干擾T細胞增殖來控制抗腫瘤免疫的負性因子。在肺癌[17]、乳腺癌[18]、肝癌[19]等實體腫瘤中,腫瘤浸潤性Foxp3+淋巴細胞表達與預后不良有關。CD276是B7家族的一員,通過其配體傳遞共刺激或共抑制信號來調節免疫反應,但是其功能及結合配體尚未闡明。腫瘤浸潤性CD276陽性淋巴細胞與一些癌癥的預后不良相關,包括肺癌[20]、結腸癌[21]、腎癌[11]等。據報道,B7- H3共同刺激CD4+和CD8+T細胞的增殖,增強細胞毒性T細胞的誘導,并在T細胞受體信號轉導的存在下選擇性地刺激IFN- γ的產生。在本研究中,膜CD276+表達與血清TNF- α、IFN- γ水平升高有關,說明CD276膜表達增加可誘導T細胞向Treg分化,分泌免疫抑制性細胞因子,進而增加T細胞介導的腫瘤逃逸,從而導致患者預后不良。因此,治療前血清sCD276水平可作為晚期HGSOC患者復發或死亡的潛在危險分層標志物。
總之,晚期HGSOC患者血清sCD276水平升高與腫瘤組織浸潤性Foxp3+T細胞數量增加和預后不良有關,且腫瘤組織膜CD276+表達者血清TNF- α、IFN- γ水平普遍升高,血清sCD276水平可作為晚期HGSOC患者危險分層的簡單無創生物標志物。

