乳腺癌組織胰島素受體底物 -1、胰島素受體底物 -2表達及其與患者臨床病理特征的關系研究
關 霞,趙穎潔
(四川省婦幼保健院病理科,四川 成都 610041)
乳腺癌是一種發生在乳房腺上皮組織的惡性腫瘤,患者早期沒有典型癥狀,容易與乳腺增生和乳腺纖維瘤混淆,不易引起重視。隨著病情進展,其可能出現周圍淋巴結轉移,也可以通過血行轉移,到達肺、腦等重要的生命器官,嚴重威脅患者生命安全。有研究顯示,多種基因的異常表達和機體微環境眾多細胞因子的相互作用與乳腺癌的轉移、疾病進展密切相關[1]。胰島素受體底物-1(IRS-1)、胰島素受體底物-2(IRS-2)均屬于胰島素受體絡氨酸激酶底物家族中的成員,參與多種細胞因子的信號轉導,通過與受體結合發生自身磷酸化為下游信號轉導提供結合位點,從而激活下游轉導通路[磷脂酰肌醇3激酶(PI3K)、絲裂原活化蛋白激酶(MAPK)等信號通路],調控細胞的生長、存活、分化及代謝,且高表達時可使細胞發生癌變,參與腫瘤的發生、發展[2-3]。本研究旨在探討IRS-1、IRS-2在乳腺癌組織中的表達情況,及其與患者臨床病理特征的關系,以期為臨床上診治乳腺癌提供參考,現報道如下。
1 資料與方法
1.1一般資料回顧性分析四川省婦幼保健院2019年8月至2021年7月收治的60例乳腺癌患者的臨床資料,分別取其乳腺癌組織標本與乳腺癌癌旁正常組織標本進行檢測。診斷標準:參照《中國抗癌協會乳腺癌診治指南與規范(2017年版)》[4]中的相關診斷標準。納入標準:符合上述診斷標準,并經病理學檢測確診;未接受放化療治療;行乳腺癌根治術治療者;臨床資料完整者等。排除標準:既往有惡性腫瘤史或伴隨其他惡性腫瘤者;合并急、慢性炎癥疾病或基礎疾病者;影像學檢查存在可疑遠處轉移;合并血液系統、免疫系統疾病者等。四川省婦幼保健院醫學倫理委員會已批準此研究。
1.2研究方法
1.2.1標本采集于乳腺癌根治術術中切除病灶組織,并采集距離病灶組織大于5 cm的癌旁正常組織2~3塊(經病理診斷確診無癌細胞殘留),30 min內使用濃度4%的多聚甲醛溶液進行固定1~2 d,使用乙醇脫水后再使用甲苯溶液對切片進行清洗,石蠟包埋制作成組織蠟塊。
1.2.2免疫組化檢測對組織蠟塊進行連續切片(厚度:4 μm),并將組織切片貼附在預先處理的載玻片上,隨后將其放在60 ℃干燥箱中進行烘烤2 h,室溫保存;使用二甲苯進行脫蠟和梯度酒精進行水化處理;在室溫避光下,使用3%過氧化氫處理10 min,山羊血清封閉(濃度10%)孵育30 min;磷酸鹽緩沖鹽溶液(PBS)浸泡2次,5 min/次。分別加入單克隆抗體,對照組以PBS代替一抗4 ℃孵育過夜,室溫復溫(45 min) →二抗(37 ℃孵育20 min) →三抗(37 ℃孵育20 min);在1滴二氨基聯苯胺顯色液與1滴親和素生物素過氧化物酶復合物(約50 μL)的混合液中加入1 mL雙蒸水并混勻,在顯微鏡下觀察切片組織顏色和強度適中后,立即使用自來水終止顯色,蘇木素復染細胞核5 min,中性樹膠封片。使用全自動熒光免疫分析儀(Radiometer Medical ApS,型號:AQT90 FLEX)檢測IRS-1、IRS-2表達水平。細胞染色情況通過顯微鏡進行判定,同時統計其表達情況。由兩名病理科醫師對所有病理切片的免疫組化染色情況進行觀察確認。
1.2.3免疫組織化學染色結果判定標準IRS-1與IRS-2高表達:呈棕黃色或棕褐色,根據標本染色強度[無著色(0分,陰性)、淺黃色(1分,弱陽性)、棕黃色(2分,陽性)、棕褐色(3分,強陽性)]及范圍[棕黃色染色范圍≤ 25%為1分,25% < 染色范圍≤ 50%為2分,50% < 染色范圍≤ 75%為3分,染色范圍 > 75%為4分]判定,免疫組化評分=染色強度×染色范圍, ≤ 1分為低表達,>2分為高表達(5~8分、9~12分別為中度陽性、強陽性)[5]。
1.3觀察指標①觀察乳腺癌組織與乳腺癌癌旁組織IRS-1、IRS-2表達情況。②分析乳腺癌組織IRS-1、IRS-2陽性表達與患者臨床病理特征的關系。其中臨床病理特征包括組織學分期(Ⅰ、Ⅱ、Ⅲ期)、腫瘤直徑(<2 cm或≥ 2 cm)、淋巴結轉移(有或無)、T分期[T1:腫瘤最大直徑≤ 20 mm;T2:20 mm<腫瘤最大直徑≤ 50 mm;T3:腫瘤最大直徑>50 mm]、N分期[N0:無區域淋巴結轉移;N1~2:同側Ⅰ、Ⅱ級腋窩淋巴結轉移,可移動(N1)、同側Ⅰ、Ⅱ級腋窩淋巴結轉移,固定或融合(N2);N3:同側鎖骨下淋巴結(Ⅲ級腋窩淋巴結)轉移,伴或不伴Ⅰ、Ⅱ級腋窩淋巴結轉移][6];組織學分期標準:按照腺管形成[腺管形成>75%(1分),10% ≤腺管形成≤ 75%(2分),腺管形成<10%(3分)]、核的多形性[1分(與腫瘤周圍正常乳腺組織比較,細胞規則,核小或稍大)、2分(較正常上皮細胞大,有中度異形性,可見空泡核及核仁)、3分(瘤細胞有明顯的多形性,可見巨核及畸形核)]及核分裂計數[核分裂計數評估,在細胞生長活躍區,計數10個高倍視野(400×),然后算出每10個高倍視野的核分裂數(1分:0~1個;2分:2~3個;3分:>3個] 3項總分進行評估,總分為3者之和,3~5分為Ⅰ級,6~7分為Ⅱ級,8~9分為Ⅲ級[7]。
1.4統計學方法采用SPSS 22.0統計學軟件分析數據,計數資料使用[ 例(%)]表示,行χ2檢驗,多組間比較采用χ2趨勢檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1乳腺癌組織IRS-1、IRS-2表達情況乳腺癌組織中IRS-1、IRS-2的高表達率均顯著高于乳腺癌旁組織,差異均有統計學意義(均P<0.05),見表1。IRS-1、IRS-2在乳腺癌組織中均有廣泛表達,呈棕褐色,陽性細胞占比≥ 51%,定位于細胞漿內,見圖1-A、圖1-B。
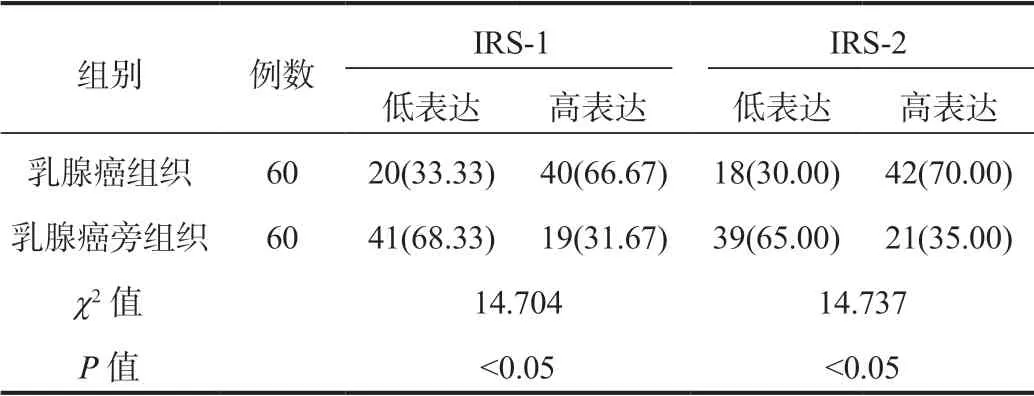
表1 乳腺癌組織中組織IRS-1、IRS-2表達情況比較[ 例(%)]
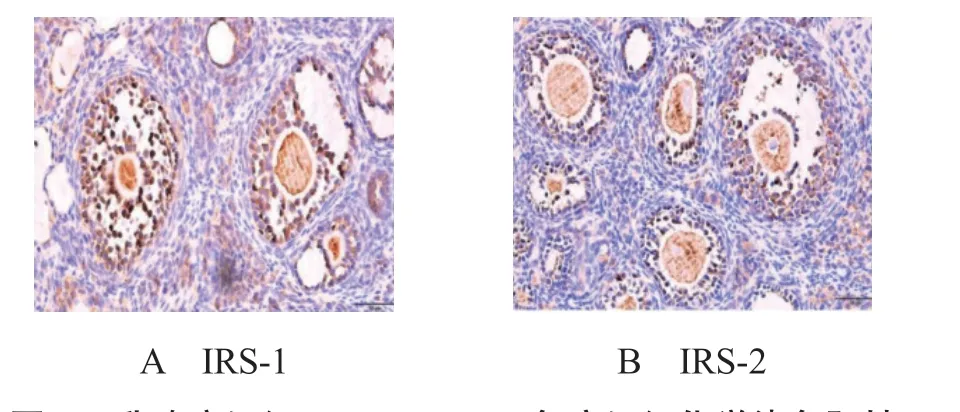
圖1 乳腺癌組織IRS-1、IRS-2免疫組織化學染色陽性圖片(×200)
2.2乳腺癌組織IRS-1、IRS-2表達與患者臨床病理特征的關系乳腺癌組織IRS-1、IRS-2高表達患者中T3期、N3期占比均顯著高于IRS-1、IRS-2低表達患者,差異均有統計學意義(均P<0.05),見表2、表3。
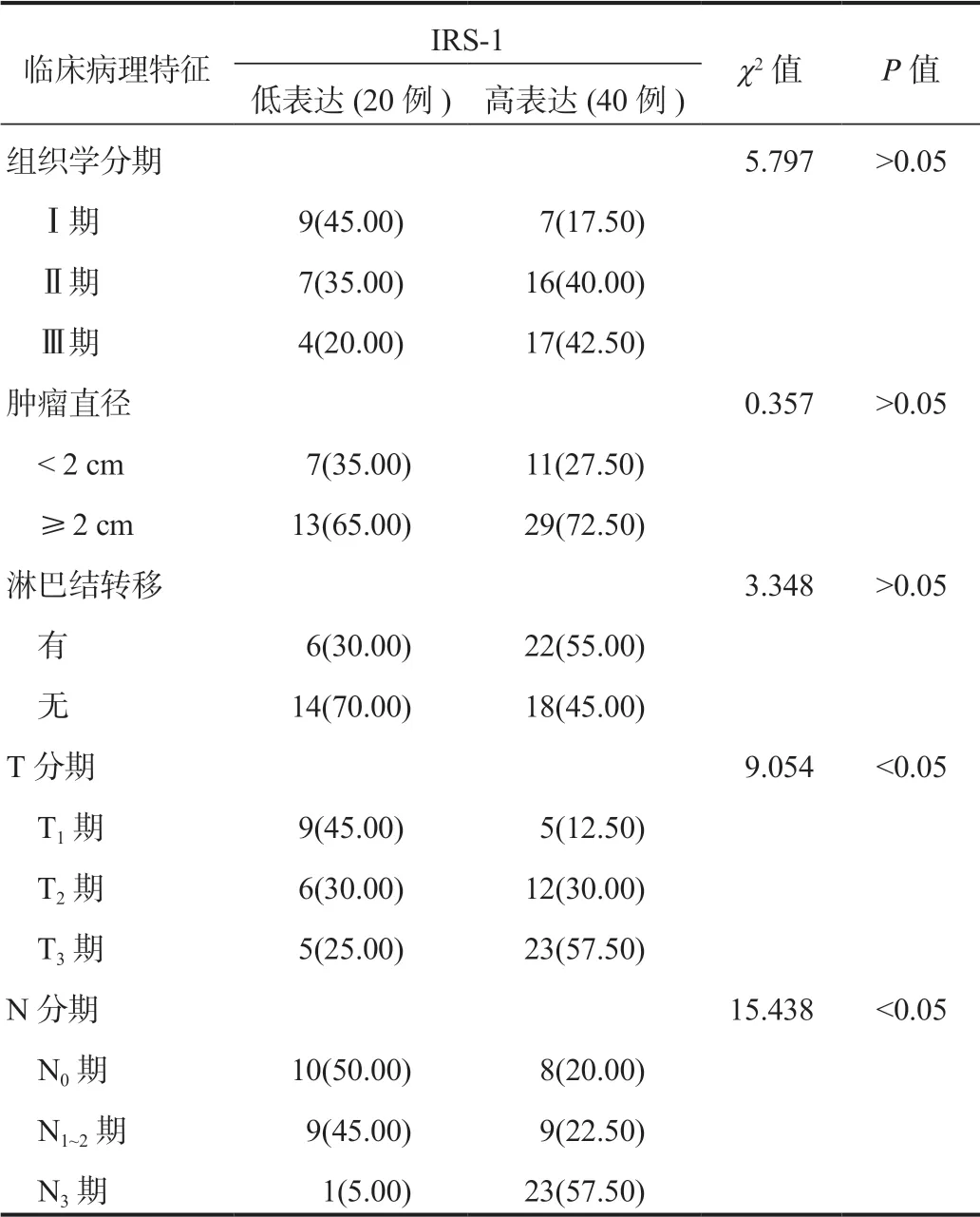
表2 乳腺癌組織IRS-1表達與患者臨床病理特征的關系[ 例(%)]
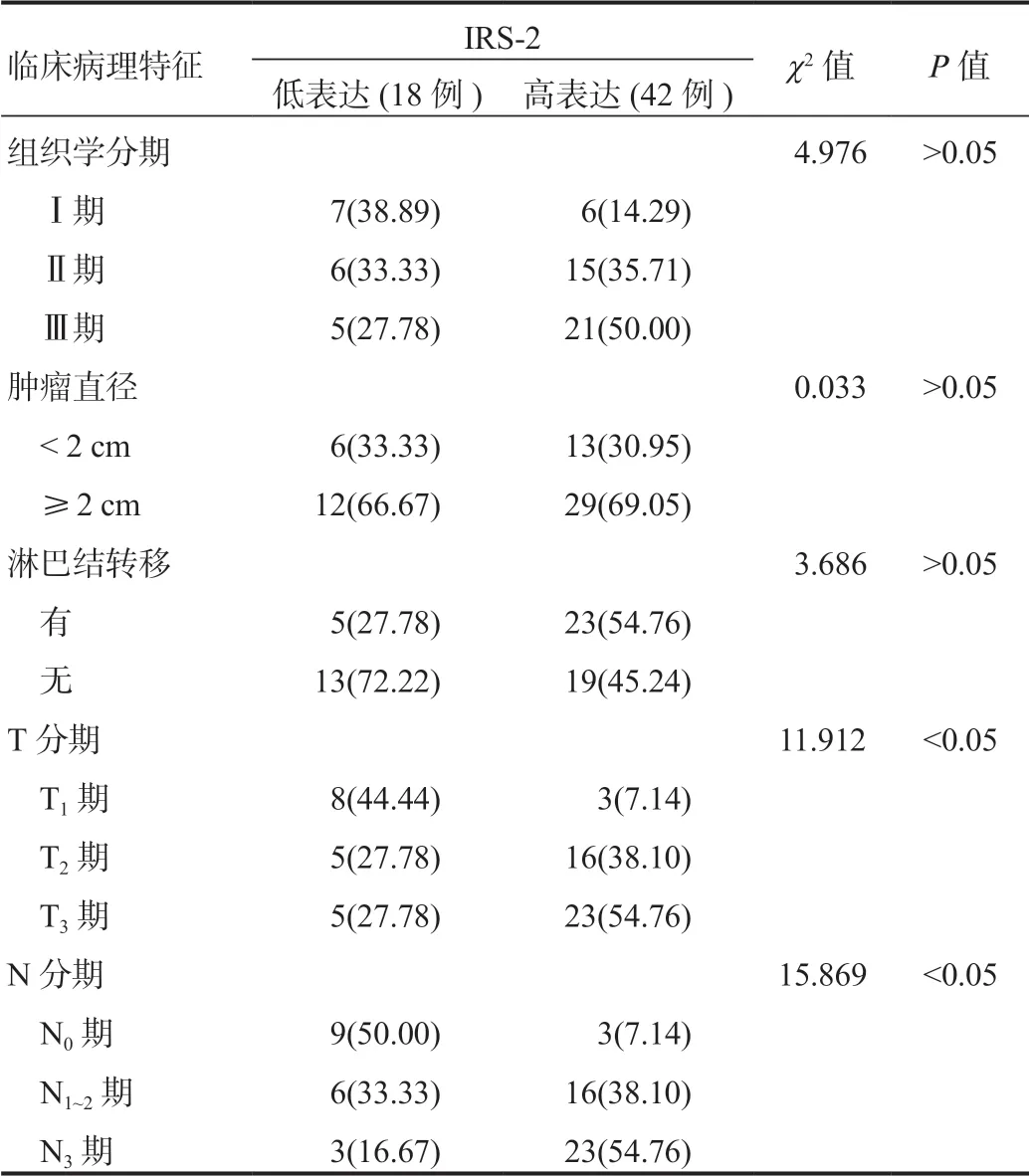
表3 乳腺癌組織IRS-2表達與患者臨床病理特征的關系[ 例(%)]
3 討論
大部分乳腺癌患者在早期一般不會出現明顯的不適癥狀,因此容易被患者忽視,當病情發展到一定程度時,進行相關檢查才發現病灶,但是為時已晚,癌細胞已發生遠處轉移,進而導致多器官出現病變,嚴重威脅患者生命安全。此外,乳腺癌患者不同的疾病進展階段,也會有不同的治療方式與預后。因此,尋找一種積極有效的乳腺癌診斷方法,對指導臨床采取及時有效的治療措施與改善患者預后意義重大。隨著臨床對乳腺癌研究的不斷深入,發現基因突變是其分子發病機制,并且在疾病的發生和發展過程中均有多基因參與。因此,了解細胞增殖標志物水平,對診斷乳腺癌具有積極意義。
IRS是被激活的胰島素受體酪氨酸激酶作用的底物,具有較多的殘基,發生磷酸化,參與了細胞因子信號轉導的磷酸化蛋白,控制下游信號的傳導,參與細胞的增殖、分化、凋亡及免疫調節等作用,其異常時可使細胞發生癌變,導致腫瘤的發生[8];而IRS-1、IRS-2屬于胰島素受體底物家族中的主要成員,可作為胰島素信號轉導系統中的關鍵中介分子,在多種腫瘤的發生發展過程中起著重要的作用;同時,該蛋白參與多種激素、細胞因子的信號轉導,以維持細胞的基本功能。相關研究顯示,IRS-1、IRS-2蛋白與乳腺癌的臨床癥狀和預后有著重要的關系[9]。本研究中,乳腺癌組織中IRS-1、IRS-2的高表達率均顯著高于乳腺癌旁組織,提示IRS-1、IRS-2在乳腺癌癌組織和癌旁組織中的表達具有較大的差異,參與了乳腺癌的發生發展。
IRS-1可通過調控多聚嘧啶區結合蛋白(PTB)的表達,消除胰島素樣生長因子受體-1(IGF-1R)對細胞分化的作用,從而促進細胞轉化,IRS-1在乳腺癌中持續被激活,高表達IRS-1會促進乳腺上皮細胞增殖[10]。IRS-2高表達于乳腺癌中,主要通過調節下游通路PI3K促進細胞有絲分裂,從而導致惡性腫瘤的增殖,同時還可以促進間皮瘤細胞和神經細胞瘤的侵襲、轉移[11]。本研究中,IRS-1、IRS-2表達均與組織學分期、腫瘤直徑、淋巴結轉移、T分期、N分期有關,說明IRS-1、IRS-2表達與臨床病理特征有關,能夠在一定程度上反映乳腺癌患者的惡性程度,這與上述指標在乳腺癌發生發展中的作用有關。
綜上,IRS-1、IRS-2在乳腺癌組織中呈高表達水平,且上述指標表達水平與患者臨床病理特征(乳腺癌T、N分期等)關系密切,可在臨床上診斷和治療乳腺癌方面起協助作用。但本研究也存在一定不足之處,未對患者疾病治療和預后情況進行隨訪,因此需擴大樣本量,延長隨訪周期,對疾病治療和預后情況做深入研究。

