鐵死亡基因及相關長鏈非編碼RNA在肝細胞癌發生與預后中的作用
姚元謙 呂建林 柳琳琳 王光耀
1.廣西中醫藥大學研究生院,廣西南寧 530001;2.廣西中醫藥大學第一附屬醫院肝病科,廣西南寧 530023
肝細胞癌目前仍是全球致死性惡性腫瘤的主要類型之一[1]。手術治療是肝癌患者早期有效治療手段,可惜大部分患者確診時已是中晚期,盡管近年來開發了多種晚期肝癌的新療法,但仍達不到臨床所需療效[2-3]。鐵死亡主要由鐵介導的氧化損傷、過度脂質氧化和細胞膜損傷驅動[4],誘導腫瘤細胞鐵死亡在各種癌癥治療中具有重要作用[5]。長鏈非編碼RNA(long non-coding RNA,lncRNA)起初被認為是基因組轉錄的“噪音”,而近年積累的證據表明,lncRNA 的異常表達與腫瘤的發展及預后密切相關[6]。本研究運用生物信息學,構建基于鐵死亡相關lncRNA 的肝癌預后模型,希望能為打破肝癌治療困境提供新視角。
1 資料與方法
1.1 一般資料
從TCGA 數據庫下載肝細胞癌的轉錄組數據,共424 個樣本。從FerrDb 數據庫獲取246 個與肝癌相關的鐵死亡基因。
1.2 鐵死亡基因功能富集分析
運用R 軟件進行差異分析,并以|logFC|>1、FDR<0.05 為過濾條件,篩選出差異表達基因,進行基因集(Gene Set Enrichment Analysis,GSEA)、GO、KEGG 富集分析。
1.3 鐵死亡相關lncRNA 篩選
參考Gencode 數據庫的基因注釋,提取轉錄組中的lncRNA。運用Pearson 相關性檢驗,以|cor|>0.4、P <0.001 為過濾條件,獲取鐵死亡相關lncRNA。
1.4 預后相關鐵死亡lncRNA 篩選
通過差異分析,提取差異鐵死亡lncRNA 的腫瘤組表達數據,進行單因素Cox 回歸分析,以P <0.001為過濾條件,篩選與預后相關的鐵死亡lncRNA。
1.5 構建肝癌預后模型
進行多因素Cox 回歸分析,構建基于鐵死亡相關lncRNA 的預后模型,該模型的計算公式:
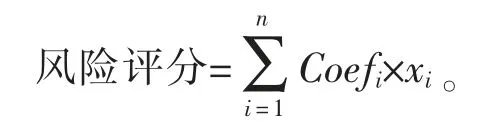
其中xi為每個lncRNA 的表達水平,Coefi為回歸系數。根據風險評分將隊列中的患者分為高、低風險組,并進行預后分析。
1.6 低風險組與高風險組的免疫差異
從TIMER2.0 數據庫下載免疫細胞浸潤數據,并通過文獻檢索獲得47 個免疫檢查點基因。以P <0.05 為過濾條件,篩選兩組差異有統計學意義的免疫細胞、免疫檢查點。
2 結果
2.1 鐵死亡基因功能富集分析
篩選出84 個差異表達鐵死亡基因,見圖1A。GSEA 富集分析發現,涉及雷帕霉素靶蛋白復合物(mechanistic target of Rapamycin 1,mTORC1)基因集、核因子-κB(nuclear factor-κB,NF-κB)調控基因集等,見圖1B。GO、KEGG 富集分析得到生物學進程631 條、細胞組分22 條、分子功能77 條、信號通路56 條,見圖1C~D。
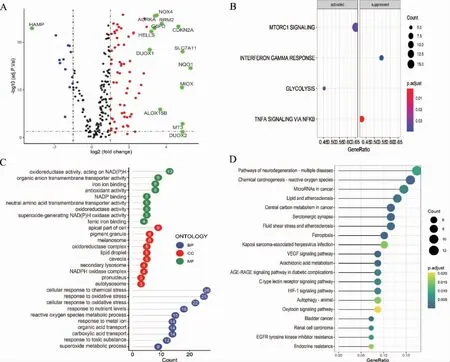
圖1 鐵死亡基因差異分析及富集分析
2.2 篩選預后相關的鐵死亡lncRNA 并構建預后模型
共鑒定出5 296 個與鐵死亡相關的lncRNA,篩選出差異lncRNA 共781 個,預后分析獲得66 個與預后相關的lncRNA。回歸分析納入17 個lncRNA 參與模型構建,其模型相關系數詳見表1。根據風險評分公式計算各患者的風險得分,并將隊列中的肝癌患者分為高、低風險組。

表1 構建預后模型多因素Cox 分析結果
2.3 預后分析及模型評估
Kaplan-Meier 生存曲線及預后風險散點圖顯示,低風險組預后優于高風險組(P <0.01),見圖2A~B。受試者操作特征(receiver operating characteristic,ROC)曲線顯示,該模型對生存期具有良好的預測能力,且優于其他臨床性狀的預測效果,見圖2C~D。回歸分析顯示,該模型與總生存期顯著相關,且具有獨立預后價值,見圖2E~F。
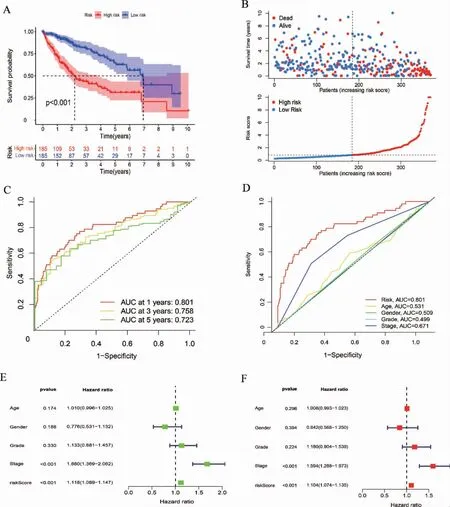
圖2 兩組預后分析及模型評估
2.4 預后相關lncRNA-mRNA 共表達分析
模型中lncRNA 基本在高風險患者中呈高表達狀態,且大部分隨著病程的進展而增高。lncRNAmRNA 共表達網絡見圖3A,圖中紅色節點為lncRNA、綠色節點為mRNA;表達熱圖見圖3B。
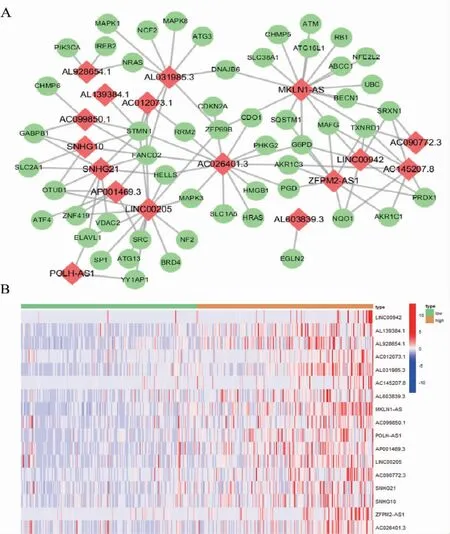
圖3 參與模型構建的lncRNA 表達分析
2.5 高風險組與低風險組免疫差異分析
免疫細胞浸潤熱圖見圖4A,圖中展示了不同平臺的分析結果。有17 個具有表達差異的免疫檢查點,見圖4B。根據以上免疫分析的結果,進一步分析14 個差異最顯著的鐵死亡基因(logFC>3)與免疫分子靶點間的相關性,見圖5。
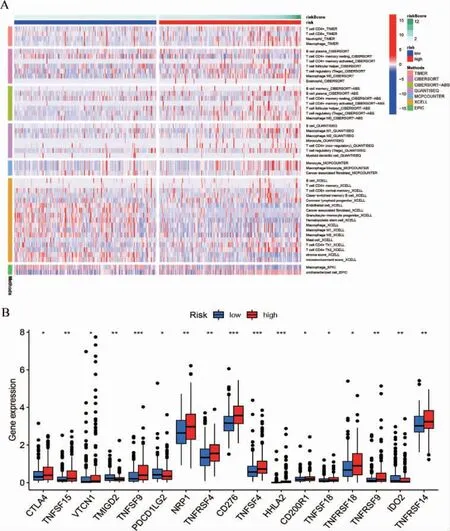
圖4 免疫細胞浸潤及免疫檢查點的差異分析
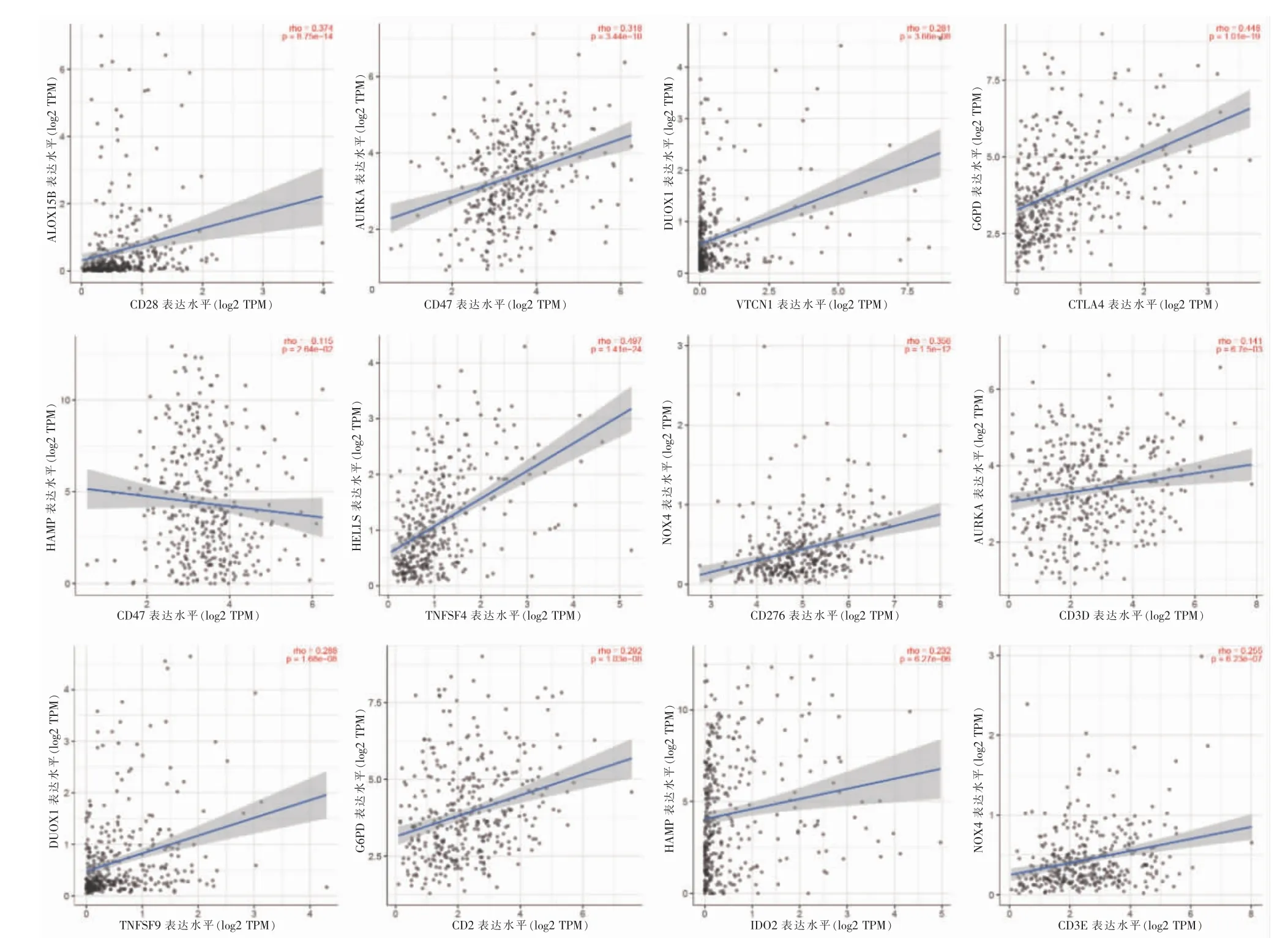
圖5 鐵死亡基因與免疫靶點相關性分析
3 討論
鐵死亡作為一種新發現的細胞死亡方式,在腫瘤研究中備受關注,而lncRNA 與鐵死亡之間具有調控關系[7]。本研究利用生物信息學,分析鐵死亡及相關lncRNA 在肝癌中的作用機制。
差異表達最顯著的鐵死亡基因中,部分已被證實參與鐵代謝或腫瘤的調節。NQO1 在細胞內起到抗氧化作用[8],其在肝癌患者中高表達,且與患者生存時間呈負相關[9]。SLC7A11 在多種惡性腫瘤中過表達,能夠抑制鐵死亡、促進腫瘤發展[10-11]。AURKA 是細胞周期調節激酶,其能誘導腫瘤細胞鐵死亡[12]。葡萄糖-6-磷酸脫氫酶(glucose-6-phosphate dehydrogenase,G6PD)能維持細胞的抗氧化損傷作用,G6PD 過表達能促進肝癌細胞的增殖[13-14]。HAMP 是維持體內鐵代謝穩態的關鍵基因,當HAMP 表達下調時可抑制細胞發生鐵死亡[15]。富集分析發現,在肝癌中mTORC1 復合物處于激活狀態,其能通過調節代謝過程為腫瘤細胞提供營養物質[16]。糖酵解途徑也在肝癌中處于激活狀態,是腫瘤細胞中表現活躍的代謝表征,糖酵解是腫瘤治療的潛在靶點[17]。而γ 干擾素應答調控途徑在肝癌中處于抑制狀態,該因子缺陷小鼠能自發地發生肺上皮惡性腫瘤[18],但也有研究認為其能夠使腫瘤細胞誘發強效的免疫逃逸機制[19]。孔雪等[20]發現,敲除AC012073.1 能夠明顯抑制乳腺癌細胞的侵襲能力,而過表達該基因則會促進癌細胞轉移。LINC00205 能夠作為內源競爭性RNA,促進肝癌細胞增殖[21],且該基因高表達的肝癌患者術后復發率較高[22]。
免疫治療策略能提高肝癌患者的生存率[23]。腫瘤中的淋巴細胞在免疫逃逸中發揮著重要作用,包括調節性T 細胞、腫瘤相關的巨噬細胞等[24]。本研究結果顯示,高、低風險組有17 個具有表達差異的免疫檢查點。目前,以單克隆抗體為代表的一系列免疫檢查點抑制劑在抗腫瘤中取得了較大成功[25]。

