人臍帶和胎盤間充質干細胞細胞因子分泌的比較研究
張坤 李芳 肖東杰 高德海 孫志軍 劉華
隨著細胞生物學的進步,細胞治療作為一種新型療法登上歷史舞臺,其中間充質干細胞(MSC)在新型冠狀病毒肺炎、脊髓損傷等難治性疾病中取得了顯著進展[1-2]。MSC 已被證實可從多個組織器官中分離獲得。而取材臍帶及胎盤的MSC 由于無需采取有創性操作,屬于產后醫療廢棄物,其體外提取簡單,不受倫理限制,低免疫源性,成為較好的MSC 種子細胞來源。不同組織來源和培養條件的MSC 具有不同的生物學特性,這成為影響MSC 藥品研發的挑戰與難點。近年來,有研究比較了不同MSC 的生物學特性,例如擴增能力、表面標記能力、多向分化能力、免疫調節及基因表達差異等[3-4]。盡管MSC 的具體治療機制尚不清楚,但MSC 分泌的細胞因子在促進組織再生和調節免疫應答方面都發揮重要作用[5]。
本研究的目的是使用人細胞因子芯片檢測臍帶間充質干細胞(UC-MSC)與胎盤間充質干細胞(P-MSC)細胞因子的分泌情況。細胞因子表達水平的檢測,有助于更好地探索MSC 的作用機制,為臨床選擇MSC 類型提供實驗數據支持。
材料與方法
一、試劑與耗材
MEM 培養基、胎牛血清、胰蛋白酶-EDTA、重組堿性成纖維細胞生長因子(bFGF)、表皮生長因子(EGF)均購自美國Gibco 公司,膠原酶Ⅰ購自美國Worthington公司。鼠抗人單克隆抗體CD13-PE、CD34-PE、CD44-PE、CD45-FITC、CD73-PE、CD90-PE、CD105-FITC、HLA-DR-FITC 均購自美國BD 公司。油紅O、茜素紅S 染色試劑購自武漢谷歌生物科技有限公司,硝酸銀試劑購自上海國藥集團化學試劑有限公司。OriCellTMMSC 成脂/成骨誘導分化培養基試劑盒購自廣州賽業生物科技有限公司公司。TGF-β1、ICAM-1 ELISA 試劑盒購自武漢博士德生物工程有限公司,IL-1β ELISA 試劑盒購自武漢伊萊瑞特生物科技股份有限公司。RNAex Pro Reagent、反轉錄試劑盒購自湖南艾科瑞生物工程有限公司,UltraSYBR Mixture 試劑購自北京康為世紀公司。細胞因子(QAH-CAA-1000)芯片購自瑞博奧(廣州)生物科技股份有限公司。
二、方 法
1. MSC 的分離培養
人體組織標本采集已獲得濟南市中心醫院倫理委員會的批準(2021-093-02),樣本采集前獲得所有供者知情同意,臍帶取自山東第一醫科大學附屬中心醫院產科,通過貼壁法獲得UC-MSC[6]。P-MSC來自山東醫科元多能干細胞生物工程有限公司。每組經分離得到7 株細胞,P5 代用于后續實驗。
2. MSC 的多向分化能力鑒定
MSC 以4×104或2×104細胞/孔的密度接種于6 孔板中,按照說明書,在成脂或成骨細胞誘導分化液中培養14~21 d 后進行油紅O、硝酸銀和茜素紅S 染色,顯微鏡下拍照。使用ImageJ 軟件進行定量分析。
3. MSC 的流式細胞術鑒定
消化后的MSC 加入下列抗體:FITC-HLA-DR、PE-CD34、FITC-CD45、PE-CD13、PE-CD44、PECD73、PE-CD90、FITC-CD105。孵育20 min,磷酸鹽緩沖液(PBS)洗1 次,BD FACSCalibur 流式細胞儀檢測,FlowJo 軟件進行分析。
4.細胞培養上清的獲取
將MSC 以4×105細胞/孔的密度接種于6 孔板中。細胞貼壁用PBS 洗滌兩次,加入含有2%FBS 的MEM 中培養。收集48 h 的條件培養基,1107×g 離心10 min,上清-80 ℃保存。
5.細胞因子的芯片檢測
按照說明書檢測上清液中80 種細胞因子的表達量。采用激光掃描儀掃描信號,使用QAHCAA-1000 的數據分析軟件來分析。
6.差異表達蛋白(DEP)篩選及KEGG 通路富集分析
檢測的原始數據用軟件歸一化后進行DEP 篩選。篩選條件如下:①logFC > log2(1.2),差異閾值為1.2;②校正后P < 0.05,并以聚類熱圖進行可視化。對分泌量前20 的細胞因子進行KEGG通路富集分析。挑選的標準是落在某個KEGG 上細胞因子數目≥2, P < 0.05,取前20 個富集的信號通路結果制圖。
7. ELISA 檢測細胞因子的表達
為驗證芯片檢測結果,使用人ELISA 試劑盒按照說明書分別檢測培養上清中IL-1β、人細胞間黏附分子-1(ICAM-1)和TGF-β1 的表達水平。每個樣品做3 個復孔。
8.實時PCR(RT-PCR)檢測相關基因的表達
TRIzol 法抽提MSC 總RNA,采用反轉錄試劑盒按步驟進行反轉錄為cDNA。以cDNA 為模板,引物序列見表1,分別擴增,以β-肌動蛋白(β-actin)作為PCR 的內參基因。RT-PCR 反應條件:95 ℃10 min,95 ℃ 15 s,63 ℃ 30 s,40 個循環。

表1 引物列表
三、統計學處理
芯片數據使用來自Bioconductor 的limma 分析,2 組比較采用moderated t 檢驗。本文其他數據采用SPSS 22.0 統計學軟件處理數據,符合正態分布的計量資料以表示,比較采用t 檢驗。P <0.05 為差異有統計學意義。柱狀圖均采用GraphPad Prism 6 軟件繪制,圖像分析采用ImageJ 軟件分析。
結 果
一、MSC 分化能力比較
流式細胞術檢測P5 代MSC 細胞表面標志物,結果顯示UC-MSC 和P-MSC 高表達CD13、CD44、CD73、CD90 和CD105(> 95%),低表達HLA-DR、CD34 和CD45(< 2%)。兩種MSC 表面標志物的表達差異均無統計學意義(P 均> 0.05),見表2。
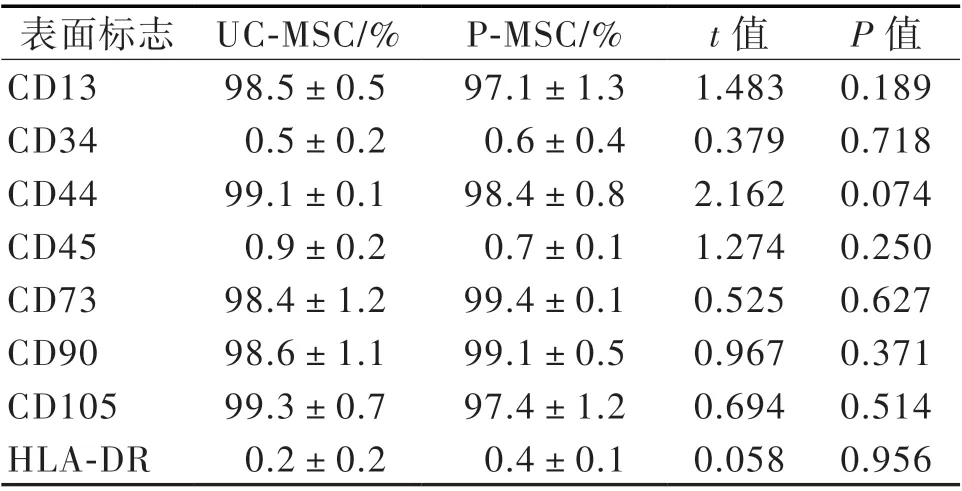
表2 流式細胞術檢測MSC 的表面標志物表達(n = 7)
光鏡下觀察UC-MSC 和P-MSC 細胞呈長梭形,經過3 周的成脂和成骨誘導分化,油紅O 染色可以觀察到MSC 呈橘紅色,有脂滴形成。硝酸銀及茜素紅S 染色可以在MSC 細胞質中觀察到黑色和橘紅色的鈣鹽沉積。這說明人臍帶及胎盤來源的MSC 均具有成脂和成骨分化能力。脂肪細胞及骨鈣化結節計數顯示兩種細胞成脂(t = 1.370,P =0.220)、成骨(t = 2.252,P = 0.065)分化能力差異均無統計學意義(P 均> 0.05),見圖1。
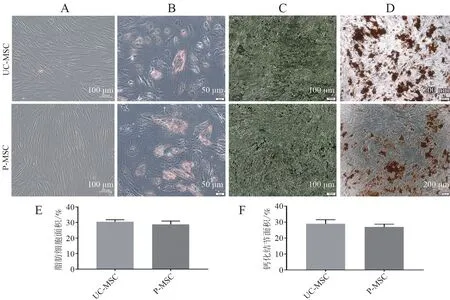
圖1 UC-MSC 和P-MSC 的培養形態及多向分化潛能
二、UC-MSC 和P-MSC 細胞因子分泌的表達
收集條件培養基,通過芯片分析80 種細胞因子的相對表達水平。芯片結果顯示,UC-MSC 與P-MSC 上清中前10 位高表達細胞因子依次為胰島素樣生長因子結合蛋白4(IGFBP-4)、IGFBP-3、IGFBP-6、基質金屬蛋白酶組織抑制劑(TIMP)-1和TIMP-2、IL-6、TGF-β1、 肝 細 胞 生 長 因 子(HGF)、單核細胞趨化蛋白-1(MCP-1)和人細胞間黏附分子-1(ICAM-1);低表達或不表達的因子依次為EGF、IL-17、IL-12p40、B 淋巴細胞趨化因 子(BLC)、TNF-β、IL-13、MIP-1δ、Eotaxin-2、IL-12p70、血小板衍生生長因子-BB(PDGF-BB),見表3、4。
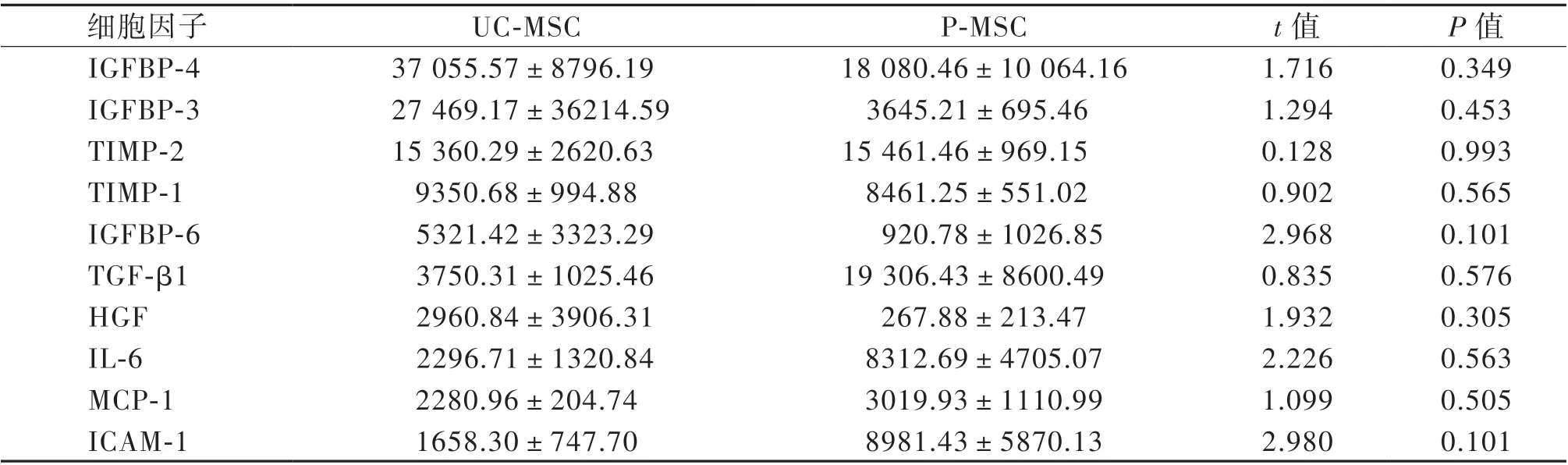
表3 芯片檢測MSC 細胞因子表達前10 位(n = 3) 單位:pg/mL
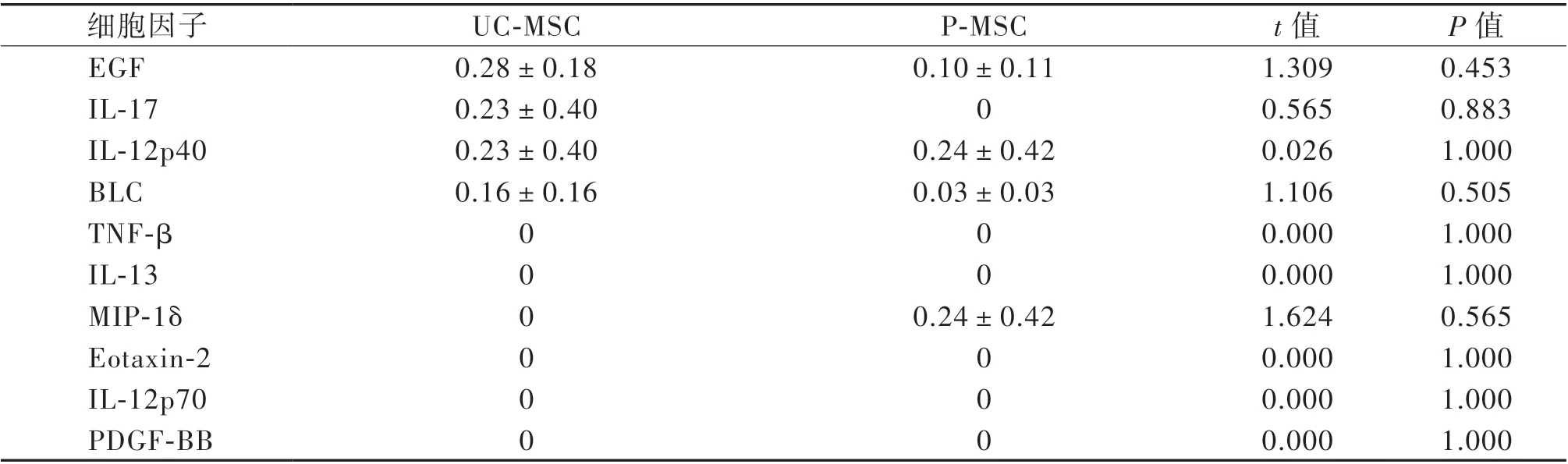
表4 芯片檢測MSC 細胞因子表達后10 位(n = 3) 單位:pg/mL
三、篩選UC-MSC 和P-MSC 分泌細胞因子的DEP 及KEGG 通路富集分析
比較UC-MSC 和P-MSC 上清中細胞因子差異,發現有5 個DEP,分別為TNFRⅡ、干細胞因子(SCF)、神經生長因子受體(NGFR)、TGF-β3 和IL-1β(P 均< 0.05,圖2A)。
利用clusterProfiler 軟件包對分泌量前20 的細胞因子進行KEGG 通路富集分析,觀察這些因子在信號通路中的富集情況。選取前20 個富集的信號通路,分析發現分泌量前20 的細胞因子主要富集在“細胞因子-細胞因子受體相互作用”“TNF信號通路”和“MAPK 信號通路”等通路(P < 0.05,圖2B)。
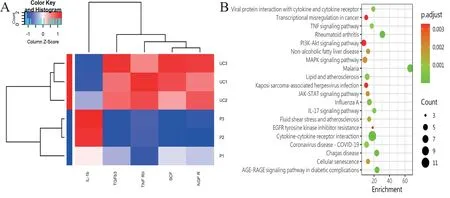
圖2 UC-MSC 和P-MSC 分泌細胞因子的聚類熱圖和KEGG 通路富集分析
四、ELISA 和RT-PCR 驗證芯片檢測結果
通過ELISA 檢測條件培養基中細胞因子的表達水平,結果顯示,UC-MSC 和P-MSC 表達量較高的兩個因子TGF-β1(t = 1.976,P = 0.119)、ICAM-1(t = 0.953,P = 0.377)兩者之間差異無統計學意義,P-MSC 的IL-1β 水平高于UC-MSC(t =5.176,P = 0.001)(圖3A)。此外,RT-PCR 檢測結果表明,UC-MSC 與P-MSC 相比,基因TGF-β3(t = 4.090,P = 0.002)、SCF(t = 3.552,P = 0.005)和TNFRⅡ(t = 2.374,P = 0.039)表達水平較高。IL-1β 基因在P-MSC 中的表達水平高于UC-MSC(t = 3.546,P = 0.005)。TGF-β1(t = 0.774,P =0.457)、ICAM-1(t = 1.008,P = 0.331)基因在UC-MSC 和P-MSC 之間表達差異無統計學意義(圖3B)。ELISA 和RT-PCR 結果與細胞因子芯片結果一致。
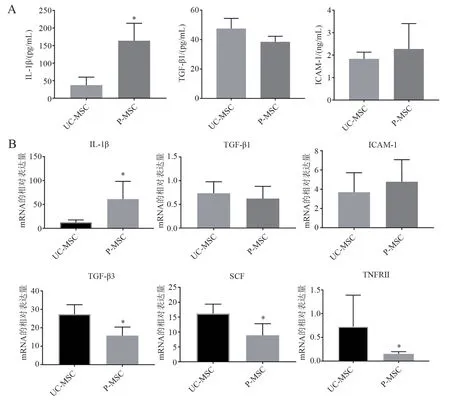
圖3 ELISA 和RT-PCR 檢測相關因子及基因表達
討 論
由于MSC 具有自我更新、多向分化潛力和旁分泌作用,被認為是再生醫學干細胞治療的重要種子細胞。迄今為止,骨髓MSC(BM-MSC)、脂肪MSC(A-MSC)、UC-MSC 和P-MSC 是臨床研究中最常用的干細胞[7-8]。有薈萃分析比較了不同來源的MSC 在臨床治療中的效果,發現不同來源的MSC 在臨床研究中發揮不同的治療作用[9-10]。
在本研究中,筆者團隊采用相同的培養基,從人的胎盤和臍帶組織中分離獲得MSC。通過形態觀察,流式細胞儀分析和誘導分化,UC-MSC 和P-MSC 表現出相似的形態、表面標志物和分化潛能。這與Li 等(2014 年)的研究結果一致。
最近研究表明,MSC 可以通過旁分泌因子來促進鄰近細胞的增殖和分化能力[11-12]。有研究檢測了不同MSC 的細胞因子表達,如 HGF、bFGF、血管細胞黏附分子-1 和血管內皮生長因子(VEGF)[13-14]。但目前還沒有系統地研究不同MSC 分泌的細胞因子。在本研究中,使用細胞因子芯片檢測兩種MSC 分泌的80 種細胞因子,結果顯示人胎盤與臍帶MSC 分泌的細胞因子基本一致。Park 等[15]檢測了BM-MSC 分泌的120 種細胞因子,高表達IL-6、IL-8、TIMP-2、MCP-1、VEGF和骨保護素,與本研究高表達細胞因子不同,可見不同組織來源的MSC在細胞因子分泌上存在差異。也有研究用ELISA 檢測UC-MSC 和P-MSC 中TGF-β1、HGF、VEGF 和EGF 的表達量,兩種MSC 的表達沒有差異,與筆者團隊的研究結果相同[13-14]。而在Wu 等[13]的研究中發現UC-MSC 分泌的bFGF 高于P-MSC,分泌的SCF 低于P-MSC,這與本研究的結果不同,這可能與胎盤的取材部位有關,他們的MSC 取自胎盤的蛻膜,本研究的則取自絨毛膜。
UC-MSC 和P-MSC 高分泌的細胞因子IGFBP,是一類與IGFs 有高度親和力并調控其作用的蛋白,IGFBP-4 能增強神經元祖細胞的分化[16]。IGFBP-3是一種不穩定的親水性蛋白,可調控細胞增殖、凋亡、蛋白質磷酸化和信號轉導通路等。已有研究證明IGFBP-3 可以誘導血管生成[17]。IGFBP-6影響MSC 多能性和肌原性分化[18]。MSC 大量分泌的IGFBP 可能在血管生成及神經和肌肉修復方面發揮作用。TIMP 可以通過抑制MMPs 來調節細胞外基質的重塑。Clarke 等(2015 年)發現TIMP-1和TIMP-2 可以減少MSC 的遷移和侵襲,促進細胞增殖并發揮抗凋亡的作用。TGF-β1 是TGF-β 超家族的關鍵成員,Li 等(2015 年)認為MSC 分泌的TGF-β1 能降低T 細胞增殖,以幫助治療免疫性疾病。同時筆者團隊前期研究顯示MSC 通過激活TGF-β1/Smad3/PLOD2 通路改善脊髓損傷后的功能恢復[19]。HGF 在細胞增殖分化,組織纖維化,腫瘤發生、轉移、耐藥等方面起著重要作用。Yang(2015 年)發現MSC 可以通過旁分泌HGF穩定急性肺損傷中的內皮屏障功能。ICAM-1 是黏附Ig 超家族的成員,可以促進MSC 歸巢至靶器官,并增強在炎癥性腸病和GVHD 模型中的免疫抑制作用[20]。有研究發現,在動物實驗中MSC 通過ICAM-1 的表達來促進腦微血管內皮細胞的血管生成,從而有助于帕金森病的恢復[21]。MSC 通過分泌大量的細胞因子在修復受損組織,促進組織分化再生,免疫調節方面發揮作用。Manochantr 等(2013 年)研究報道,在體外UC-MSC 和P-MSC具有相似的免疫抑制功能。在小鼠模型中,UCMSC 和P-MSC 對預防GVHD 發生具有相似的效果[22]。
本研究KEGG 通路富集分析UC-MSC 和P-MSC高表達的細胞因子,發現這些因子主要富集在“細胞因子-細胞因子受體相互作用”“TNF 信號通路”“MAPK 信號通路”等通路中,這些信號通路介導多種細胞過程,參與細胞增殖、分化、衰老、凋亡、免疫調節和炎癥反應[23-24]。聚 類 熱 圖表明UC-MSC 和P-MSC 分泌的細胞因子基本一致,僅有5 個DEP,分別為TNFRⅡ、SCF、NGFR、TGF-β3 和IL-1β。在差異表達的細胞因子中,已有的研究證明TNFRⅡ對維持MSC 再生功能,例如傷口愈合、內皮促血管生成支持有重要作用,能夠改善阿爾茨海默病,是MSC 免疫和再生功能的關鍵調節因子[25]。有研究證明TGF-β3 在體外能夠誘導MSC 向軟骨分化[26]。同時TGF-β3 能促進MSC的肌腱分化能力[27]。雖然兩種MSC 在因子表達上略有差異,但其分泌量較少,且在機體內發揮的作用尚值得商榷。
本研究在體外培養條件下比較了UC-MSC 和P-MSC 細胞因子分泌情況,細胞因子表達情況大致相同,關于UC-MSC 和P-MSC 移植后在不同疾病模型中,是否分泌相似的細胞因子,尚需要進一步研究。

