瑞巴派特緩釋片的處方優選及穩定性考察
黃月英,卞 俊,鮑蕾蕾(1.海軍軍醫大學第三附屬醫院藥劑科,上海 00438;.海軍軍醫大學第一附屬醫院藥劑科,上海 00433)
瑞巴派特是一種內源性黏膜保護劑,主要用于胃潰瘍[1]、潰瘍性結腸炎[2]、內鏡黏膜下剝離術術后潰瘍[3]的治療。該藥可正向誘導環氧合酶2活化并刺激前列腺素受體表達,進而提高胃黏膜內源性前列腺素水平、增加胃黏液分泌;同時,其還可激活生長因子(如表皮生長因子、血管內皮生長因子和肝細胞生長因子等)及其受體在潰瘍胃黏膜上的表達,抑制炎癥因子分泌,清除活性氧自由基,促進黏膜損傷愈合等[4]。目前,瑞巴派特有片劑、膠囊劑等在售,但均存在半衰期短(1.5~2.0 h)、患者依從性差等問題[5]。筆者前期通過大鼠胃腸吸收實驗發現,瑞巴派特為全胃腸道吸收藥物[6],遂根據其藥動學特點和現有劑型缺陷,將該藥設計為緩釋制劑。在此基礎上,本研究擬進一步優選瑞巴派特緩釋片處方,并考察所制片劑的穩定性,旨在為瑞巴派特緩釋制劑的研發提供參考。
1 材料
1.1 主要儀器
本研究所用主要儀器有UV-2550 型分光光度計[島津企業管理(中國)有限公司]、ZRS-8G型系列智能溶出試驗儀(天津天河醫療儀器有限公司)、BC-50E 型低溫光照儀(青島海爾股份有限公司)、LHRS-400B型恒溫恒濕培養箱(上海博泰實驗設備有限公司)、202-2DA型數顯電熱恒溫干燥箱(上海陽光實驗儀器有限公司)等。
1.2 主要藥品與試劑
瑞巴派特對照品(批號141019,純度99.9%)、瑞巴派特原料藥(批號150911,純度99.7%)均購自浙江遠力健藥業有限公司。L-精氨酸(批號20160217)購自上海易蒙斯化工科技有限公司;泊洛沙姆188(批號WPD1608B)購自德國BASF 公司;羥丙甲纖維素K100M(hypromellose K100M,HPMC K100M,批 號SH234187)購自上海卡樂康包衣技術有限公司;微晶纖維素(批號1712130)、微粉硅膠(批號171202)均購自安徽山河藥用輔料股份有限公司;上述輔料均為藥用級。甲醇為色譜純,其余試劑均為分析純,水為純化水。
2 方法與結果
2.1 瑞巴派特緩釋片的制備
按處方量稱取瑞巴派特原料藥150.0 mg、L-精氨酸75.0 mg(用量于前期預實驗確定)和泊洛沙姆188、HPMC K100M、微晶纖維素適量,采用熔融法制備瑞巴派特固體分散體,均勻分散后,迅速冷卻,于干燥箱中干燥1 h,粉碎過30目篩,再加填充劑微晶纖維素和潤滑劑微粉硅膠5 mg(1%),混勻壓片,總處方量為500 mg。
2.2 瑞巴派特含量的測定
2.2.1 溶液的制備 (1)對照品貯備液:精密稱取瑞巴派特對照品50.08 mg,置于50 mL 量瓶中,用0.1 mol/L NaOH 溶液溶解并稀釋至刻度,搖勻。精密量取上述溶液1 mL,用水制成質量濃度為100.16 μg/mL 的對照品貯備液。(2)供試品貯備液:取瑞巴派特緩釋片粉末(約含瑞巴派特50 mg),精密稱定,置于50 mL量瓶中,用水溶解并稀釋至刻度;精密量取上述溶液1 mL至10 mL量瓶中,用水定容,即得供試品貯備液。(3)輔料溶液:取與瑞巴派特緩釋片同比例的輔料(不含瑞巴派特)適量,按“2.2.1(2)”項下方法制備,即得輔料溶液。
2.2.2 檢測波長確定 將對照品貯備液和輔料溶液分別置于分光光度計中,在200~400 nm 波長范圍內進行紫外掃描。結果表明,瑞巴派特在230 nm 和328 nm 波長處均有較大吸收,輔料無干擾,考慮到末端吸收問題,本文選擇328 nm作為檢測波長(圖略)。
2.2.3 方法學考察 參照2020 年版《中國藥典》(四部)相關通則要求進行方法學考察[7]。(1)線性關系考察:精密吸取“2.2.1(1)”項下對照品貯備液適量,用水稀釋,制成瑞巴派特質量濃度分別為5.008、10.016、20.032、30.048、40.064、50.080 μg/mL 的系列溶液,在328 nm 波長處測定吸光度,以吸光度為縱坐標(Y)、瑞巴派特質量濃度為橫坐標(X)進行線性回歸,得回歸方程為Y=0.016 3X+0.004 8(R2=0.999 9),瑞巴派特檢測質量濃度的線性范圍為5.008~50.080 μg/mL。(2)精密度考察:按上述方法配制低、中、高質量濃度(10.016、30.048、50.080 μg/mL)對照品溶液,于1 d內重復測定5次,計算日內精密度;連續測定5 d,計算日間精密度。結果顯示,日內、日間精密度RSD 均小于2%(n=5),表明儀器精密度良好。(3)穩定性考察:精密量取“2.2.1(2)”項下供試品貯備液3 mL,置于10 mL 量瓶中并用水定容,混勻,分別于室溫下放置0、2、4、6、8、24 h時在328 nm波長處測定吸光度。結果顯示,吸光度的RSD為0.39%(n=6),提示供試品貯備液在24 h內穩定性良好。(4)重復性考察:取瑞巴派特緩釋片粉末,按“2.2.1(2)”項下方法平行制備供試品貯備液6 份;取供試品貯備液3 mL,置于10 mL 量瓶中并用水定容,混勻,于328 nm 波長處測定吸光度并代入回歸方程計算含量,得瑞巴派特含量的RSD 為0.38%(n=6),說明方法重復性良好。(5)加樣回收率考察:稱取已知含量的瑞巴派特緩釋片粉末(約含瑞巴派特50 mg),共9份,精密稱定,分別置于50 mL量瓶中,用水溶解并定容,混勻,精密量取上述溶液1.5 mL于100 mL 量瓶中,分別加入相當于瑞巴派特已知量80%、100%、120% 的對照品溶液[1 001.6 μg/mL,按“2.2.1(1)”項下方法配制]1.2、1.5、1.8 mL,用水稀釋至刻度,混勻,在328 nm波長處測定吸光度,計算得瑞巴派特平均加樣回收率為99.47%(RSD=0.73%,n=9),表明方法準確度良好。
2.3 體外累積釋放度實驗
按2020年版《中國藥典》(四部)“溶出度與釋放度測定法”項下“第一法(籃法)”操作[7]:釋放介質為900 mL水,溫度為(37.0±0.5)℃,轉速為100 r/min。取瑞巴派特緩釋片6片,分別置于6個溶出杯中,于0.25、0.5、1、2、3、4、6、8、10、12 h 時分別取樣5 mL,并及時補充釋放介質5 mL。取樣液用0.45 μm微孔濾膜過濾,取濾液作為供試溶液。取上述供試溶液,于328 nm波長處測定吸光度,代入回歸方程計算其中瑞巴派特的質量濃度并計算體外累積釋放度:體外累積釋放度(%)=100%[式中,C為供試溶液中瑞巴派特的質量濃度(μg/mL),V為釋放介質體積(mL),D為稀釋倍數,W為片劑質量(mg),F為瑞巴派特在制劑中的百分含量(%)]。
2.4 瑞巴派特緩釋片處方的優化
參考文獻[8-12],本研究在單因素實驗的基礎上,選取對藥物體外累積釋放度影響較大的親水凝膠骨架HPMC K100M用量(X1)和分散劑泊洛沙姆188用量(X2)為考察因素,以緩釋片在0.5、2、6、10、12 h的體外累積釋放度(Y0.5、Y2、Y6、Y10、Y12)的綜合評分(Y)、體外累積釋放曲線的相關系數(R)及黏沖程度(N)為評價指標。體外累積釋放度標準分別為9%~12%(0.5 h)、20%~22%(2 h)、50%~55%(6 h)、81%~89%(10 h)、≥90%(12 h)[13-14],Y=|Y0.5-10%|+|Y2-21%|+|Y6-51%|+|Y10-81%|+|Y12-95%|,Y取最小值;R的標準為0.99~1.00[13];N的標準為嚴重黏沖記0分,黏沖記3分,稍微黏沖記7分,不黏沖記10 分[15]。采用中心點復合設計-響應面法進行實驗,具體因素與水平見表1,實驗安排與結果見表2。
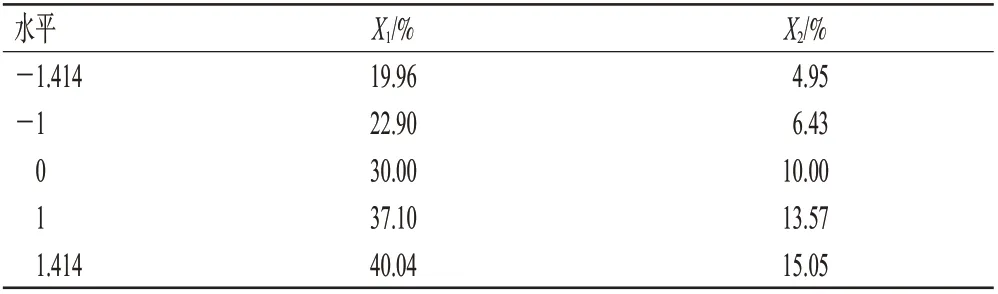
表1 中心點復合設計-響應面法的因素與水平
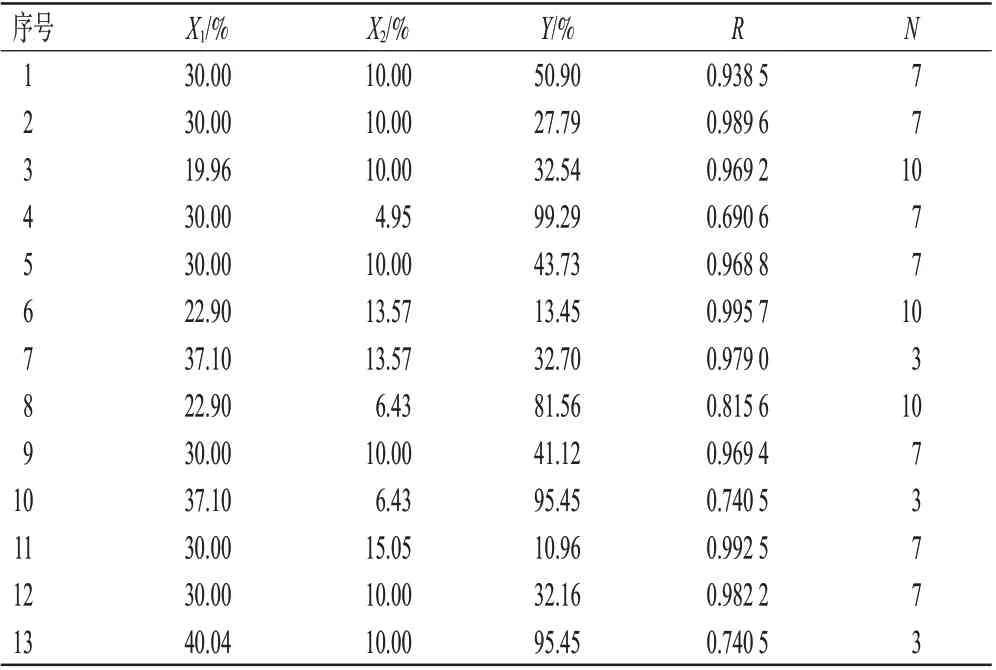
表2 中心點復合設計-響應面法的實驗安排與結果
采用Design-Expert 8.0.5b軟件對表2數據進行統計分析,得Y、R、N二項式擬合方程分別為:Y=340.43-12.05X1-21.61X2+0.05X1X2+0.23X12+0.55X22(P=0.000 5,r=0.936 1);R=-0.24+0.05X1+0.10X2+0.000 6X1X2-0.001 0X12-0.004X22(P=0.000 6,r=0.931 9);N=13.55-0.05X1+0.10X2-0.006X12-0.005X22(P<0.000 1,r=0.970 0)。Y、R、N的二項式擬合方程的P均小于0.05,提示其能較好地反映因素對響應值的影響;r均大于0.900 0,說明各二項式擬合方程與真實數據的擬合度良好,可用于瑞巴派特緩釋片處方參數的預測及分析。由二項式擬合方程的方差分析結果(表3)可知,Y、R、N的F檢驗的P均小于0.01,說明模型能準確預測具有顯著性的影響因素。
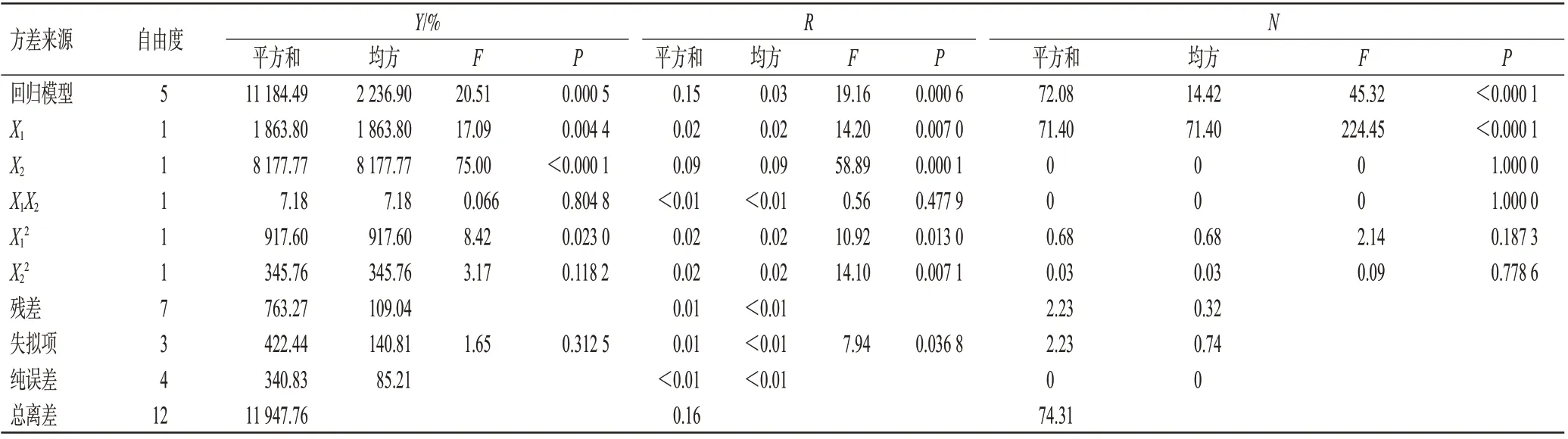
表3 中心點復合設計-響應面法的Y、R、N二項式擬合方程的方差分析結果
采用Design-Expert 8.0.5b 軟件繪制等高線圖和三維響應面圖(圖1)。結果顯示,因素X1(HPMC K100M用量)對藥物的釋放有顯著影響,因素X2(泊洛沙姆188用量)的影響較弱。HPMC K100M 用量越大,釋藥速度越慢且越均勻;泊洛沙姆188用量增加,釋藥速度緩慢加快;HPMC K100M 用量越大,R越大;泊洛沙姆188 用量越大,R越小。黏沖現象主要受泊洛沙姆188 用量的影響,泊洛沙姆188 用量越大,黏沖現象越嚴重。采用Design-Expert 8.0.5b 軟件對上述二項式擬合方程求解,確定最優處方為:泊洛沙姆188 用量13.12%,HPMC K100M用量22.90%。
根據最優處方,結合生產實際,確定最終處方為:瑞巴派特150.0 mg、泊洛沙姆188 65.6 mg、L-精氨酸75.0 mg、HPMC K100M 114.5 mg、微晶纖維素適量、微粉硅膠5 mg,總處方量為500 mg。根據該處方制備3批瑞巴派特緩釋片進行驗證實驗,按“2.2”“2.3”項下方法測定其含量及體外累積釋放度,并考察Y、R、N實測值與預測值的偏差[偏差=(預測值-實測值)/預測值×100%]。結果顯示,瑞巴派特的含量分別為100.61%、98.69%、99.01%,緩釋片在0.5、2、6、10、12 h 的體外累積釋放度分別為(9.59±0.69)%、(22.28±0.08)%、(54.00±0.71)%、(80.77±0.61)%、(94.32±0.45)%,RSD 均小于2.00%(n=3),表明所制緩釋片能持續12 h 釋藥,體外累積釋放度≥90%,重現性良好,本品的處方和工藝設計合理。Y、R、N的實測值分別為10.70%、0.996 5、10.00,與預測值11.63%、1.000 0、9.76的偏差均小于10%,表明所建模型具有良好的預測效果[16]。
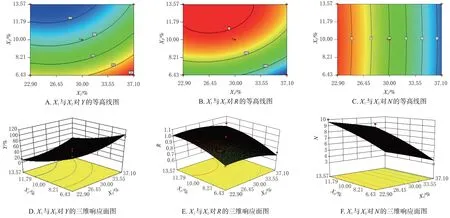
圖1 X1、X2對Y、R、N影響的等高線圖和三維響應面圖
2.5 釋藥曲線方程擬合及釋藥機制研究
參考文獻[14,17]對瑞巴派特緩釋片進行釋藥曲線方程擬合及釋藥機制研究。取瑞巴派特緩釋片進行體外累積釋放度實驗,將體外累積釋放度(Q)與時間(t)進行曲線擬合,探討釋藥機制。以Origin 9.0 軟件進行釋藥曲線方程擬合,結果見表4。

表4 瑞巴派特緩釋片釋藥曲線方程擬合結果
由表4 可知,Peppas 方程對該實驗數據結果的擬合度最高(R2=0.998 8),其擴散指數(n)為0.795 5,提示瑞巴派特緩釋片的體外釋藥特征符合混合型機制;此外,因零級釋放模型方程的R2為0.997 4,說明瑞巴派特緩釋片具有較好的緩釋效果。
2.6 瑞巴派特緩釋片穩定性實驗
參照2020年版《中國藥典》(四部)相關通則方法[7],對3批樣品進行穩定性研究,主要考察瑞巴派特緩釋片的性狀、含量、體外累積釋放度等參數的變化。
2.6.1 影響因素實驗 (1)光照實驗:取樣品適量,裸置于恒定質量的玻璃皿中,在(4 500±500)lx 的光照下放置10 d。結果(表5)顯示,光照10 d 后,樣品性狀與第0天相比無明顯變化,體外累積釋放度與第0天相比無明顯差異,含量略有下降。(2)高溫實驗:取樣品適量,裸置于恒定質量的玻璃皿中,置于干燥箱內,于(40±2)℃下放置10 d。結果(表5)顯示,高溫放置10 d后,樣品性狀與第0天相比無明顯變化,含量、體外累積釋放度與第0天相比亦無明顯差異。(3)高濕實驗:取樣品適量,裸置于恒定質量的玻璃皿中,置于恒溫恒濕培養箱內,在溫度為25 ℃,相對濕度分別為(75±5)%、(90±5)%的條件下放置10 d。結果(表5)顯示,在溫度25 ℃、相對濕度(75±5)%條件下放置10 d 后,片劑稍有膨脹,含量、體外累積釋放度與第0 天相比無明顯差異;在溫度25 ℃、相對濕度(90±5)%條件下放置10 d后,片劑從第5天起出現膨脹并開裂、釋放速率減慢等現象,含量與第0天相比無明顯差異。
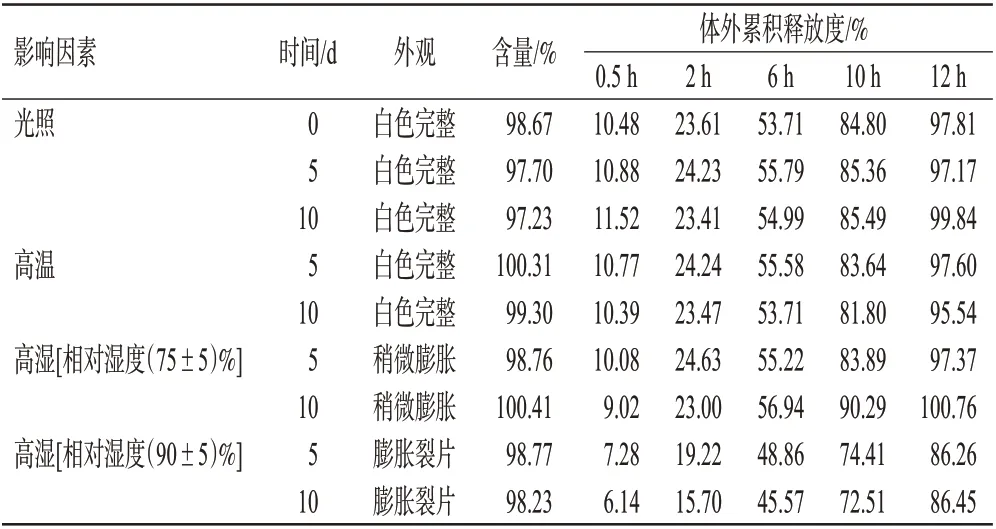
表5 瑞巴派特的影響因素實驗結果(n=3)
2.6.2 加速穩定性實驗 模擬本品市售包裝,并在相對濕度(75±5)%、溫度(40±2)℃條件下放置6 個月。結果(表6)顯示,樣品性狀無明顯變化,含量和體外累積釋放度測定結果與第0個月相比均無明顯差異,表明樣品加速穩定性良好。
2.6.3 長期穩定性實驗 模擬本品市售包裝,并在相對濕度(65±5)%、溫度(30±2)℃條件下放置12個月。結果(表7)顯示,樣品性狀無明顯變化,含量和體外累積釋放度測定結果與第0個月相比均無明顯差異,表明樣品長期穩定性良好。
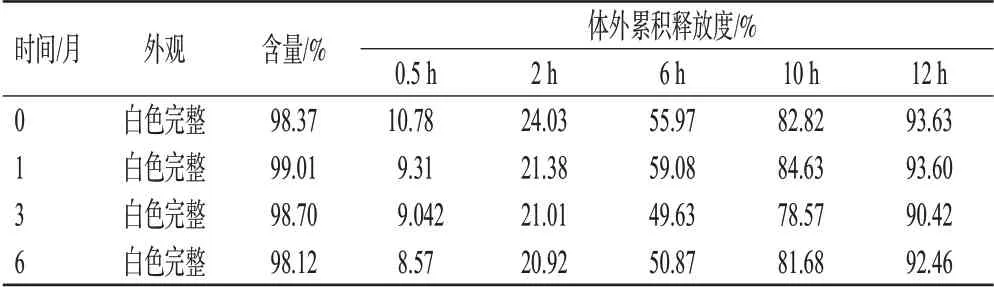
表6 瑞巴派特緩釋片加速穩定性實驗結果(n=3)
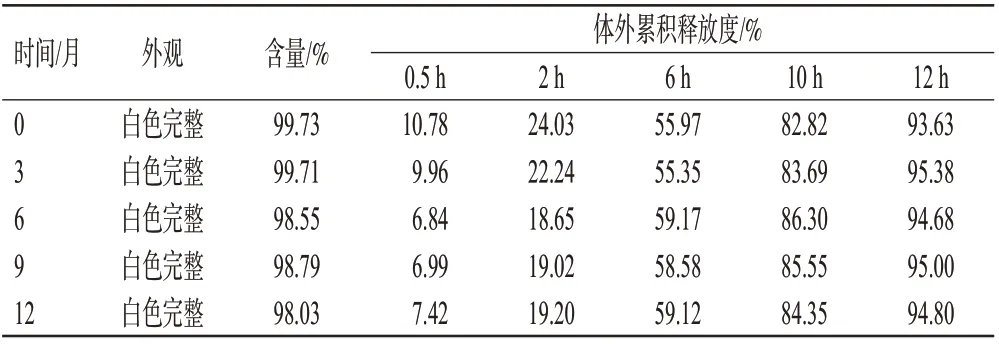
表7 瑞巴派特緩釋片長期穩定性實驗結果(n=3)
3 討論
以HPMC K100M 為骨架材料制成凝膠型骨架片,藥物釋放具有先快后慢的特征。前期研究顯示,泊洛沙姆188 可增加藥物的溶出,調節藥物的釋放[18]。通過分析三維響應面圖發現,隨著HPMC K100M用量的增加,釋藥速度減慢且更均勻;隨著泊洛沙姆188用量的增加,釋藥速率緩慢加快。這是因為HPMC K100M水合膨脹可形成凝膠屏障,黏度和用量越大,凝膠強度越大,藥物的溶出擴散和HPMC K100M 的溶蝕速度越慢,導致釋藥速度減慢;泊洛沙姆188為表面活性劑,可在凝膠層中形成孔道,減少藥物的擴散阻力,增加藥物的溶出,二者相結合可以達到理想的釋放效果。
通過Origin 9.0 軟件擬合釋藥曲線方程發現,瑞巴派特緩釋片釋藥機制更接近Peppas方程(n為0.795 5),符合混合型釋藥機制。這說明在此系統中,骨架材料的水合膨脹和溶蝕、藥物的溶出和擴散等同時影響著緩釋片中瑞巴派特的溶出[14,17]。
穩定性實驗中,光照對瑞巴派特緩釋片的含量略有影響;高濕對瑞巴派特緩釋片有較大影響,可導致片劑膨脹、開裂,并減緩釋放速率;高溫對瑞巴派特緩釋片無明顯影響。因此,本品應采用遮光材料包裝,于干燥處密封保存。模擬市售包裝后進行的加速穩定性實驗及長期穩定性實驗結果顯示,瑞巴派特緩釋片性狀均無明顯變化,含量和體外累積釋放度與第0個月相比均無明顯差異,表明瑞巴派特緩釋片加速和長期穩定性良好。
通過對瑞巴派特緩釋片進行處方優選及穩定性考察發現,緩釋片體外累積釋放度重現性良好,藥物含量穩定,穩定性良好。但本研究在進行處方優化時,只考察了12 h 的體外累積釋放度,未進行24、36 h 的體外累積釋放實驗,后續將進一步完善并進行體內藥動學研究,為瑞巴派特緩釋片的臨床應用提供實驗依據。

