lncRNA TOPORS-AS1靶向miR-718對胃癌細胞增殖、遷移和凋亡調控作用研究
邱實 曹佳懿 余雅靖
胃癌是全球第五大常見癌癥和第三大癌癥相關死亡原因,雖然部分患者可從手術、輔助化療中獲益,但大多數患者確診時已處于疾病晚期或發生轉移,治療往往無效[1,2]。研究顯示包括長鏈非編碼RNA(lncRNA)、微小RNA(miRNA)在內的非編碼RNA在胃癌進展中發揮重要作用,lncRNA通過與miRNA結合調節下游靶基因表達廣泛參與細胞周期、凋亡、轉移、血管生成等細胞過程,其表達改變與胃癌的腫瘤特征顯著相關,具有作為胃癌治療靶點的潛力[3,4]。有報道稱lncRNA TOPORS反義RNA 1(TOPORS-AS1)在胃癌組織中的表達顯著低于癌旁非腫瘤組織[5],但TOPORS-AS1在胃癌中的作用和調控機制并未有研究。研究報道miR-718高表達與胃癌患者預后不良顯著相關,下調miR-718可通過抑制磷脂酰肌苷3-激酶/蛋白激酶B(PI3K/Akt)信號通路,從而抑制胃癌細胞增殖和侵襲[6]。miR-718還可作為FBXL19反義RNA 1(FBXL19-AS1)的直接靶點,介導干擾FBXL19-AS1對乳腺癌進展的抑制作用[7]。生物信息學分析顯示TOPORS-AS1與miR-718存在相互作用,但TOPORS-AS1是否靶向miR-718調控胃癌進展尚需驗證。本研究探討了TOPORS-AS1在胃癌中的表達、生物學功能及其潛在機制,旨在為胃癌治療提供新的抗癌靶點。報告如下。
1 材料與方法
1.1 材料
1.1.1 胃癌組織:以2018年7月至2019年12月我院住院的43例胃癌患者,其中男23例,女20例;年齡45~76歲,平均年齡(61.3±7.5)歲,術中取人胃癌組織及癌旁組織(正常組織標本)。患者術前均未接受任何輔助治療。標本立即冷凍,-80℃保存。本研究的開展獲得我院倫理委員會的批準,患者均簽訂知情同意書。
1.1.2 細胞與試劑:人胃癌細胞系HGC-27、正常胃黏膜上皮細胞系GES-1購自美國ATCC;Lipofectamine 2000購自美國Invitrogen公司;PrimerScript逆轉錄試劑盒、miRNA cDNA合成試劑盒、SYBR green Premix Ex Taq Ⅱ購自大連寶生物公司;熒光素酶報告載體、pcDNA-TOPORS-AS1、pcDNA、anti-miR-NC、anti-miR-718、miR-NC、miR-718 mimics購自廣州銳博生物公司;CCK-8試劑盒購自南京恩晶生物科技公司;Transwell板(24孔)美國BD公司;Annexin-FITC/碘化丙啶雙染凋亡檢測試劑盒購自上海銳賽生物公司。
1.2 方法
1.2.1 細胞培養:HGC-27、GES-1細胞均接種在RPMI-1640培養基中在37℃、含5%CO2、濕潤培養箱中培養,該培養基中添加1%青鏈霉素混合液和10%胎牛血清。
1.2.2 RT-qPCR檢測TOPORS-AS1、miR-718表達:用TRIzol試劑提取胃癌組織和細胞系的總RNA,分別用PrimerScript逆轉錄試劑盒、miRNA cDNA合成試劑盒進行反轉錄,應用SYBR green Premix Ex Taq II進行RT-qPCR。GAPDH上游引物5’-ACCCACTCCTCCACCTTTGAC-3’,下游引物5’-TGTTGCTGTAGCCAAATTCGTT-3’;TOPORS-AS1上游引物5’-GCAAGCAGCAAGTAAGAAGCG-3’,下游引物5’-GCAAGCAGCAAGTAAGAAGCG-3’;U6上游引物5’-GCTTCGGCAGCACATATACTAAAAT-3’,下游引物5’-CGCTTCACGAATTTGCGTGTCAT-3’;miR-718上游引物5’-CAGTGCGTGTCGTGGAGT-3’,下游引物5’-CAGTGCGTGTCGTGGAGT-3’。2-ΔΔCt法計算TOPORS-AS1、miR-718表達量。
1.2.3 實驗分組:將HGC-27細胞接種6孔板,培養24 h后進行轉染,即用Lipofectamine 2000轉染pcDNA、pcDNA-TOPORS-AS1、anti-miR-NC、anti-miR-718、pcDNA-TOPORS-AS1+miR-NC、pcDNA-TOPORS-AS1+miR-718 mimics至50%融合細胞。轉染48 h后收集細胞進行RT-qPCR分析。HGC-27細胞共分為pcDNA組、pcDNA-TOPORS-AS1組、anti-miR-NC組、anti-miR-718組、pcDNA-TOPORS-AS1+miR-NC組、pcDNA-TOPORS-AS1+miR-718組。
1.2.4 CCK-8和克隆形成實驗檢測增殖:CCK-8實驗:將轉染細胞(5×103個/孔)接種在96孔板并在培養箱孵育48 h。每孔加入10 μl CCK-8試劑,再孵育4 h。酶標儀測量450 nm處的吸光度(A)。抑制率(%)=(1-實驗A/對照A)×100%克隆形成實驗:將轉染細胞(5×102個/孔)接種到6孔板置于培養箱孵育。每3天更換1次培養基。2周后,用甲醇固定細胞集落,用0.1%結晶紫染色。計數超過50個細胞的集落。
1.2.5 Transwell法檢測細胞遷移:取200 μl無血清培養基重懸的細胞懸液接種于上室,下室加入含10%胎牛血清的培養基。孵育24 h后,用棉簽去除未穿膜細胞。用4%多聚甲醛固定穿膜細胞,0.1%結晶紫染色15 min。顯微鏡下計數膜上隨機5個視野的細胞數,用平均值表示細胞遷移數量。
1.2.6 流式細胞術評估細胞凋亡:用冷PBS洗滌轉染細胞2次,用500 μl的1×結合緩沖液(含5 μl Annexin-FITC和5 μl碘化丙啶)重懸,避光孵育15 min,流式細胞術檢測細胞凋亡情況。
1.2.7 雙熒光素酶報告實驗:將含有miR-718結合位點的TOPORS-AS1片段克隆到psiCHECK-2載體構建野生型(WT)熒光素酶報告載體WT-TOPORS-AS1;將突變TOPORS-AS1片段克隆到psiCHECK-2載體構建突變型(MUT)熒光素酶報告載體MUT-TOPORS-AS1。用Lipofectamine 2000將WT-TOPORS-AS1、MUT-TOPORS-AS1分別與miR-718 mimics、miR-NC共轉染細胞。用雙熒光素酶報告基因檢測系統在轉染后48 h測量螢火蟲和海腎熒光素酶活性,相對熒光素酶活性以二者的比值表示。
1.2.8 Western blot檢測蛋白表達:RIPA緩沖液裂解轉染細胞提取總蛋白。測定蛋白濃度后,取等量變性蛋白用SDS-PAGE分離,并轉移到PVDF膜。用5%脫脂牛奶溶液封閉膜后,用針對Cleaved-caspase3、GAPDH的的特異性抗體在4℃下孵育過夜。隨后,將膜與酶標二抗在室溫下孵育1 h。化學光光發法進行顯色反應,Image J軟件分析Cleaved-caspase3相對于GAPDH條帶灰度值表示其蛋白表達量。

2 結果
2.1 胃癌組織和細胞中TOPORS-AS1、miR-718表達的檢測 胃癌組織中TOPORS-AS1表達水平顯著高于癌旁組織(P<0.05),miR-718表達水平顯著低于癌旁組織(P<0.05)。HGC-27細胞TOPORS-AS1表達水平顯著低于GES-1細胞(P<0.05),miR-718表達水平顯著高于GES-1細胞(P<0.05)。見表1。
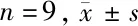
表1 TOPORS-AS1、miR-718表達的檢測
2.2 TOPORS-AS1對HGC-27增殖、遷移、凋亡的影響 轉染pcDNA-TOPORS-AS與轉染pcDNA比較HGC-27細胞TOPORS-AS1表達水平顯著升高(P<0.05),表明轉染pcDNA-TOPORS-AS1可促進TOPORS-AS1表達。與pcDNA組比較,pcDNA-TOPORS-AS1組HGC-27細胞抑制率、凋亡率、Cleaved-caspase3蛋白表達顯著升高(P<0.05),克隆形成數、遷移細胞數顯著減少(P<0.05)。見圖1,表2。
圖1 TOPORS-AS1促進HGC-27凋亡及Cleaved-caspase3蛋白的表達
表2 TOPORS-AS1抑制HGC-27增殖遷移促進凋亡
2.3 TOPORS-AS1和miR-718靶向關系 DIANA Tools預測到TOPORS-AS1和miR-718存在互補核苷酸序列。miR-718+ WT-TOPORS-AS1組HGC-27的相對熒光素酶活性顯著低于miR-NC+WT-TOPORS-AS1組(P<0.05);miR-718+MUT-TOPORS-AS1組HGC-27的相對熒光素酶活性與miR-NC+ MUT-TOPORS-AS1組比較無明顯變化。pcDNA-TOPORS-AS1組HGC-27細胞miR-718表達顯著低于miR-718組(P<0.05)。見圖2,表3、4。

圖2 TOPORS-AS1和miR-718互補序列
2.4 抑制miR-718對HGC-27增殖、遷移、凋亡的影響 轉染anti-miR-718與轉染anti-miR-NC比較HGC-27細胞miR-718表達顯著降低,表明轉染anti-miR-718可抑制miR-718表達。與anti-miR-NC組比較,anti-miR-718組HGC-27細胞抑制率、凋亡率、Cleaved-caspase3蛋白表達顯著升高,差異有統計學意義(P<0.05),克隆形成數、遷移細胞數顯著減少(P<0.05)。見圖3,表5。
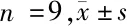
表3 雙熒光素酶報告實驗
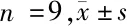
表4 TOPORS-AS1調控miR-718的表達
圖3 抑制miR-718促進HGC-27凋亡及Cleaved-caspase3蛋白的表達
表5 抑制miR-718抑制HGC-27增殖遷移促進凋亡
2.5 過表達miR-718逆轉TOPORS-AS1過表達對HGC-27增殖、遷移、凋亡的影響 與pcDNA-TOPORS-AS1+miR-NC組比較,pcDNA-TOPORS-AS1+miR-718組HGC-27細胞miR-718表達、克隆形成數、遷移細胞數顯著升高(P<0.05),細胞抑制率、凋亡率、Cleaved-caspase3蛋白表達顯著降低(P<0.05)。見圖4,表6。
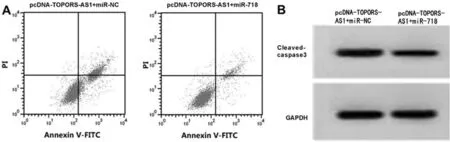
圖4 miR-718逆轉TOPORS-AS1對HGC-27凋亡的促進作用及Cleaved-caspase3蛋白表達的促進作用

表6 過表達miR-718和TOPORS-AS1對HGC-27增殖遷移凋亡的作用
3 討論
lncRNA在癌癥的發生和轉移中發揮著重要作用。研究顯示lncRNA在胃癌組織中的表達顯著改變,并參與多種腫瘤生物學過程,例如,LINC00511在胃癌中上調,并與晚期臨床特征和預后不良呈正相關[8]。lncRNA腫瘤易感基因11(CASC11)參與調控胃癌細胞周期阻滯、凋亡、遷移[9]。lncRNA HOX轉錄反義RNA(HOTAIR)通過靶向miR-1277-5p和上調COL5A1表達來促進胃癌的生長和轉移[10]。然而,筆者發現差異表達的lncRNA在胃癌中的作用并未完全闡明。本研究檢測到胃癌組織、細胞系中TOPORS-AS1表達顯著減少,提示TOPORS-AS1低表達可能有助于胃癌進展。
已有研究證實TOPORS-AS1低表達乳腺癌患者總生存率較差,過表達TOPORS-AS1可抑制乳腺癌細胞增殖,抑制細胞侵襲行為[11]。為探討TOPORS-AS1在胃癌進展中的作用,本研究轉染pcDNA-TOPORS-AS1至胃癌細胞HGC-27分析其功能,結果表明,過表達TOPORS-AS1可抑制細胞克隆形成和增殖能力,提高細胞凋亡率,這與乳腺癌中TOPORS-AS1的抑制作用一致。Cleaved-caspase3是凋亡執行蛋白,具有促凋亡作用,Cleaved-caspase3水平被認為是評估細胞凋亡的重要指標[12,13]。本研究中過表達TOPORS-AS1能夠誘導Cleaved-caspase3表達上調,者進一步證實過表達TOPORS-AS1的凋亡促進功能。
miRNA是在基因表達的轉錄后調控中發揮功能的短鏈非編碼RNA分子,近年研究發現lncRNA可結合特定miRNA進而調控腫瘤進展[14]。本研究證實miR-718是TOPORS-AS1的直接靶點。研究表明非小細胞肺癌中miR-718表達降低與腫瘤大小、淋巴結轉移、較差的總生存率顯著相關[15]。乳頭狀甲狀腺癌中miR-718表達降低,上調miR-718表達可抑制腫瘤細胞葡萄糖代謝和遷移[16]。肝癌中miR-718過表達導致腫瘤細胞增殖率升高,lncRNA SEMA3B反義RNA 1(SEMA3B-AS1)靶向下調miR-718可抑制肝癌細胞增殖[17]。本研究發現胃癌組織、細胞系中miR-718表達顯著升高,抑制miR-718表達可下調Cleaved-caspase3水平,誘導細胞凋亡,抑制細胞增殖,這與Liu等[6]報道miR-718在胃癌致癌作用吻合。
過表達TOPORS-AS1后HGC-27細胞中miR-718是表達降低,且抑制miR-718表達和過表達TOPORS-AS1的抗胃癌作用一致,提示胃癌中存在潛在TOPORS-AS1/miR-718調控分子軸。回復實驗表明,過表達miR-718還可減弱TOPORS-AS1過表達對HGC-27細胞增殖、凋亡和遷移的影響,基本恢復HGC-27細胞惡性行為,這提示TOPORS-AS1在胃癌中至少通過部分調控miR-718表達發揮抑癌功能。
綜上所述,TOPORS-AS1在胃癌中呈低表達,TOPORS-AS1通過靶向負調控miR-718可抑制胃癌細胞增殖、遷移并促進凋亡。這些發現可為研究胃癌發生、進展機制提供新的視角,并可能為胃癌治療提供新的抗癌靶點。

