金天格膠囊對H2O2誘導的小鼠成骨細胞MC3T3-E1氧化應激損傷及炎癥因子的作用
李超 趙劍波* 陳俊雅 耿玲 何寧 趙浩東
1. 大理大學第一附屬醫院創傷骨科,云南 大理 671000; 2. 大理大學,云南 大理,671000
骨質疏松(osteoporosis,OP)是常見老年疾病,致殘率高。臨床以低骨量和骨組織微結構破壞為特征,導致骨質脆性增加和易于骨折的全身性骨代謝性疾病[1]。而由于OP產生的病理性骨折,是老年人死亡的重要因素。流行病學研究[2]表明,OP與多種因素有關,包括遺傳因素、鈣和維生素D缺乏、雌激素和雄激素分泌不足、老年退化性機制等。現代藥理研究[3]表明,在骨質疏松的發生發展中,氧化應激是一個至關重要的初始風險因素。活性氧自由基(reactive oxide species,ROS)積累和成骨細胞凋亡參與了各種類型OP的發病機理,因此抗氧化在一定程度上能夠預防骨質疏松。
金天格膠囊為人工虎骨粉,具有健骨作用,臨床前研究及臨床研究均發現其具有一定的促進骨生長的作用[4],但是對于氧化應激所導致的損傷作用尚不清楚。因此,本研究利用小鼠成骨細胞ME3T3-E1,考察過氧化氫(H2O2)刺激后氧化還原平衡和炎癥基因、炎癥因子變化,并同時考察金天格膠囊對氧化應激損傷的保護作用,對細胞中總超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、谷胱甘肽過氧化物酶(glutathion peroxidase,GSH-Px)和過氧化氫酶(catalase,CAT)活力的影響,以及對腫瘤壞死因子alpha(tumor necrosis factor alpha,TNF-α)、白介素1beta(interleukin 1 beta,IL-1β)、白介素6(interleukin 6,IL-6)基因表達和細胞因子分泌的影響,從而明確金天格膠囊對氧化應激損傷的作用。
1 材料和方法
1.1 細胞株
小鼠成骨細胞MC3T3-E1細胞株(北納創聯生物技術有限公司,中國),采用含10 %胎牛血清,1 %青-鏈霉素的MEM-α(modified eagle medium-α)完全培養基,置于37 ℃、5 % CO2培養箱中培養。
1.2 藥品與試劑
金天格膠囊,由金花企業(集團)股份有限公司西安金花制藥廠饋贈。藥物配制:取1.2 g(0.4 g ×3粒)金天格膠囊,無菌條件下用12 mL MEM-α完全培養基溶解,0.22 μm過濾器過濾,即得100 mg/mL金天格膠囊儲備液,4 ℃保存。臨用前用MEM-α完全培養基分別配制成100、50、20、10、0 μg/mL金天格膠囊溶液。脂多糖(lipopolysaccharide,LPS)購自碧云天生物技術研究所,總RNA提取試劑盒、反轉錄試劑盒以及擴增試劑盒均購自南京諾唯贊生物科技股份有限公司。小鼠Ⅰ型前膠原羧基端前肽(procollagen type ⅠC-peptide,PICP)酶聯免疫吸附法(enzyme-linked immunosorbent assay,ELISA)試劑盒和小鼠堿性磷脂酶(alkaline phospholipase,ALP)ELISA試劑盒購自上海酶聯生物科技有限公司。小鼠TNF-α ELISA試劑盒、IL-1β ELSA試劑盒、IL-6 ELSA試劑盒,SOD檢測試劑盒、MDA檢測試劑盒、GSH-Px檢測試劑盒、CAT檢測試劑盒和CCK8(Cell Counting Kit-8)試劑均購自碧云天生物技術研究所。青-鏈霉素混合液(100×)和胰酶購自北京索萊寶科技有限公司,MEM-α培養基購自美國HyClone公司,胎牛血清購自杭州四季青生物工程材料有限公司。
1.3 儀器
RT-PCR儀(美國BIO-RAD公司),多功能酶標儀(美國基因有限公司),NanoPhotometer(德國Implen公司),實時熒光定量PCR儀(Life Technologies)。
1.4 細胞培養
MC3T3-E1細胞培養于含10 %胎牛血清、1 %青-鏈霉素混合液的EME-α完全培養基中,置于37 ℃、5 % CO2的培養箱中培養觀察。
1.5 金天格膠囊對ME3T3-E1細胞增殖、凋亡及ALP、PICP含量影響的測定
1.5.1CCK-8檢測細胞增殖:將100 μL濃度為1×105/mL細胞懸液接種于96孔細胞培養板,分別設為不同濃度金天格膠囊組(100、50、20、10、0 μg/mL金天格膠囊溶液),空白組加入同體積無血清培養基,每組設6個復孔,置37 ℃、5 % CO2的細胞培養箱培養。24 h后,去除培養液,磷酸鹽緩沖液(phosphate buffer sulfate,PBS)輕輕洗2次,相應孔中分別加入不同濃度的金天格膠囊溶液或無血清培養基,繼續置37 ℃、含5 % CO2的細胞培養箱培養。24 h后,每孔加入CCK-8溶液10 μL,置37 ℃、5 % CO2的細胞培養箱培養。避光孵育3 h后,采用酶標儀于450 nm處測定吸光度值。
1.5.2ELISA檢測細胞培養上清中相關因子:將MC3T3-E1細胞以1×106/mL接種于6孔細胞培養板。培養24 h后,吸棄細胞培養上清液,藥物組分別加入含不同濃度金天格膠囊(100、50、20、10、0 μg/mL)的完全培養基,空白組加入同體積無血清培養基,48 h后,收集細胞培養上清液,3 000 r/min、4 ℃離心20 min,收集、分裝上清,-20 ℃保存備用。根據ELISA試劑盒說明書測定細胞培養上清液中ALP和PICP含量。
1.6 金天格膠囊對H2O2誘導ME3T3-E1細胞損傷保護作用的測定
1.6.1H2O2損傷模型制備及藥物作用下細胞增殖活力測定[5]:按照MC3T3-E1細胞數量和體積種板。24 h后,吸棄細胞培養上清。藥物組分別加入不同濃度金天格膠囊(100、50、20、10、0 μg/mL)的完全培養基,空白組加入同體積無血清培養基。20 h后,藥物組和損傷組均加入含1 mmol/L H2O2的MEM-α完全培養基共孵育4 h。每孔加入CCK-8溶液10 μL,避光孵育3 h后,采用酶標儀于450 nm處測定吸光度值。
1.6.2細胞中SOD、MDA、GSH-Px和CAT活力測定:以1×105/mL細胞懸液接種于24孔細胞培養板中,24 h后,吸棄細胞培養上清液。藥物組分別加入不同濃度金天格膠囊(100、50、20、10、0 μg/mL)的完全培養基,空白組加入同體積無血清培養基。20 h后,藥物組和損傷組均加入含1 mmol/L H2O2的MEM-α完全培養基共孵育4 h后,按照試劑盒說明書測定細胞中SOD、MDA、GSH-Px和CAT活力。
1.6.3細胞培養上清中TNF-α、IL-1β、IL-6含量測定:按照1×106/mL將MC3T3-E1細胞接種于6孔板中。按照細胞種板及給藥方法,加H2O2孵育4 h后,收集細胞培養上清液,3 000 r/min、4 ℃離心20 min,收集、分裝上清,-20 ℃保存備用。根據ELISA試劑盒說明書測定細胞培養上清液中炎癥相關因子TNF-α、IL-1β、IL-6含量。
1.6.4細胞中Tnfa、Il-1b、Il-6相對mRNA水平測定按照1×106/mL將MC3T3-E1細胞接種于6孔板中。按照細胞種板及給藥方法,加H2O2孵育4 h后,吸棄細胞培養上清液,PBS輕輕洗1次,收集每孔細胞。采用Trizol試劑從細胞中提取總RNA,用反轉錄試劑盒將提取的RNA反轉錄為cDNA。然后擴增cDNA進行RT-PCR。實驗采用GAPDH作為內參基因,結果采用2-△△CT法進行分析。RT-PCR引物由上海生工生物工程股份有限公司合成,具體引物序列如下:Tnfa5’-3,F:CCCTCACACTCAGATC ATCTTCT,R:GCTACGACGTGGGCTACAG;Il-1b5’-3’,F:GCAACTGTTCCTGAACTCAACT,R:ATCTTT TGGGGTCCGTCAACT;Il-6 5’-3’,F:TAGTCCTT CCTACCCCAATTTCC,R:TTGGTCCTTAGCCACTCC TTC;GAPDH 5’-3,F:AGGTCGGTGTGAACGGAT TTG,R:TGTAGACCATGTAGTTGAGGTCA。
1.7 統計學處理
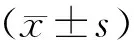
2 結果
2.1 不同濃度金天格膠囊作用24 h對MC3T3-E1細胞增殖的作用
與空白組比較,20、50、100 μg/mL金天格膠囊溶液均能夠促進MC3T3-E1細胞增殖,其中100 μg/mL金天格膠囊溶液能顯著促進MC3T3-E1細胞增殖(P<0.01)。結果見圖1。
注:與空白組比較,**P < 0.01。
2.2 不同濃度金天格膠囊對MC3T3-E1細胞培養上清中ALP和PICP含量的影響
與空白組比較,除10 μg/mL金天格膠囊溶液外,20、50、100 μg/mL金天格膠囊溶液均可明顯提高MC3T3-E1細胞培養上清中ALP和PICP含量,且差異具有統計學意義(P< 0.05,P< 0.01)。結果見表1。
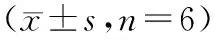
表1 金天格膠囊提高MC3T3-E1細胞培養上清中ALP和PICP含量
2.3 H2O2誘導下細胞增殖活力測定
與空白組比較,H2O2組MC3T3-E1細胞存活率顯著下降(P< 0.01),10、20、50 μg/mL金天格膠囊溶液組細胞存活率也明顯下降(P< 0.01)。與H2O2組比較,50、100 μg/mL金天格膠囊溶液能顯著提高H2O2刺激后的細胞存活率(P< 0.01)。結果見圖2。
注:與空白組比較,*P < 0.05,**P < 0.01;與H2O2組比較,#P < 0.05,##P < 0.01。
2.4 H2O2誘導下SOD、MDA、GSH-Px和CAT活力測定
與空白組比較,H2O2組MC3T3-E1細胞中SOD、CAT活力顯著降低(P< 0.01),MDA水平顯著上升(P< 0.01)、GSH-Px水平明顯下降(P< 0.05)。與H2O2組比較,100 μg/mL金天格膠囊溶液能顯著提高SOD、CAT活力(P< 0.01),提高GSH-Px水平(P< 0.05),顯著降低MDA水平(P< 0.01)。結果見表2。
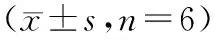
表2 H2O2誘導下不同濃度金天格膠囊溶液對MC3T3-E1細胞中SOD、MDA、GSH-Px和CAT活力影響
2.5 H2O2誘導下細胞培養上清中炎癥因子TNF-α、IL-1β、IL-6含量測定
與空白組比較,H2O2組MC3T3-E1細胞培養上清中TNF-α、IL-1β、IL-6含量顯著提高(P< 0.01),10、20、50 μg/mL金天格膠囊溶液組細胞上清中TNF-α、IL-1β、IL-6含量也明顯提高(P< 0.05,P< 0.01)。與H2O2組比較,50、100 μg/mL金天格膠囊溶液能明顯降低MC3T3-E1細胞培養上清中TNF-α、IL-1β、IL-6含量(P< 0.05,P< 0.01)。結果見表3。
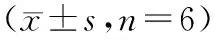
表3 H2O2誘導下不同濃度金天格膠囊溶液對MC3T3-E1細胞中TNF-α、IL-1β和IL-6含量作用
2.6 H2O2誘導下細胞中炎癥因子TNF-α、IL-1β、IL-6 mRNA相對表達
與空白組比較,H2O2組和10 μg/mL金天格膠囊溶液組細胞中Tnfa、Il-1b和Il-6 mRNA相對表達明顯提高(P< 0.05,P< 0.01)。與H2O2組比較,50、100 μg/mL金天格膠囊溶液組能顯著降低細胞中Tnfa和Il-6 mRNA相對表達(P< 0.01)。結果見表4。
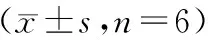
表4 H2O2誘導下不同濃度金天格膠囊溶液對MC3T3-E1細胞中Tnfa、Il-1b和Il-6 mRNA相對表達
3 討論
目前,世界上約有2億人正在遭受OP困擾,而受環境和生活方式等多種因素影響,這一數據還在不斷增加[6]。氧化應激被認為是許多疾病狀態的致病因素之一,包括降低骨密度,即骨量流失[7]。研究表明,抗氧化劑可以作為OP治療的有效手段之一,并且多種抗氧化劑的抗氧化應激作用,如N-乙酰半胱氨酸[8]、綠原酸[9]等,已經得到臨床前證明。H2O2體外誘導MC3T3-E1細胞損傷模型,是在成骨細胞中建立骨壞死的常用體外模型。在此模型中,H2O2促進MC3T3-E1細胞凋亡[10],誘導氧化應激,從而增加過氧化產物MDA水平,下調GSH-Px水平[11]。結果發現,100 μg/mL金天格膠囊溶液能顯著促進正常MC3T3-E1細胞的增殖,并顯著提高H2O2誘導MC3T3-E1細胞存活率的下降。同時,100 μg/mL金天格膠囊溶液顯著提高了抗氧化相關因子SOD、CAT活力,提高GSH-Px水平,并降低過氧化產物MDA水平。說明金天格膠囊對H2O2誘導的MC3T3-E1細胞氧化應激損傷具有保護作用。
研究發現,在MC3T3-E1細胞中,H2O2誘導了炎癥因子TNF-α、IL-1β等水平的增加[12]。臨床研究也發現,金天格膠囊與阿法骨化醇軟膠囊聯用,對絕經后骨質疏松癥具有較好療效,可減少血液中炎癥因子水平[13]。結果發現,金天格膠囊溶液能降低MC3T3-E1細胞中Tnfa、Il-6、Il-1b基因相對表達,減少細胞培養上清中炎癥因子TNF-α、IL-6、IL-1β的含量。結果表明,金天格膠囊具有明顯的抗炎作用。
骨質疏松(OP)以骨量流失為特征,通常伴隨著骨吸收增加和骨形成減少的發生。骨的形成與成骨細胞活性有關,堿性磷脂酶(ALP)活性反映了成骨細胞分化程度,其活性越高,成骨細胞的成骨活性越強[14]。I型膠原蛋白約占骨骼有機成分的90 %,骨形成時,Ⅰ型前膠原羧基端前肽(PICP)會隨I型膠原的合成而釋放入血,其水平能反映骨細胞合成骨膠原的能力[15]。實驗結果發現,在體外培養的小鼠成骨細胞MC3T3-E1細胞株中,除10 μg/mL金天格膠囊溶液之外,20、50、100 μg/mL金天格膠囊溶液均可顯著提高MC3T3-E1細胞培養上清中ALP和PICP含量(P< 0.05,P< 0.01)。表明金天格膠囊增強了成骨細胞活性和I型膠原合成能力。
在中成藥治療膝骨關節炎臨床應用指南(2020年)中,明確指出金天格膠囊可以用于膝骨關節炎的緩解期和康復期[16]。本研究表明,金天格膠囊能顯著促進小鼠MC3T3-E1正常成骨細胞增殖,并提高H2O2引起的細胞存活率的降低;降低炎癥因子水平;此外,金天格膠囊還能增強成骨細胞活性和I型膠原合成能力。因此,抗氧化應激、抗炎和促進I型膠原合成在金天格膠囊治療OP的過程中可能發揮重要作用。
本研究著重考察了金天格膠囊在OP體外模型中對氧化應激的調節作用,對炎癥因子在RNA和蛋白水平表達增加的抑制作用,提高ALP和PICP增強成骨細胞活性作用。但是,還需要明確在OP臨床樣本和動物模型的不同發病時間和發展階段,其氧化應激和炎癥應答各因子水平變化,以及成骨細胞和破骨細胞之間的平衡,進一步探究其可能的發病機制,并探討金天格膠囊對OP不同階段的作用。

