基于電擊策略的三孢布拉霉遺傳轉化體系的優化及應用
沈思巧,楊培龍,曲音波,余曉斌,羅瑋*
1(江南大學 生物工程學院,江蘇 無錫,214122)2(農業農村部飼料生物技術重點實驗室, 中國農業科學院飼料研究所,北京,100081) 3(山東大學,微生物技術國家重點實驗室,山東 青島,266237)
三孢布拉霉是目前大規模生產β-胡蘿卜素的工業化菌株[1],在該菌株中發現了多個類胡蘿卜素合成調控基因,如crgA[2]、wc-1c[3]。在卷枝毛霉中類胡蘿卜素光誘導合成的效應主要由wc-1c基因介導[4],通過將三孢布拉霉來源的btwc-1c導入到卷枝毛霉相應功能缺失菌中,初步證明了btwc-1c參與光誘導的類胡蘿卜素合成[3]。然而,目前缺乏針對三孢布拉霉的高效遺傳轉化方法[5],難以對類胡蘿卜素合成關鍵調控基因的作用機制進行深入研究。
目前文獻已報道的關于三孢布拉霉的轉化方法包括聚乙二醇介導的原生質體轉化[6]、農桿菌侵染原生質體[5]與電擊轉化原生質體[7]等。原生質體轉化通常使用聚乙二醇介導將核酸導入原生質體中,鞏尊洋等[6]采用該方法篩選到陽性轉化子,然而受限于三孢布拉霉細胞壁結構的復雜及對細胞壁水解酶的了解使該方法轉化效率較低[8]。農桿菌侵染原生質體是依靠T-DNA在誘導條件下轉移基因到宿主基因組中的一種轉化方法[9],廣泛應用于絲狀真菌和植物的轉化過程。李娜等[5]采用該方法篩選到了轉化子,然而該方法操作復雜耗時且后期農桿菌難以完全去除,篩選出的轉化子即使在含有頭孢噻肟鈉的培養基上繼代多次仍然有可能攜帶農桿菌[10]。相對于前兩種方法,電擊轉化法可使外源核酸立即轉移到細胞內[8],轉化耗時短,另外還能導入雙質粒。WANG等[7]采用該方法成功篩選到了轉化子,但其轉化效率依然不高,可能的原因包括影響真菌原生質體制備的因素,如菌齡、酶解時間與溫度、滲透壓穩定劑的種類等會影響原生質體的數量與質量[11],而電擊轉化時的電壓大小與電脈沖時間,再生培養時搖床轉速及培養時間等會影響轉化子的獲得。
本研究基于電擊轉化原生質體存在的問題,利用可以提高轉化效率的含有AMA1自主復制元件[12]的復制型質粒pFC332進行電轉化,優化了電擊轉化三孢布拉霉原生質體多個參數。同時,以轉化含有btwc-1c的重組載體為例,成功構建了btwc-1c過表達菌株。本研究為在三孢布拉霉中進行代謝工程和解析類胡蘿卜素合成的代謝調控機制奠定了一定的基礎。
1 材料與方法
1.1 材料
1.1.1 菌株與質粒
菌株三孢布拉霉(Blakesleatrispora)負菌NRRL2896、大腸桿菌JM109(EscherichiacoliJM109)由本實驗室保藏。質粒pFC332和pUC57-AMA1-pgpdA-cas9-TrpC-hph由本實驗室保藏。
1.1.2 培養基與溶液
麥汁培養基 (1 L):5°麥汁,25 g瓊脂;
種子培養基 (g/L):玉米粉30,大豆粉50,KH2PO41.5,MgSO4·7H2O 0.5;
再生培養基 (g/L):蔗糖200,馬鈴薯200,葡萄糖20,KH2PO41、MgSO4·7H2O 0.1;
LB培養基(g/L):NaCl 10、蛋白胨10、酵母提取物5。如需配制LB固體平板,再加入2%的瓊脂粉后滅菌。
溶液 (mol/L):穩滲液:NaCl 0.6;電脈沖緩沖液:蔗糖0.6、磷酸緩沖液0.005、山梨醇1,pH 7。
1.1.3 主要試劑
Prime STAR?Max DNA Polymerase,寶日醫生物技術(北京)有限公司;溶菌酶、溶壁酶、蝸牛酶、氨芐青霉素、潮霉素B,無錫特達生物技術有限公司;DNA小量抽提試劑盒,天根生化科技(北京)有限公司;RNApure Plant Kit,北京康為世紀生物科技有限公司;MolPure?Plant DNA Kit植物DNA提取試劑盒、Hifair?Ⅲ 1 st Strand cDNA Synthesis SuperMix for qPCR (gDNA digester plus)、Hieff?qPCR SYBR Green Master Mix (High Rox Plus),翌圣生物科技(上海)股份有限公司;ClonExpress?Ⅱ One Step Cloning Kit,南京諾唯贊生物科技股份有限公司;引物合成與測序等服務,蘇州金唯智生物科技有限公司或上海生物工程有限公司。
1.2 實驗方法
1.2.1 三孢布拉霉潮霉素最低抑制濃度試驗
利用pFC332載體上的潮霉素抗性作為抗性篩選標記,對三孢布拉霉NRRL2896野生型進行潮霉素敏感性測試。將利用酶解制備的三孢布拉霉原生質體通過血球計數板計數后在含有不同濃度潮霉素的培養基中進行培養,確定潮霉素對三孢布拉霉的最低抑菌濃度。
1.2.2 電轉化三孢布拉霉原生質體條件的確立及優化
圖1為電擊轉化三孢布拉霉原生質體的基本流程,初始轉化條件如下:
(1)三孢布拉霉原生質體的制備
將三孢布拉霉按1%接種量接種于50 mL種子液中,28 ℃培養48 h,8 000 r/min離心5 min,收集菌絲體,無菌水水洗2次,添加10 mL由0.6 mol/L的蔗糖溶液配制的酶解液(3 g/100mL溶壁酶+1.5 g/100mL溶菌酶+1.5 g/100mL蝸牛酶),避光孵育1.5 h,使用4層擦鏡紙過濾后用0.6 mol/L的蔗糖溶液清洗2次,4 000 r/min,10 min離心,調整原生質體個數為1×107個/mL后備用。
(2)電轉化三孢布拉霉原生質體
將200 μL的原生質體與0.5 μg的線性質粒充分混合后移入規格為0.2 cm的電轉杯,設置4 kV/cm的條件,電轉1 ms。電轉3次(第1次間隔2 s,第2次間隔3 s)后迅速加入940 μL的再生培養基。
(3)再生與培養
在28 ℃,180 r/min培養1.5 h進行再生,然后以9 000 r/min離心1 min,取100 μL轉移至含80 μg/mL 的潮霉素固體麥汁培養基中。
需要進行的優化參數如表1所示。
1.2.3 再生率及轉化效率的計算
英國廣播公司拍攝的《自然的運作》《沙漠》《熱帶雨林》等與生態學主要內容密切相關的視頻資料,螞蟻和竹節蟲被孢子侵襲后的病態表現和它們身上長出一棵小蘑菇狀的菌絲的動態過程,一定能使學生們深刻領會什么是“寄生”,還能牢記不忘。學生們會在看到極樂鳥求偶炫耀變換色彩斑斕的羽毛時驚呼,會在看到沙漠蜘蛛逃亡化身車輪滾下沙丘時鼓掌,會在看到沙漠蜥蜴在盛夏正午為避免燙傷而抬高雙腿時大笑。在被大自然的奇妙征服的同時,激發出他們珍愛地球生命、熱愛大自然的情感。
計算原生質體再生率步驟如下:在0.6 mol/L NaCl的酶解液(溶壁酶3 g/100mL+溶菌酶1.5 g/100mL+蝸牛酶1.5 g/100mL)中于28 ℃,75 r/min 下避光酶解1~5 h后將酶解后的液體采用4層擦鏡紙進行過濾后再用0.6 mol/L NaCl溶液洗滌2遍后使用血球計數板計數將溶液稀釋至1×107個/mL,取100 μL后涂布在含200 g/L蔗糖的高滲麥汁固體培養基中,培養2 d 左右后記下菌落數,計為Y1,另外取100 μL的原生質體涂步在不含200 g/L蔗糖的低滲麥汁固體培養基中,培養2 d左右后記下菌落數,計為Y2。
計算電擊后的再生率的步驟如下:取200 μL的原生質體在不同的電壓大小與電脈沖時間下進行電轉(電擊3次:一次間隔2 s,一次間隔3 s),涂布在含200 g/L蔗糖的高滲麥汁固體培養基中,培養2 d左右后記下菌落數,計為Y1,另外在同樣條件下處理后涂步在不含200 g/L蔗糖的低滲麥汁固體培養基中,培養2 d左右后記下菌落數,計為Y2。
原生質體再生率按照公式(1)和公式(2)進行計算:
(1)
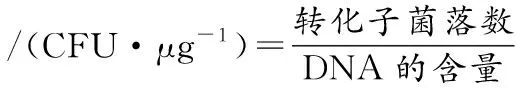
(2)
1.2.4btwc-1c過表達載體的構建
采用RNApure Plant Kit試劑盒提取野生型三孢布拉霉RNA,然后使用Hifair?Ⅲ 1 st Strand cDNA Synthesis SuperMix for qPCR試劑盒反轉錄成cDNA,以cDNA為模板,使用引物W-F與W-R得到btwc-1c片段,以質粒pUC57-AMA1-pgpdA-cas9-TrpC-hph為模板采用P-F與P-R反向PCR擴增得到pUC57-AMA1-pgpdA-TrpC片段。使用ClonExpress?Ⅱ One Step Cloning Kit試劑盒將pUC57-AMA1-pgpdA-TrpC與btwc-1c連接構建表達載體pUC57-AMA1-pgpdA-btwc-1c-TrpC-hph。
構建的流程如圖2所示,引物見表2。
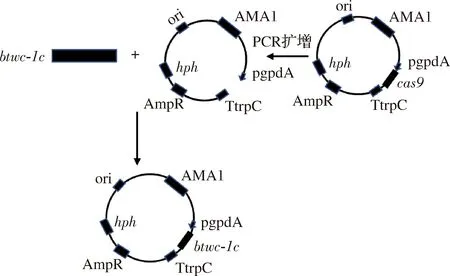
圖2 過表達載體pUC57-AMA1-pgpdA-btwc-1c-TrpC-hph的 構建Fig.2 Construction of overexpression vector pUC57-AMA1-pgpdA-btwc-1c-TrpC-hph

表2 本研究所用到的引物對Table 2 Primer pairs used in this study
1.2.5 轉化子鑒定及轉錄水平分析
(1)目的基因Ct值歸一化:
ΔCt實驗組=Ct實驗組目的基因-Ct實驗組內參基因
ΔCt對照組=Ct對照組目的基因-Ct對照組內參基因
(2)實驗組ΔCt值歸一化:
ΔΔCt=ΔCt實驗組-ΔCt對照組
(3)基因表達差異倍數=(1+n)-ΔΔCt;n為引物的擴增效率。
1.2.6 生物量和β-胡蘿卜素含量的測定
在固體培養基上培養三孢布拉霉,然后在紅光照射下采用一次性涂布器刮取菌苔迅速稱量菌體濕重。測定β-胡蘿卜素含量需制定其標準曲線。稱取1 mg β-胡蘿卜素標準品,用乙酸乙酯配制成10 μg/mL的標準溶液,添加20 g/L 2,6-二叔丁基對甲酚(butylated hydroxy toluene,BHT)防止β-胡蘿卜素氧化。分別取標準溶液1、2、3、4、5、6 mL,用乙酸乙酯定容于10 mL棕色容量瓶中。分別取200 μL不同濃度的標準品溶液,用酶標儀測定450 nm下的吸光值。以標準品濃度為橫坐標,OD450值為縱坐標,繪制標準曲線。標準曲線計算公式為y=0.129x-0.027 4,y為OD450值,x為β-胡蘿卜素含量(ng/μL)。紅光環境下取培養的菌絲體測量其濕重,迅速加入10 mL棕色離心管中,用蒸餾水洗滌3次后,將干菌體置于研缽中,加入液氮將菌絲體研磨成粉末狀,用含有6 mL 2%(質量分數)BHT的乙酸乙酯,4 ℃萃取1 h[13],4 ℃條件下10 000 r/min離心5 min,分離上清液與沉淀,繼續用6 mL的乙酸乙酯進行萃取。將2次上清液進行混合,β-胡蘿卜素含量分析采用酶標儀在450 nm下測定吸光值,待測樣品的β-胡蘿卜素含量根據標準曲線進行計算。
2 結果與分析
2.1 原生質體抗性分析及酶解孵育時間對原生質體再生的影響
選擇潮霉素為抗性篩選標記,需首先對三孢布拉霉NRRL2896(-)野生型菌株進行潮霉素抗性分析。先將在平板中培養3~4 d的三孢布拉霉菌苔接種至種子培養基中培養48 h后,將菌絲體進行酶解(3 h),將原生質體數稀釋為1.0×107個/mL,取100 μL分別涂布在潮霉素終質量濃度為40~120 μg/mL的麥汁固體平板上,培養4~5 d后觀察菌絲體生長情況。由表3結果可知潮霉素質量濃度在80 μg/mL時三孢布拉霉原生質體無法長為菌絲體,因此后續的轉化實驗將潮霉素質量濃度控制在 80 μg/mL。

表3 三孢布拉霉潮霉素抗性敏感度測試Table 3 Sensitivity test of Blakeslea trispora to hygromycin
真菌具有復雜的、動態的細胞壁結構,在抵御外界刺激過程中發揮著重要作用[14]。絲狀真菌細胞壁主要由葡聚糖、幾丁質、殼聚糖、甘露聚糖、糖蛋白等組成[15-17],結構復雜、外界物質不易穿透,因而無法像原核生物那樣不經處理或經過簡單處理后即可進行電轉化[18],因此需要制備高質量的原生質體。有研究報道[7]溶壁酶(3 g/100mL)、溶菌酶(1.5 g/100mL)和蝸牛酶(1.5 g/100mL)溶解在0.6 mol/L蔗糖中黑暗孵育1.5 h可以制備出原生質體用于電轉,而李曄[19]指出與0.6 mol/L蔗糖相比采用0.6 mol/L NaCl作為穩滲液在28 ℃,75 r/min 避光酶解下更適合制備原生質體,故本研究直接采用0.6 mol/L NaCl作為穩滲液。酶解時間是影響原生質體制備的另一個關鍵因素,時間較短原生質體釋放的不夠,時間長原生質體則會易破裂死亡。從圖3可知酶解3 h原生質體的再生率最高達到約51.6%,在酶解0~3 h時再生率逐漸升高,3 h后隨著酶解時間的延長再生率下降。
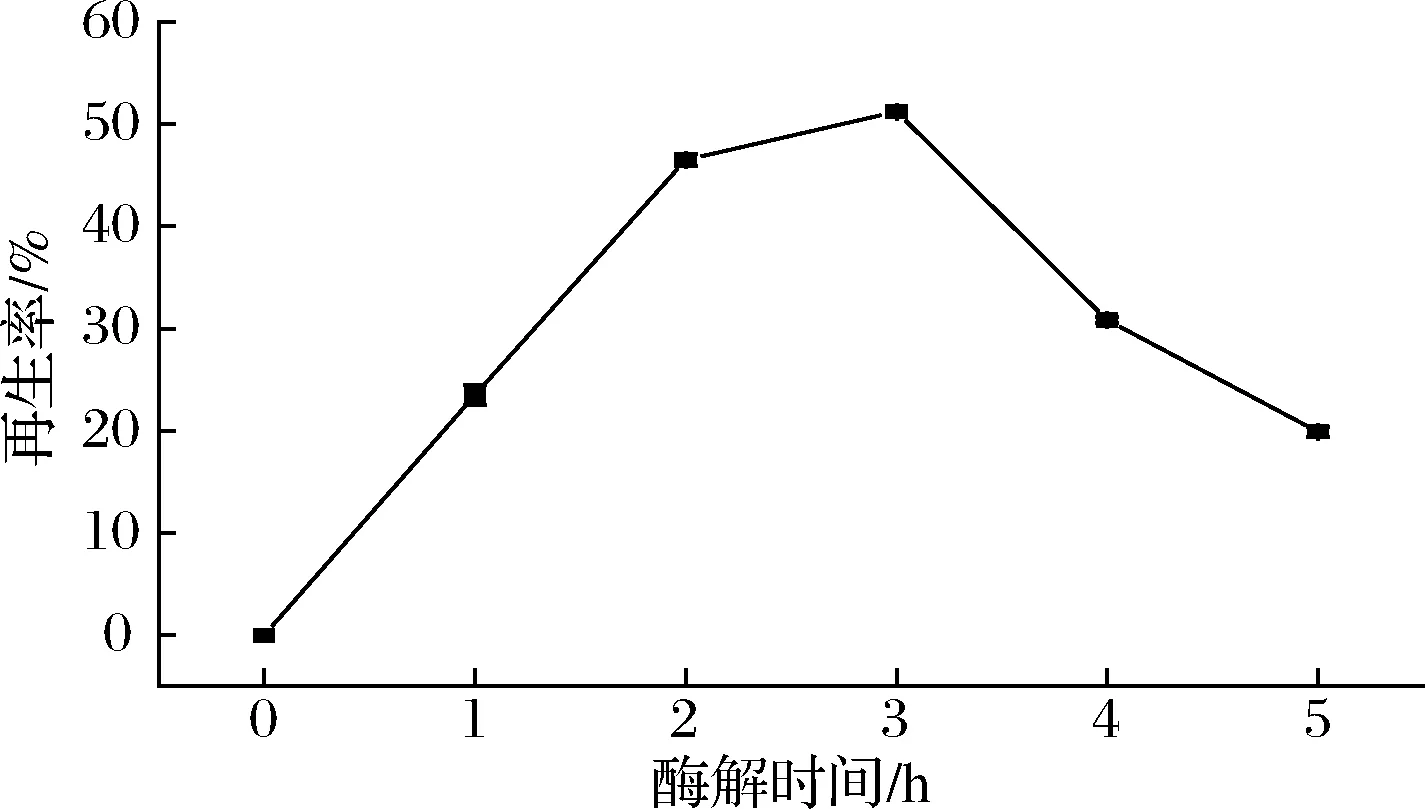
圖3 酶解時間對再生率的影響Fig.3 Effect of enzymatic hydrolysis time on regeneration rate
2.2 不同電場強度及溫度對電轉化效率的影響
電場強度是影響再生率與電轉化效率的關鍵因素。電場強度沒有達到合適的電轉閾值時電轉效率低,而過高的電場強度會對細胞膜造成不可逆的損傷,導致細胞死亡[20]。因此,本研究設置了不同的電壓大小與電脈沖時間,考察其對電轉化效率與再生率的影響。如圖4-a所示,電脈沖時間為1 ms時的再生率高于3 ms時的,而與2 ms時的再生率相差不大。從圖4-b可知電壓大小與電脈沖時間對轉化效率的影響也較大。當脈沖時間為2 ms時的轉化效率比其他兩種脈沖時間的轉化效率要高。可能的原因是低的脈沖時間(1 ms)不足以將核酸穩定地導入細胞內,脈沖時間較長(3 ms)時對細胞的損傷增加導致再生率低。另外,轉化效率受電壓影響很大,且在不同脈沖時間下變化趨勢一致。由此當電壓為0.4 kV,脈沖時間為2 ms時,轉化效率達到最大值(15.7 CFU/μg)。
2.3 核酸濃度、電擊緩沖液的種類與再生時間對電擊轉化效率的影響
外源核酸濃度[21]、電擊緩沖液的種類與再生時間也會影響電擊轉化效率,但對再生率的影響并不顯著(數據未列出)。采用pUC57-AMA1-pgpdA-btwc-1c-TrpC-hph線性質粒(SacI進行單酶切)進行轉化。由圖5-a可知核酸濃度明顯影響了轉化效率,核酸濃度越高轉化效率越低;當核酸質量濃度在2.5 μg/mL時的轉化效率最高(約16 CFU/μg),因此選擇2.5 μg/mL作為轉化時的核酸質量濃度。電轉化時,電轉緩沖液為其提供了重要的環境。目前常用的介質有蔗糖、甘油蔗糖溶液[22]、磷酸鹽緩沖液[22]或山梨醇溶液[23]等,這些介質均能用于電轉化。由圖5-b可知采用10%甘油+0.6 mol/L的蔗糖溶液或者磷酸鹽緩沖液作為電脈沖緩沖液轉化效率較低,而1 mol/L 的山梨醇轉化效率和蔗糖溶液效果均較好,當選擇山梨醇作為電脈沖緩沖液,其轉化效率達到30 CFU/μg。另外,電轉后原生質體再生時間也會影響轉化效率,電轉后細胞受到損傷,需要合適的環境與時間進行修復。再生時間太長會影響野生型與轉化子生長的比例,再生時間過短細胞壁再生效果不好影響轉化效率。由圖5-c可知,再生時間為3 h時轉化效率達到最大值。
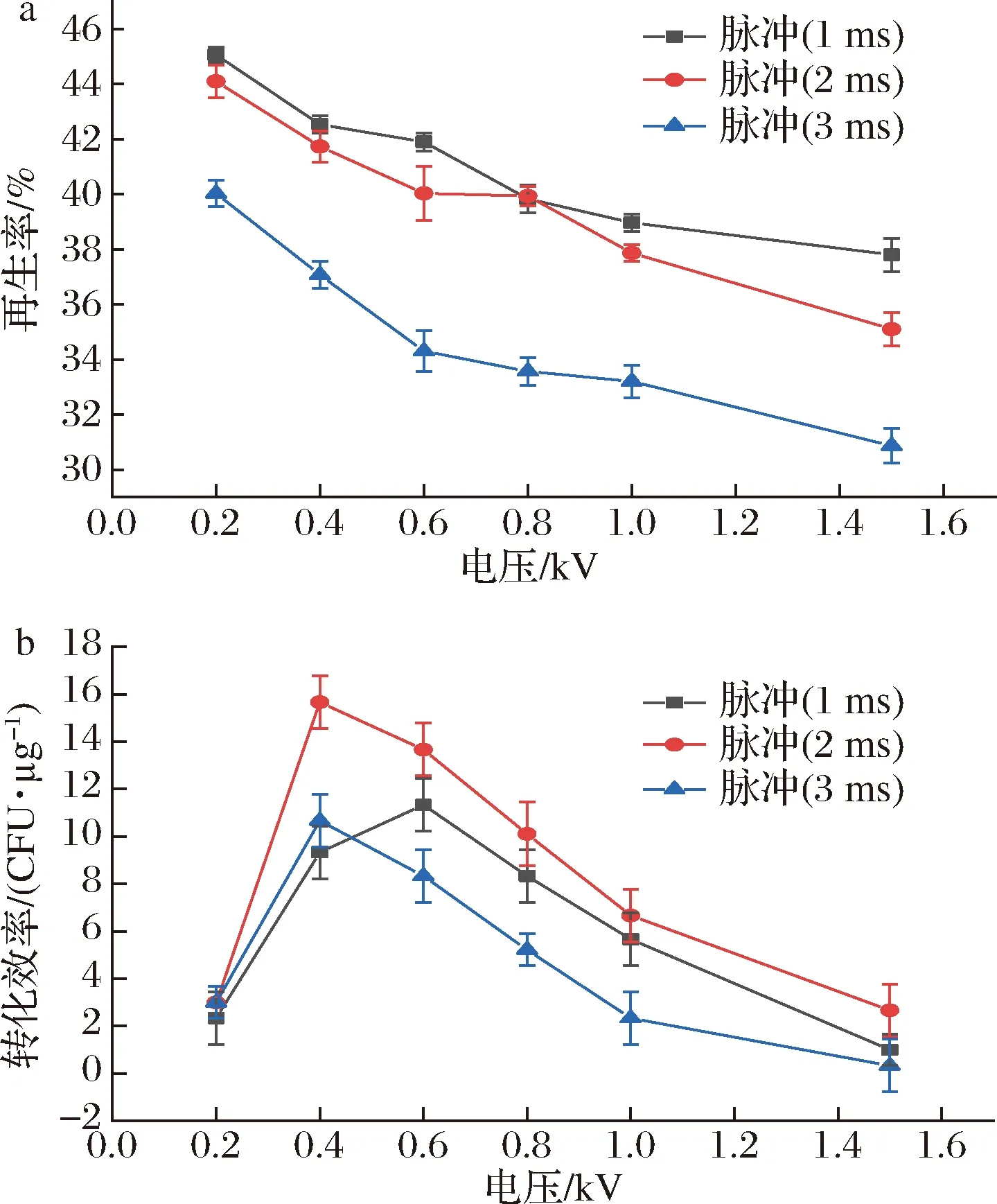
a-電壓與電脈沖對再生率的影響; b-電壓與電脈沖對電轉化效率的影響圖4 三孢布拉霉電擊轉化參數的優化Fig.4 Optimization of electric shock conversion parameters of Blakeslea trispora
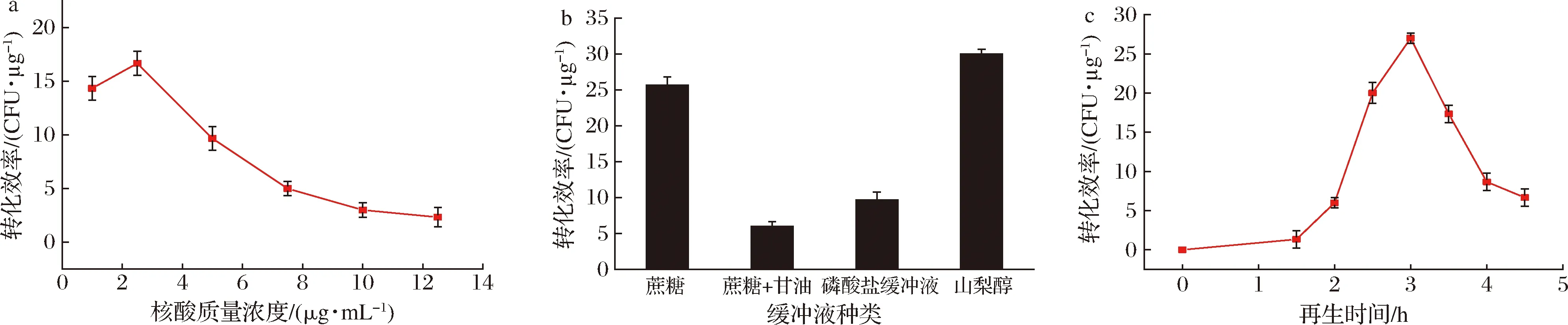
a-核酸濃度對轉化效率的影響;b-電脈沖緩沖液種類對轉化效率的影響;c-再生時間對轉化效率的影響圖5 核酸濃度、電脈沖緩沖液種類與再生時間對電轉化效率的影響Fig.5 The influence of the nucleic acid concentration, the type of electric pulse buffer and the regeneration time on the electric conversion efficiency
2.4 電擊轉化效率的正交試驗分析
在之前單因素試驗的基礎上,選擇電壓、電脈沖時間、核酸濃度及再生時間等因素,設計正交試驗考察它們對電擊原生質體轉化效率的影響。每個因素設置4個水平,每個水平進行3個處理,設置一個空白對照。具體參數如下:電壓(0.2、0.3、0.4、0.5 kV)、電脈沖時間(1、2、3、4 ms)、核酸質量濃度(1、1.5、2、2.5 μg/mL)及再生時間(2、2.5、3、3.5 h)。
通過軟件正交設計助手VII 3.1設計標準正交表,各個因素的離合平方差及極差結果分析如表4所示,根據每個因素不同水平的離合平方差大小,A3B2C4D3為最優組合,轉化效率約35.1 CFU/μg。從表5方差分析可知,再生時間偏差平方和小于誤差平方和,因此再生時間歸入誤差,不考慮顯著性,而電壓大小在不同水平上存在顯著差異(P<0.05)。因此選擇最優組合電壓0.4 kV,電脈沖2 ms,核酸質量濃度2.5 μg/mL,再生時間3 h作為轉化最優條件。
2.5 基于優化的電轉化策略在三孢布拉霉中的應用
將線性化質粒pUC57-AMA1-pgpdA-btwc-1c-TrpC在上述最優電轉條件下轉化至野生型三孢布拉霉中,在25 ℃條件下培養4~5 d,轉化效率為30 CFU/μg。在80 μg/mL的麥汁固體培養基中傳代3次后提取基因組以確定為陽性轉化子,隨后以pgpdA-btwc-1c框為篩選序列,采用引物C-F與C-R進行PCR共篩選到8個穩定的陽性轉化子(圖6-a)。將btwc-1c過表達菌株與野生型菌株培養在光照培養箱中,以tef1[24](轉錄因子編碼基因)作為內源參照基因。實時熒光定量PCR分析結果表明轉化菌中btwc-1c的基因相對表達水平約為野生型菌株的2.5倍(圖6-b),顯示了電轉化的重組載體在三孢布拉霉中表達了btwc-1c;表型分析結果表明轉化菌中β-胡蘿卜素含量相對于野生菌提高了約2.1倍,證明了轉化菌中表達的btwc-1c能夠誘導β-胡蘿卜素的合成。
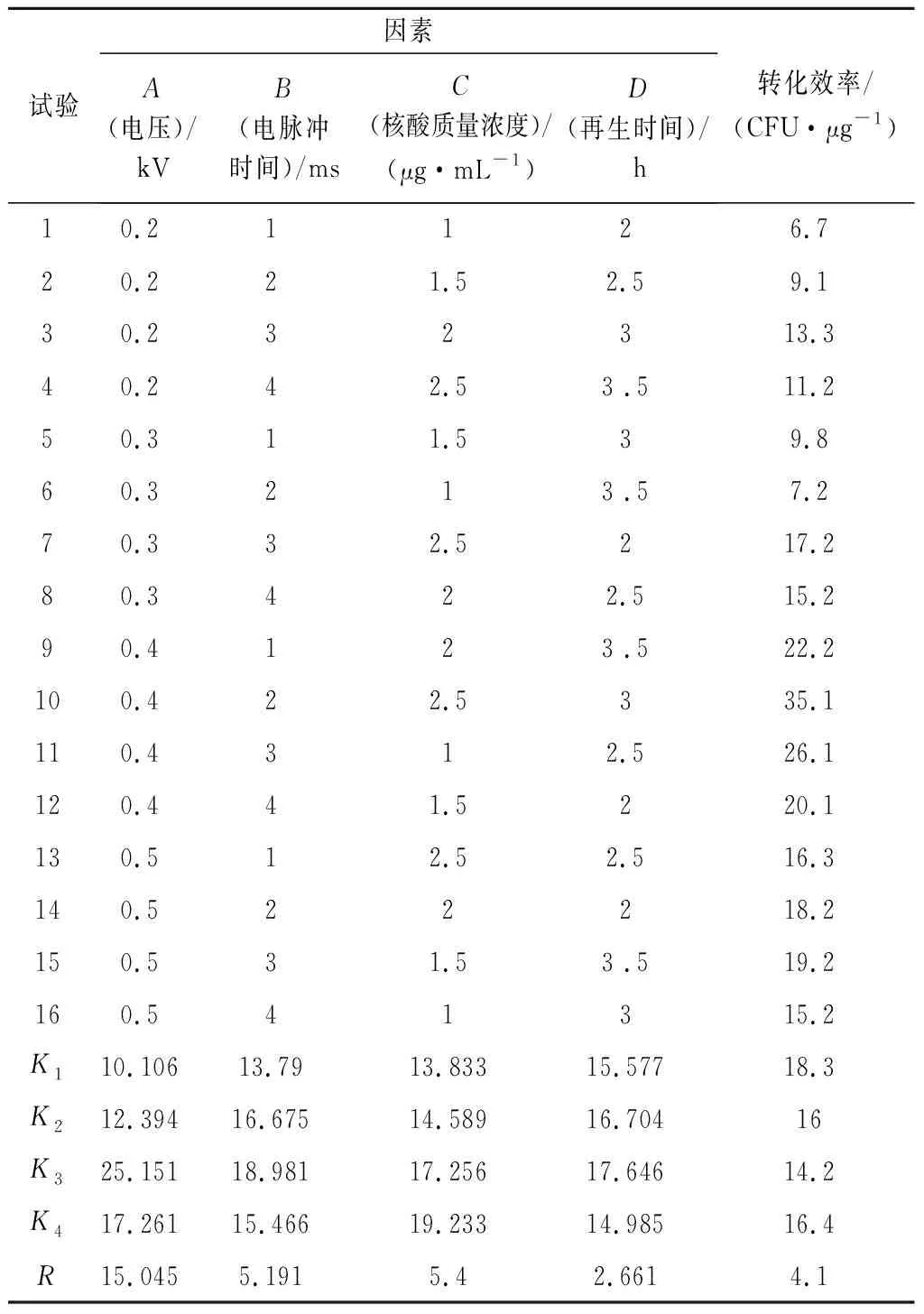
表4 正交分析表Table 4 Orthogonal analysis table
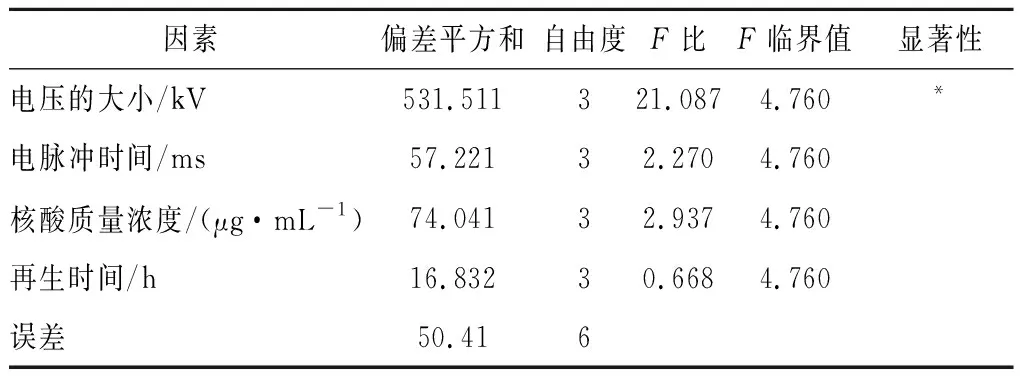
表5 方差分析表Table 5 Table of variance analysis
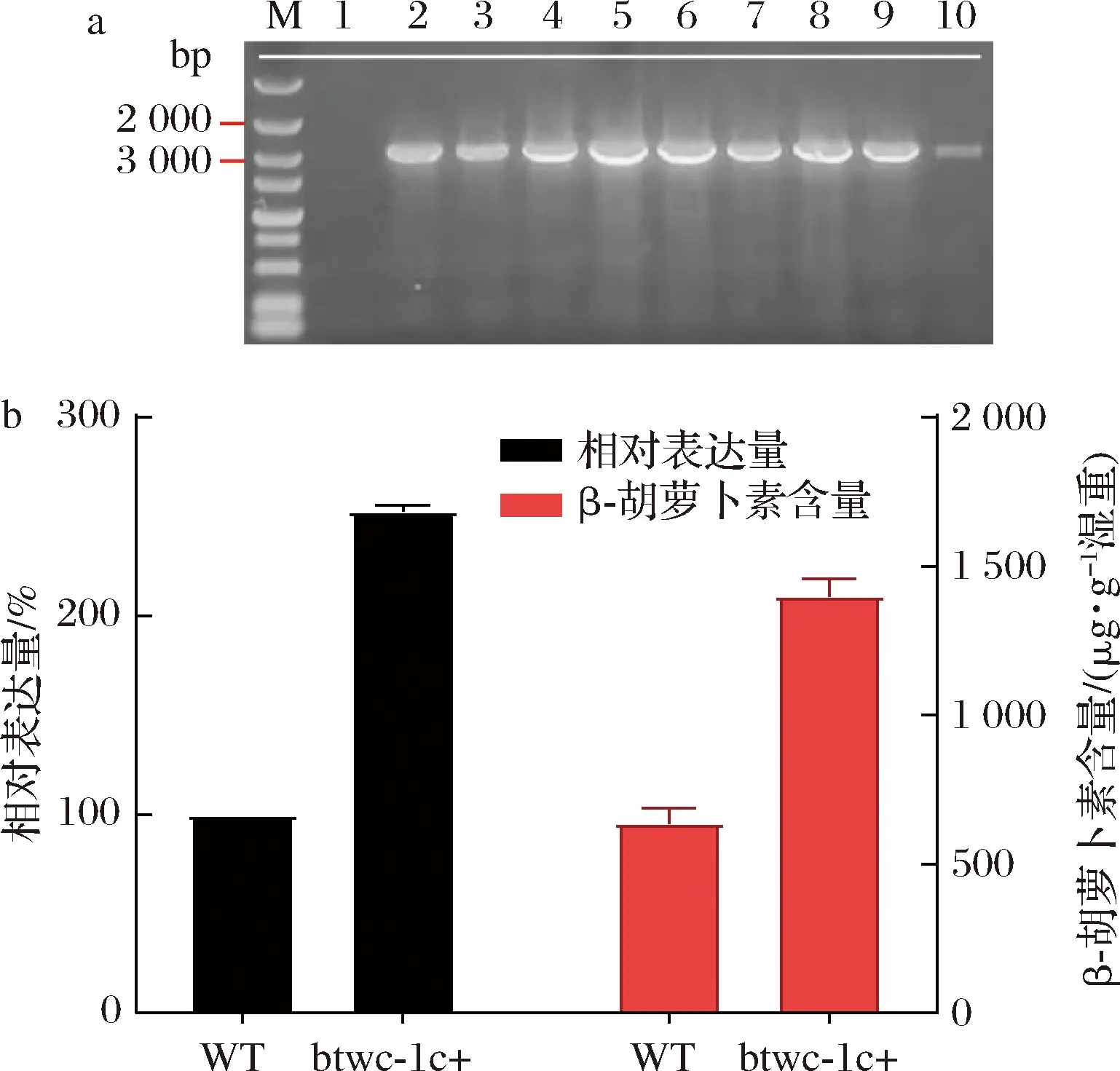
M-DNA maker;1-陰性對照,以野生型為模板的PCR結果; 2-陽性對照,pUC57-AMA1-pgpdA-btwc-1c-TrpC-hph 為模板的PCR擴增結果;3~8-陽性轉化子的PCR擴增結果; WT-野生型三孢布拉霉;btwc-1c+-btwc-1c基因過表達的三孢布拉霉 a-pgpdA-btwc-1c框的電泳圖;b-btwc-1c基因過表達菌株與 野生型菌株相對表達水平及β-胡蘿卜素含量的比較圖6 btwc-1c基因過表達菌株的檢測Fig.6 Detection of btwc-1c gene overexpression strain
3 結論
目前對于三孢布拉霉進行遺傳轉化方法有農桿菌侵染原生質體[5]、原生質體轉化[6]及電轉原生質體[7]等,因轉化效率低造成它們的敲除效率僅在1%~10%。CRISPR/Cas9是最近幾年比較熱門的對微生物進行分子改造的方法,成功實現了對粗糙脈孢菌[25]、黃青霉[26]及米曲霉[27]等絲狀真菌的分子改造。為了提高編輯效率,一般對這些絲狀真菌采用雙質粒進行同時導入。然而,由于農桿菌侵染操作繁瑣、不能同時進行多質粒轉化,且對三孢布拉霉原生質體侵染效率較低導致開發出高效率的編輯策略受到了限制。而電轉化原生質體能夠克服上述多種問題,從而提供了一個潛在的解決方案。為了構建高效的轉化方法從而提升三孢布拉霉的分子改造效率,本研究對三孢布拉霉電擊轉化原生質體進行了優化,包括制備原生質體的酶解時間、電壓大小與電脈沖時間、緩沖液種類、核酸濃度及再生時間等。通過單因素試驗及正交試驗分析最終確定了對培養48 h的三孢布拉霉在0.6 mol/L NaCl酶解液中避光酶解3 h,在1 mol/L的山梨醇電脈沖緩沖液中,核酸添加量為2.5 μg/mL,在0.4 kV、2 ms 的電轉條件下進行電轉,電轉后再生培養3 h,最后涂布在含80 μg/mL潮霉素的麥汁固體培養基中,轉化效率達到了35.1 CFU/μg。最后,以電轉化btwc-1c基因為例,轉化菌中btwc-1c基因表達水平和β-胡蘿卜素合成水平分別提高了2.5倍和2.1倍,證明了本研究建立的轉化方法能夠有效地進行基因轉化,為研究三孢布拉霉中類胡蘿卜素合成調控基因的功能奠定了堅實的基礎。

