漢黃芩苷干預高糖刺激RAW264.7巨噬細胞KLF4/NF-κB信號通路
謝 姍,徐興欣
糖尿病腎病(diabetic nephropathy, DN)是糖尿病最常見的微血管并發癥,在DN發生和發展中巨噬細胞的參與起著至關重要的作用。研究顯示,在DN腎組織中,過表達的Krüppel樣因子4(Krüppel-like factor4,KLF4)可以抑制腎臟炎癥,表現出抗炎、抗纖維化的保護作用[1-3],也可以在巨噬細胞炎癥中進行調節[4-5]。因而,激活KLF4的表達可能是延緩DN進展的有效手段。漢黃芩苷(wogonoside, WG)屬于生物活性黃酮,具有抗氧化、抗炎、抗病毒和抗癌的作用[6]。同時,WG能顯著降低脂多糖(lipopolysaccharide, LPS)刺激引起的巨噬細胞炎癥因子釋放[7]。但是WG是否干預高糖誘導巨噬細胞活化,KLF4是否參與炎癥及WG干預機制,目前尚未見報道。該研究以巨噬細胞為研究對象,通過觀察WG對巨噬細胞中相關信號通路及炎癥因子的影響,探討 KLF4-蛋白核因子κB(nuclear factor κB, NF-κB)信號通路在高糖誘導巨噬細胞激活中的具體機制。
1 材料與方法
1.1 細胞與試劑小鼠巨噬細胞系(RAW264.7)購自中科院上海細胞生物學研究所。WG(Batch NO.:DST210409-026)購自成都樂天美醫藥科技有限公司。兔抗CD68、白介素1β(interleukin-1β,IL-1β)、腫瘤壞死因子α(tumor necrosis factor alpha,TNF-α)、誘生型一氧化氮合酶(inducible nitric oxide synthase, iNOS)、KLF4單克隆抗體購自美國Abcam公司,NF-κB p65、NF-κB pp65單克隆抗體購自美國CST公司,小鼠抗β-actin單克隆抗體、辣根過氧化物酶標記的羊抗兔IgG、羊抗小鼠IgG抗體購自武漢三鷹公司,小鼠TNF-α、IL-1β ELISA試劑盒購自美國R&D公司, DMEM低糖培養基、胎牛血清購自加拿大Wisent公司,D-葡萄糖、2-脫氧-D-葡萄糖(2-deoxy-D-glucose,2-DG)購自美國Sigma公司,BCA蛋白測定試劑盒、SDS-PAGE凝膠試劑盒購自江蘇碧云天公司,TRIzol試劑購自雅酶公司,反轉錄試劑盒、實時熒光定量PCR試劑盒購自艾科瑞生物公司,ECL化學發光試劑盒購自美國Thermo Scientific公司。PCR引物由上海生工生物工程股份有限公司合成。
1.2 方法
1.2.1細胞培養 將RAW264.7細胞培養于含10%胎牛血清的低糖5.5 mmol/L DMEM培養基,放置于條件為37 ℃、5%CO2的培養箱。將細胞隨機分為:LG組(5.5 mmol/L葡萄糖培養基)、D組(30 mmol/L甘露醇培養基)、HG組(30 mmol/L葡萄糖培養基)、LG+WG50組(5.5 mmol/L葡萄糖+50 μmol/L WG)、HG+WG12.5組(30 mmol/L葡萄糖+12.5 μmol/L WG)、HG+WG25組(30 mmol/L葡萄糖+25 μmol/L WG)、HG+WG50組(30 mmol/L葡萄糖+50 μmol/L WG)后同步化培養24 h,高糖刺激在WG預處理2 h后加入培養基,光鏡觀察各組細胞數量及形態變化,檢查各組指標變化,并收集數據。
1.2.2細胞活力測定 將RAW264.7細胞置于96孔板中,于低糖培養條件下同步化24 h后,分別更換0、6.25、12.5、25、50、100 μmol/L WG高糖培養基,24 h后加入CCK-8孵育2 h,酶標儀450 nm波長下進行光密度(optical density,OD)值測定,并使用公式OD(450)實驗組/OD(450)0 μmol/L×100%算出細胞活力。
1.2.3細胞熒光檢測 將RAW264.7細胞以1×105個/孔的密度接種在玻璃皿底,4%多聚甲醛固定10 min,10%牛血清蛋白阻斷30 min,加入iNOS一抗溶液4 ℃孵育過夜。PBS洗滌3次后,加入FITC標記的熒光二抗室溫避光孵育1 h,DAPI染核5 min,加熒光抗淬滅劑封片后,在熒光顯微鏡下觀察并采集圖象,各組隨機選取5~10個高倍鏡視野,使用Image J軟件計數細胞平均數。
1.2.4Western blot分析 收集各組細胞,加RIPA裂解液冰上裂解,BCA試劑盒測定蛋白濃度并計算上樣量。適量蛋白通過SDS-PAGE凝膠進行電泳后轉移到NC膜,用5%的脫脂牛奶封閉2 h,再用稀釋一抗NF-κB p65(1 ∶1 000)、NF-κB pp65(1 ∶1 000)、KLF4(1 ∶1 000)、iNOS(1 ∶1 000)、TNF-α(1 ∶1 000)、IL-1β(1 ∶1 000)4 ℃孵育12 h,用HRP標記的山羊抗鼠或抗兔二抗(1 ∶8 000)進行孵育,TBST洗3次,滴加ECL顯色劑在凝膠成像系統進行化學發光,并用Image J進行半定量分析。
1.2.5qRT-PCR TRIzol試劑裂解細胞后提取總RNA,進行RNA濃度及純度鑒定,使OD260/280在1.8~2.1之間,并在反轉錄系統中逆轉錄為cDNA。依據SYBGREEN PCR試劑盒進行定量分析,終體積10 μl。引物序列見表1。每個樣本設置3個復孔,設置GAPDH為內參對照進行校正,用2-△△Ct計算目的基因的相對表達量。

表1 引物序列
1.3 統計學處理所有數據使用SPSS 18.0軟件進行統計學分析,方差齊性應用Levene法檢驗,兩組間比較應用獨立樣本t檢驗,多組間比較應用單因素方差分析(One-way ANOVA),方差不齊應用K-W檢驗或Wilcoxon秩和檢驗,LSD分析數據以確定顯著差異性。P<0.05表示差異有統計學意義。
2 結果
2.1 WG對RAW264.7細胞活性的影響WG選取0~100 μmol/L范圍中6個濃度,見圖1,當WG濃度在0~50 μmol/L時,高糖刺激后的RAW264.7細胞活性無明顯影響(P>0.05),WG濃度高于50 μmol/L時,細胞活性明顯下降(P<0.01)。
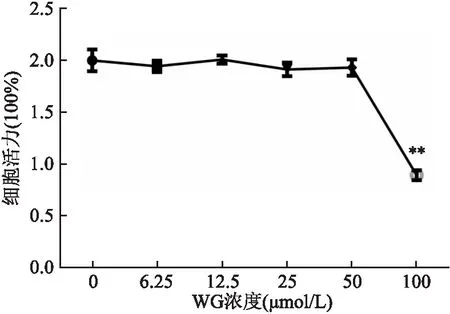
圖1 CCK-8法檢測WG對RAW264.7細胞活性的影響與0 μmol/L WG比較:**P<0.01
2.2 高糖刺激各組巨噬細胞iNOS的表達高糖刺激的巨噬細胞中iNOS表達量增高,陽性細胞數明顯高于低糖培養的巨噬細胞(P<0.01),表明高糖可以促進巨噬細胞炎癥。加入50 μmol/L WG預處理的高糖巨噬細胞,iNOS表達的陽性細胞數明顯低于HG組,差異有統計學意義(P<0.01),見圖2。
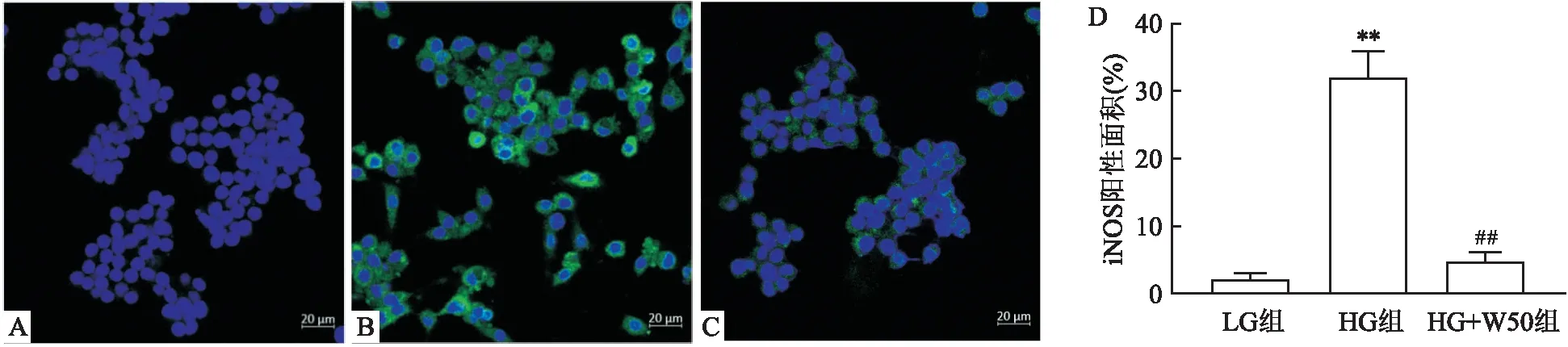
圖2 LG組、HG組與HG+W50組iNOS的表達 ×400A:LG組;B:HG組;C:HG+W50組;D:熒光鏡下iNOS陽性面積統計;與LG組比較:**P<0.01;與HG組比較:##P<0.01
2.3 WG減輕高糖刺激RAW264.7細胞引起的炎癥Western blot、qRT-PCR結果顯示,WG預處理2 h后,高糖刺激的RAW264.7細胞iNOS、TNF-α、IL-1β、NF-κB pp65表達均明顯增高(P<0.01),WG明顯抑制iNOS、TNF-α、IL-1β、NF-κB pp65表達,且50 μmol/L的抑制程度最明顯,與HG組對比,差異有統計學意義(P<0.01),見圖3~5。ELISA法檢測各組細胞上清液,結果表明高糖刺激上清液中TNF-α、IL-1β表達增高,不同濃度的WG作用后TNF-α、IL-1β呈濃度依賴性降低(P<0.01),見圖6。

圖3 Western blot檢測各組細胞中NF-κB p65、NF-κB pp65、KLF4、iNOS、TNF-α及IL-1β蛋白表達A:LG組、HG組、D組、LG+W50組的Western blot實驗條帶圖;B:NF-κB p65、NF-κB pp65、KLF4、iNOS、TNF-α及IL-1β蛋白表達半定量統計;與LG組比較:**P<0.01;與HG組比較:##P<0.01

圖4 Western blot檢測各組細胞中NF-κB p65、NF-κB pp65、KLF4、iNOS、TNF-α及IL-1β蛋白表達A:LG組、HG組、HG+W12.5組、HG+W25組和HG+W50組的Western blot實驗條帶圖;B:NF-κB p65、NF-κB pp65、KLF4、iNOS、TNF-α及IL-1β蛋白表達半定量統計;與LG組比較:**P<0.01;與HG組比較:#P<0.05,##P<0.01

圖5 qRT-PCR檢測各組細胞中KLF4、iNOS、TNF-α及IL-1β mRNA表達A: KLF4 mRNA表達;B iNOS mRNA表達;C:TNF-α mRNA表達;D: IL-1β mRNA表達;a:LG組;b:HG組;c:D組;d:LG+W50組;e:HG+W12.5組;f:HG+W25組;g:HG+W50組;與LG組比較:**P<0.01;與HG組比較:#P<0.05,##P<0.01

圖6 各組細胞上清液中炎癥因子TNF-α及IL-1β水平變化A:TNF-α表達水平;B:IL-1β表達水平;a:LG組;b:HG組;c:D組;d:LG+W50組;e:HG+W12.5組;f:HG+W25組;g:HG+W50組;與LG組比較:**P<0.01;與HG組比較:##P<0.01
2.4 WG干預高糖刺激RAW264.7細胞中KLF4的表達Western blot結果顯示,高糖刺激后,巨噬細胞內KLF4蛋白表達量較LG組下降(P<0.01),在WG干預后,KLF4的蛋白表達量呈現增高現象(P<0.01),見圖3、4。通過qRT-PCR再次觀察了KLF4 mRNA表達量變化,結果同樣顯示巨噬細胞內KLF4 mRNA表達量較LG組下降(P<0.01),在WG干預后,KLF4 mRNA的表達量呈現劑量依耐性增高現象(P<0.01),見圖5A。
3 討論
DN已經成為終末期腎臟病的主要原因之一,且在中國人群中的患病率逐年上升[8]。眾所周知,自身免疫病發展與巨噬細胞的長期激活有關,持續不斷分泌的炎癥因子,最終對正常組織及細胞造成無法修復的損害,導致腎組織纖維化及腎臟功能下降[9]。本實驗以高糖刺激的巨噬細胞為研究對象,模擬糖尿病高糖環境,探究WG抑制DN炎癥發展的可能機制。
在長期高血糖狀態下,巨噬細胞在腎組織中異常聚集,激活TLR4、NF-κB等通路,分泌大量TNF-α、IL-1β炎癥因子,導致腎小球、腎小管及基底膜病理性改變,進而出現蛋白尿增多等臨床癥狀。TNF-α和IL-1β被稱作巨噬細胞炎癥的“警報細胞因子”,它們會進一步誘導促炎基因iNOS的產生。此次研究中采用高糖刺激小鼠RAW264.7巨噬細胞,觀察炎癥信號蛋白及相關炎癥因子表達。結果表明,高糖刺激后,NF-κB p65、NF-κB pp65、iNOS表達增高,促炎因子TNF-α、IL-1β表達明顯上調,巨噬細胞極化。與Zhu et al[9]及湯祥瑞 等[10]研究結果相似,高糖可以直接或間接的刺激巨噬細胞遷移、炎癥因子的分泌及iNOS表達增加。
巨噬細胞是先天免疫的重要參與者,而KLF4是巨噬細胞生物學中的關鍵介質,起著調節巨噬細胞促炎效應。本研究顯示,KLF4在高糖誘導的RAW264.7細胞中表達下調,并且伴隨炎癥因子的釋放及iNOS的增加。與多數研究[11-12]結果一致,KLF4在腎臟保護及炎癥抑制方面有極大地探索意義。有研究[2-3, 13]報道KLF4抑制STAT3、mTOR和NF-κB p65的激活,以改善動脈粥樣硬化及膿毒血癥等疾病的進展。此研究驗證出高糖刺激巨噬細胞24 h出現抑制KLF4表達的情況,說明在炎癥狀態中KLF4是處于低表達狀態。也有文獻[3]報道在炎癥激活過程中,NF-κB p65活性增強抑制KLF4的轉錄作用,KLF4表達下調會激活NF-κB pp65的表達,兩者形成正反饋效應加快炎癥反應的進行。由此推測KLF4介導是DN炎癥發展過程的重要環節。
WG是一種低毒、低成本、高療效的黃酮類天然化合物[8],具有抗炎、抗氧化、抗癌等作用。多數研究證明,WG有顯著的抗炎活性,可以明顯減輕結腸炎[6]、脂肪肝[14]及慢性咽炎[15]等疾病進展,但在DN介導的慢性炎癥中的作用及機制還有待探索。在本研究中,通過CCK-8實驗驗證高糖條件下細胞安全濃度范圍,再用不同濃度的WG給予細胞預處理,然后再用高糖刺激巨噬細胞活化。結果表明,WG減輕HG組巨噬細胞TNF-α、IL-1β的分泌和iNOS的表達,這種作用是通過抑制NF-κB p65的磷酸化,逆轉巨噬細胞抗炎活性,成功減輕了高糖誘導的巨噬細胞炎癥。此外,KLF4表達量在WG作用下呈劑量依賴性遞增,提示KLF4不僅是炎癥中的重要參與者,更在DN中發揮保護性作用,并參與到WG的治療機制中。
綜上所述,本研究表明高糖刺激巨噬細胞后,其KLF4表達減少,而WG可以刺激巨噬細胞KLF4的表達增高,進而抑制高糖刺激巨噬細胞產生促炎因子和炎性物質,其機制是由于KLF4表達增高抑制了NF-κB p65的磷酸化,進而減少了iNOS的表達。提示KLF4/NF-κB相關信號通路可能參與到WG影響巨噬細胞改善DN的過程。由于本研究缺乏對相關靶向蛋白干預和相應體內模型驗證,將在以后的研究中加以探討,以期為DN的治療提供新的思路。

