基于兩步法制備生物發酵蛋白工藝的研究
蔡 吉,陳文聰,劉 軍*,李 麗,張桂容,附俊杰,馮潔雅,2,劉雪嬌,2
(1.四川輕化工大學 生物工程學院,四川 宜賓 644005;2.四川省綿陽市豐谷酒業有限責任公司,四川 綿陽 621000)
菜籽粕是油菜籽提取菜籽油后得到的一種副產品,我國自20世紀80年代開始,每年產生超過600萬t的菜籽粕,其粗蛋白含量約為35%~45%,且氨基酸較為平衡,是一種物美價廉的植物蛋白資源[1-3]。豆粕是經過大豆提取豆油后得到的一種副產品,其產量巨大、營養豐富,目前仍是動物飼料的主要原料,但近年來對豆粕需求的不斷增加導致市場供應需求緊張,為緩解供應緊張、降低成本,已將菜籽粕用于畜牧行業中以減少或替代豆粕使用[4]。與豆粕相比,菜籽粕的維生素B1(vitamin B1,VB1)、VB2、膽堿、煙酸、生物素和鈣、磷、硒等礦物質元素含量較高,特別是無機磷[5]。但菜籽粕中含有大量的抗營養因子,如硫苷(glucosinolates,GLS)、芥子堿和單寧等。硫苷會在芥子酶的作用下水解生成嗯唑烷硫酮、異硫氰酸酯、腈等有毒物質,長期攝入會造成動物的腎臟、肝臟等內臟器官的損害和腫大[6]。因此,要想提高菜籽粕的蛋白利用率就必須消除其主要的抗營養因子。微生物發酵技術能有效去除多種餅粕中的抗營養因子[7],從而達到降解和排毒的目的。此外,微生物發酵還能夠生成大量的菌體蛋白和一些促進動物腸道內有益菌群生長的活性物質[8]。如司馬博鋒等[9]以棉粕、菜籽粕和豆粕為原料,發酵制備的發酵蛋白,將粗蛋白含量提高了9%,氨基酸含量提高了11.6%,同時抗營養因子游離棉酚降解了45.4%,異硫氰酸酯降解了27.8%。
發酵、酶解兩步法充分利用了微生物在發酵過程中產生酶,無需使用外源酶制劑,生物資源的利用達到最大化,可有效改善低質原料蛋白質品質,降解原料中的抗營養因子,完善氨基酸組成,降低生產成本,改善原料的適口性,提高動物的采食率。相比傳統固態發酵,固態發酵、酶解兩步法大幅縮短了處理時間,減少了對固態發酵條件的控制依賴,使得終產物得率不僅僅依賴于發酵過程,增大了固態發酵的應用范圍。因此,本試驗利用米曲霉(Aspergillus oryzae)發酵糧油提取副產物—菜籽粕與豆粕兩種蛋白原料,充分利用植物資源,以期為食品行業增加產品附加值的同時,為飼料行業提供一種成本低、動物適口性佳、營養組成合理的新型蛋白原料。
1 材料與方法
1.1 材料與試劑
米曲霉(Aspergillus oryzae)M1:本實驗室保藏。
菜籽粕、豆粕、麩皮、玉米蛋白粉:樂山恒峰華邦科技有限公司。
麩皮種子培養基:麩皮∶水=2∶1(W/W)。
葡萄糖、蔗糖、硫酸鉀、硫酸鎂、吐溫-80、乙酸鈉、氯化鈀、羧甲基纖維素鈉、三氯乙酸(trichloroacetic acid,TCA)、氫氧化鈉、硼酸、硫酸銅(均為分析純)、酵母浸粉、牛肉膏(均為生化試劑):成都科龍化工試劑廠;黑芥子硫苷酸鉀(分析純):上海源葉生物有限公司。
1.2 儀器與設備
MF80BSH-2霉菌培養箱:上海新苗醫療器械制造有限公司;QYC-2102C恒溫培養搖床:上海福馬實驗設備有限公司;LS-75HD立式高壓蒸汽滅菌鍋:江陰濱江醫療設備有限公司;T-114分析天平:北京賽多利斯儀器系統有限公司;T6紫外-可見分光光度計:北京普析通用儀器有限公司;AT-710電位自動滴定計:日本京都電子制造有限公司;SH220F石墨消解儀、K9840自動凱氏定氮儀:海能未來技術集團股份有限公司。
1.3 方法
1.3.1 米曲霉麩皮種子制備
使用接種環勾取2~3環本實驗室保藏的米曲霉菌種,接種于裝有25 g麩皮種子培養基的500 mL錐形瓶,30 ℃恒溫培養72 h。
1.3.2 發酵蛋白原料組成優化
將發酵蛋白原料(菜籽粕、豆粕、玉米蛋白粉)以不同組成(60%、30%、10%;60%、40%、0;70%、25%、5%;70%、20%、10%;70%、30%、0;80%、15%、5%;80%、10%、10%;80%、20%、0)混合均勻,吐溫-80溶解于1 000 mg/L的過氧乙酸溶液(溫度約50 ℃),吐溫-80含量為800 mg/L。用上述溶液調節發酵蛋白原料初始含水量為45%,靜置滅菌30 min后,取150 g發酵蛋白原料裝于2 L錐形瓶中,接種3%米曲霉麩皮種子,搖勻,棉花塞封口,30 ℃發酵48 h。發酵結束,取140 g發酵樣品,調節初始含水量為60%,密封,45 ℃酶解24 h,后70 ℃烘干24 h,粉碎后過40目篩網,測定樣品蛋白溶解度、酸溶蛋白/粗蛋白及硫苷含量。
1.3.3 固態發酵蛋白培養條件優化
確定發酵蛋白原料組成后,分別對發酵過程中麩皮種子接種量(1%、2%、3%、4%、5%)、發酵時間(24 h、32 h、40 h、48 h、56 h)、發酵原料初始含水量(30%、35%、40%、45%、50%)、發酵溫度(26 ℃、28 ℃、30 ℃、32 ℃、34 ℃)進行優化。固態發酵結束后按1.3.2的條件酶解,測定樣品蛋白溶解度、酸溶蛋白/粗蛋白及硫苷含量。
在單因素試驗的基礎上,選取影響顯著的3個主要因素接種量(A)、發酵溫度(B)及發酵時間(C),設計3因素3水平正交試驗,對固態發酵蛋白培養條件進行優化,正交試驗因素與水平見表1。固態發酵結束后按1.3.2的條件酶解,測定樣品蛋白溶解度、酸溶蛋白/粗蛋白及硫苷含量。

表1 固態發酵蛋白培養條件優化正交試驗因素與水平Table 1 Factors and levels of orthogonal tests for optimization of protein culture conditions by solid-state fermentation
1.3.4 酶解條件優化
對優化培養條件的發酵樣品進行酶解條件優化。分別考察酶解時間(20 h、24 h、28 h、32 h、36 h、40 h)、酶解樣品初始含水量(45%、48%、50%、52%、54%、56%、58%、60%)、酶解溫度(40 ℃、45 ℃、50 ℃、55 ℃、60 ℃)對酶解效果的影響,樣品于70 ℃烘干24 h,粉碎后過40目篩網,測定樣品蛋白溶解度、酸溶蛋白/粗蛋白及硫苷含量。
1.3.5 測定方法
粗蛋白:根據GB/T 6432—2018《飼料中粗蛋白的測定凱氏定氮法》測定[10];蛋白溶解度:根據GB/T 19541—2017《飼料原料豆粕》氫氧化鉀蛋白溶解度的測定[11];酸溶蛋白:采用參考文獻[12]的三氯乙酸沉淀法測定;硫苷(GLS)測定:采用參考文獻[13]的氯化鈀比色法測定。氨基酸測定:采用GB 5009.124—2016《食品中氨基酸的測定》測定[14]。
1.3.6 數據處理
使用Microsoft Excel 2016數據整理,使用SPSS 23對數據進行分析,多組數據使用單因素方差分析(analysis of variance,ANOVA),以Duncan檢驗法進行多重比較,以P<0.05作為差異性顯著判斷標準,試驗結果采用“平均值±標準差”表示,數值標注不同字母表明差異性顯著,采用Origin 2018和Microsoft Excel 2016作圖。
2 結果與分析
2.1 原料組成對發酵蛋白品質的影響
酸溶蛋白主要由小分子菜籽粕肽和游離氨基酸組成,其中小肽由2~20個氨基酸組成,是酸溶蛋白中的主要成分,分子質量均低于6 000 Da[13],酸溶蛋白含量越高表明其中小肽和游離氨基酸含量也越高[15-16],其中游離氨基酸和部分小肽可被直接吸收利用[17]。如YAMADA Y等[18-19]分別從菜籽粕水解物中分離出具有降壓活性的三肽,其氨基酸序列分別為Arg-Ile-Tyr和Gly-His-Ser,均具有較好的降壓效果。酸溶蛋白含量可以有效反映蛋白原料質量的高低。油菜籽經過壓榨或其他熱處理方式分離油脂與菜籽蛋白時,高溫會使菜籽蛋白受到不同程度的不可逆轉的熱變。熱反應會使蛋白溶解度下降,原因為高溫使蛋白發生解離,疏水基團暴露蛋白結構性展開,疏水性的增加引起蛋白溶解度下降[20]。但蛋白溶解也受到處理方式的變化存在差異,有時高熱變性也具有較高的蛋白溶解度[21]。原料組成對發酵蛋白品質的影響見表2。由表2可知,當原料組成為70%菜籽粕+30%豆粕時,其蛋白溶解度為70.26%,顯著高于其他組(P<0.05);酸溶蛋白/粗蛋白的比值也較高,硫苷含量較低。因此,確定發酵蛋白原料組成為70%菜籽粕+30%豆粕。
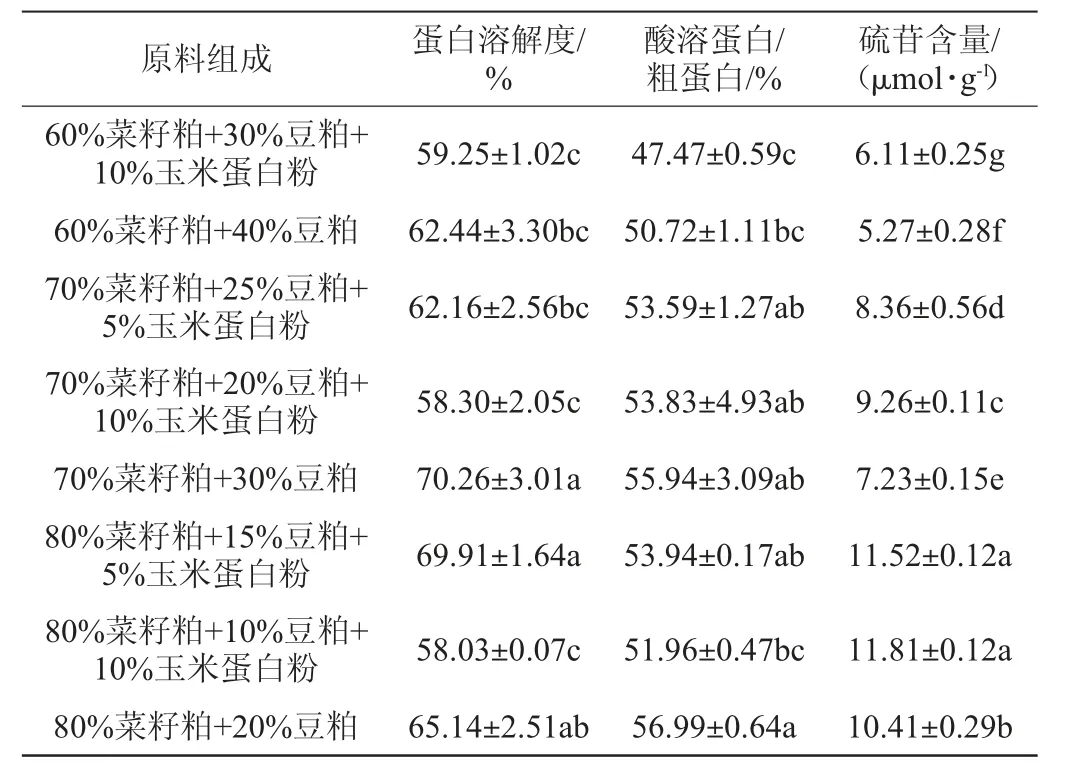
表2 原料組成對發酵蛋白品質的影響Table 2 Effect of raw material composition on fermented protein quality
2.2 固態發酵蛋白培養條件優化
2.2.1 接種量對發酵蛋白品質的影響
由圖1可知,隨著米曲霉麩皮種子接種量的增加,發酵蛋白的蛋白溶解度、硫苷含量先升高后降低,酸溶蛋白/粗蛋白變化不大。當接種量為3%時,蛋白溶解度最高,酸溶蛋白/粗蛋白較高且差異不顯著(P>0.05),硫苷含量較低且差異不顯著(P>0.05)。原因可能是適當增加接種量,由于培養基中產酶增加而蛋白溶解度得到有效改善;但當接種量>3%時,原料中溶氧不足,降解大分子蛋白與硫苷的酶合成受到一定影響[22]。因此初步確定最優米曲霉麩皮種子接種量為3%。

圖1 接種量對發酵蛋白品質的影響Fig.1 Effect of inoculum on fermented protein quality
2.2.2 發酵時間對發酵蛋白品質的影響
由圖2可知,隨發酵時間的延長,發酵蛋白的蛋白溶解度與酸溶蛋白/粗蛋白先升高后降低,硫苷含量升高。在發酵40 h時,蛋白溶解度較高且差異不顯著(P>0.05),酸溶蛋白/粗蛋白最高且差異顯著(P<0.05),硫苷含量較低且差異不顯著(P>0.05)。可能是因為隨發酵時間的延長,酶的活性受到影響,從而使酶解階段的硫苷降解率減少。因此初步確定最優發酵時間為40 h。

圖2 發酵時間對發酵蛋白品質的影響Fig.2 Effect of fermentation time on fermented protein quality
2.2.3 發酵原料初始含水量對發酵蛋白品質的影響
由圖3可知,隨著發酵原料初始含水量的增加,蛋白溶解度、酸溶蛋白/粗蛋白呈上升趨勢,而硫苷呈現下降趨勢;且在水分為45%時,酸溶蛋白/粗蛋白含量最高,為51.83%,但當發酵水分>45%后,蛋白溶解度、酸溶蛋白/粗蛋白開始降低,硫苷升高,且差異顯著(P<0.05)。據相關文獻報道,米曲霉在曲料上充分生長發育產生醬油發酵所需要的中性及酸性蛋白酶類、氨肽酶、淀粉酶、糖化酶、纖維素酶等[23]。酶產量及活性與微生物生長代謝狀況直接相關,水分過高影響培養基中的疏松程度,溶氧量低,會抑制纖維素酶和硫苷水解酶等的產量,從而導致后續酶解階段對硫苷的降解減弱,而水分過低又會影響麩皮中的活化萌發速度,延遲發酵時間。因此初步確定最優發酵原料初始含水量為45%。
2.2.4 發酵溫度對發酵蛋白品質的影響
由圖4可知,隨著發酵溫度的升高,發酵蛋白的蛋白溶解度和酸溶蛋白/粗蛋白均先升高后降低,硫苷含量升高。在發酵溫度28 ℃時,蛋白溶解度和酸溶蛋白/粗蛋白均達到最高且差異顯著(P<0.05),硫苷含量較低且差異不顯著(P>0.05)。可能是28 ℃時蛋白酶的產量和酶活力相對較高,硫苷水解酶最適作用溫度為40~60 ℃,發酵溫度未能達到,主要依靠酶解階段進行降解。因此初步確定最優發酵溫度為28 ℃。
2.2.5 固態發酵蛋白培養條件優化正交試驗
由表3可知,3個因素對發酵蛋白蛋白溶解度的影響主次順序為B>C>A;對酸溶蛋白/粗蛋白的影響主次順序為C>B>A。以蛋白溶解度、酸溶蛋白/粗蛋白為考察指標時的最優組合均為A2B2C2,即接種量為3%、發酵溫度為28 ℃、發酵時間為40 h。在此條件下,發酵蛋白的蛋白溶解度為63.54%,酸溶蛋白/粗蛋白為47.56%,硫苷含量為14.13μmol/g。
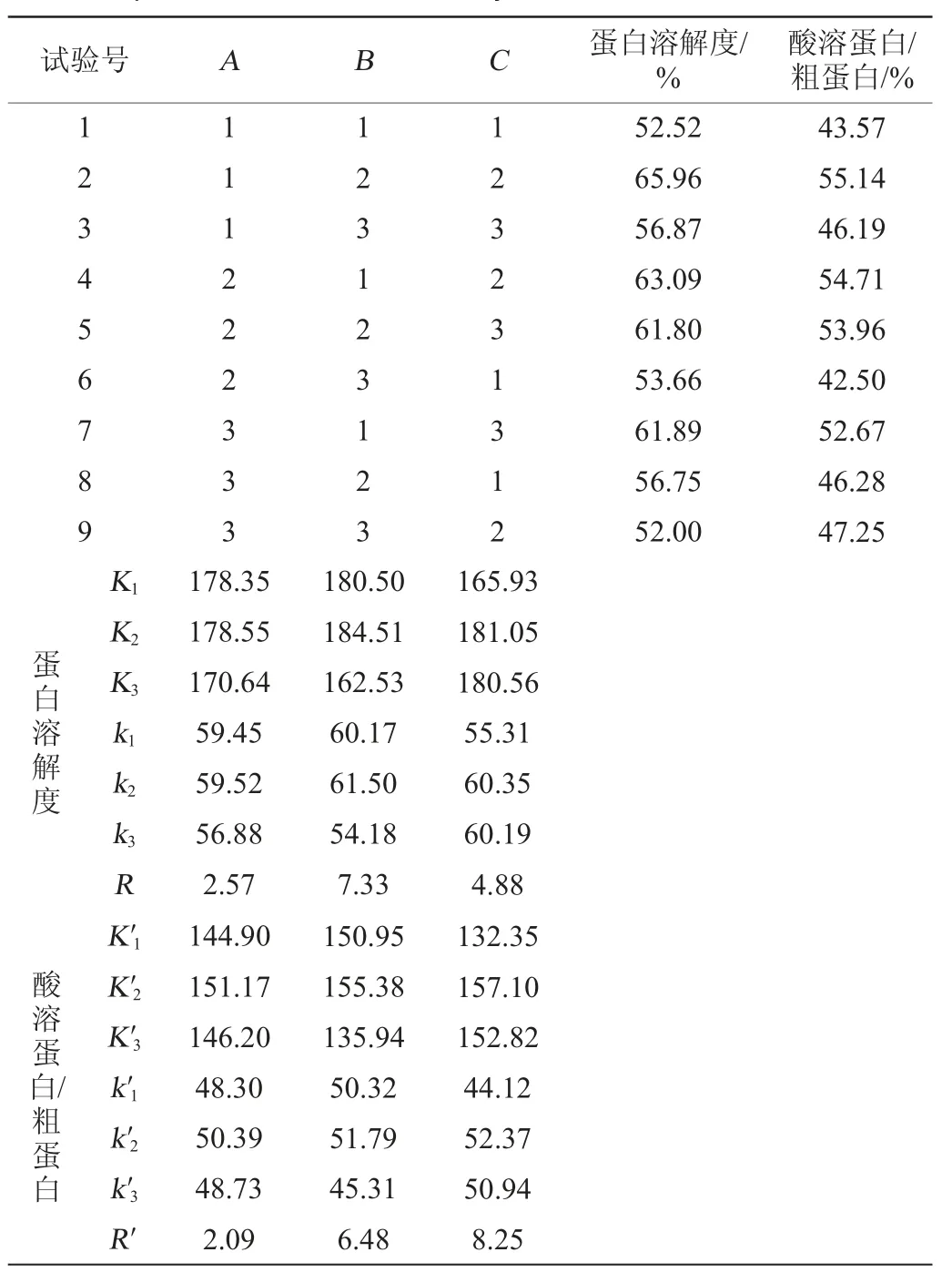
表3 固態發酵蛋白培養條件優化正交試驗結果與分析Table 3 Results and analysis of orthogonal tests for optimization of protein culture conditions by solid-state fermentation
2.3 酶解條件優化
2.3.1 酶解時間對發酵蛋白品質的影響
由圖5可知,隨著酶解時間的延長,蛋白溶解度和酸溶蛋白/粗蛋白有小幅升高,但差異不顯著(P>0.05);硫苷含量先升高后降低再緩慢升高。在酶解32 h時,硫苷含量達到最低,可能是固態發酵過程中產生的分解硫苷的酶類有限,當酶解時間超過32 h,酶活性降低,硫苷降解減弱。綜合考慮,確定最優酶解時間為32 h。
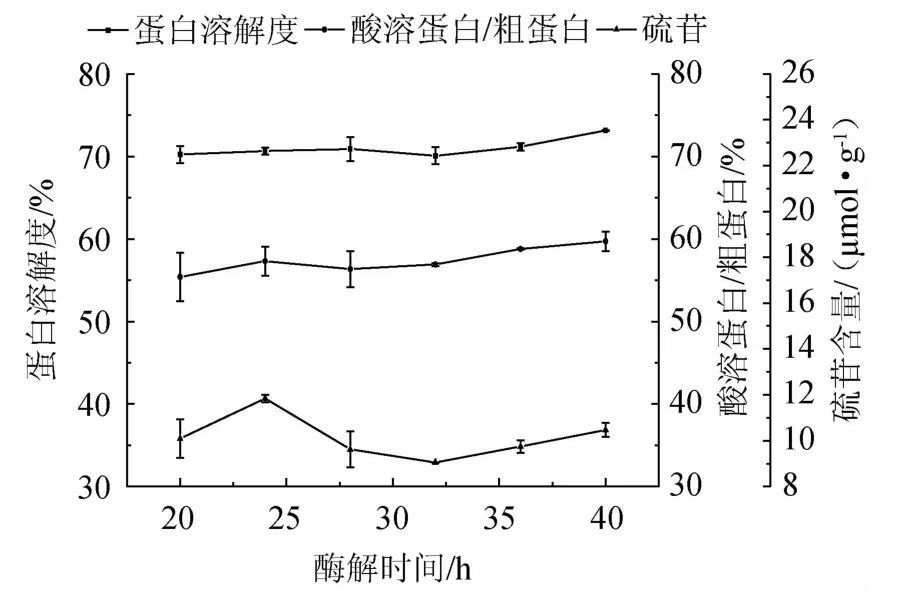
圖5 酶解時間對發酵蛋白品質的影響Fig.5 Effect of enzymolysis time on fermented protein quality
2.3.2 酶解樣品初始含水量對發酵蛋白品質的影響
由圖6可知,隨酶解樣品初始含水量的增加,發酵蛋白的蛋白溶解度有小幅度升高后降低,但差異不顯著(P>0.05),酸溶蛋白/粗蛋白呈升高趨勢且差異顯著(P<0.05),硫苷含量先降低后升高,但差異不顯著(P>0.05)。在酶解樣品初始含水量56%時,酸溶蛋白/粗蛋白達最高。水分含量的高低在影響微生物生長的同時,主要影響酶的作用效果,酶解樣品初始含水量超過56%時,蛋白酶的活性和穩定性下降。綜合考慮,確定最優酶解樣品初始含水量為56%。
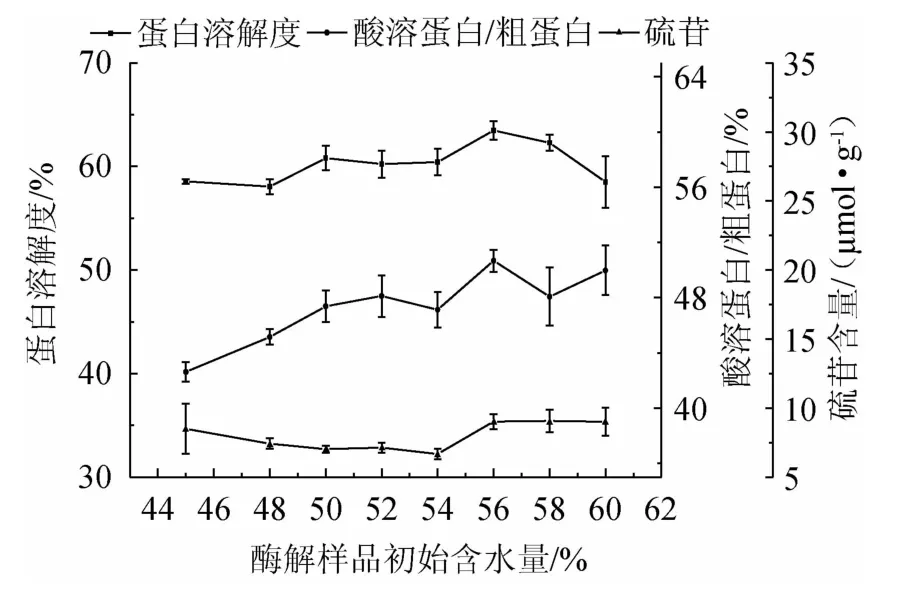
圖6 酶解樣品初始含水量對發酵蛋白品質的影響Fig.6 Effect of initial moisture in enzymolysis sample on fermented protein quality
2.3.3 酶解溫度對發酵蛋白品質的影響
由圖7可知,隨酶解溫度的升高,發酵蛋白的蛋白溶解度、酸溶蛋白/粗蛋白均先升高后降低,硫苷含量先小幅降低再升高再降低。酶解溫度為50 ℃時,發酵蛋白的蛋白溶解度、酸溶蛋白/粗蛋白均達最高且差異顯著(P<0.05),硫苷含量降至最低但差異不顯著(P>0.05)。綜合考慮,確定最優酶解溫度為50 ℃。
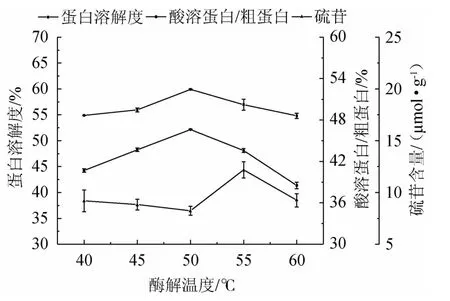
圖7 酶解溫度對發酵蛋白品質的影響Fig.7 Effect of enzymolysis temperature on fermented protein quality
2.4 發酵蛋白品質及氨基酸含量分析
氨基酸對動物的免疫機能影響重大,缺乏氨基酸動物就會出現生長受阻,胸腺退化,脾臟淋巴細胞分裂降低等現象[24-26]。由表4可知,與未處理的原料相比,發酵蛋白的蛋白溶解度(65.80%)提高97.49%,酸溶蛋白/粗蛋白(44.13%)提高779.75%,硫苷含量(8.63 μmol/g)降低69.14%。經固態發酵、酶解后,發酵蛋白的天冬氨酸、甘氨酸、丙氨酸、半胱氨酸、纈氨酸、甲硫氨酸、異亮氨酸、亮氨酸、脯氨酸含量均顯著提高(P<0.05)。
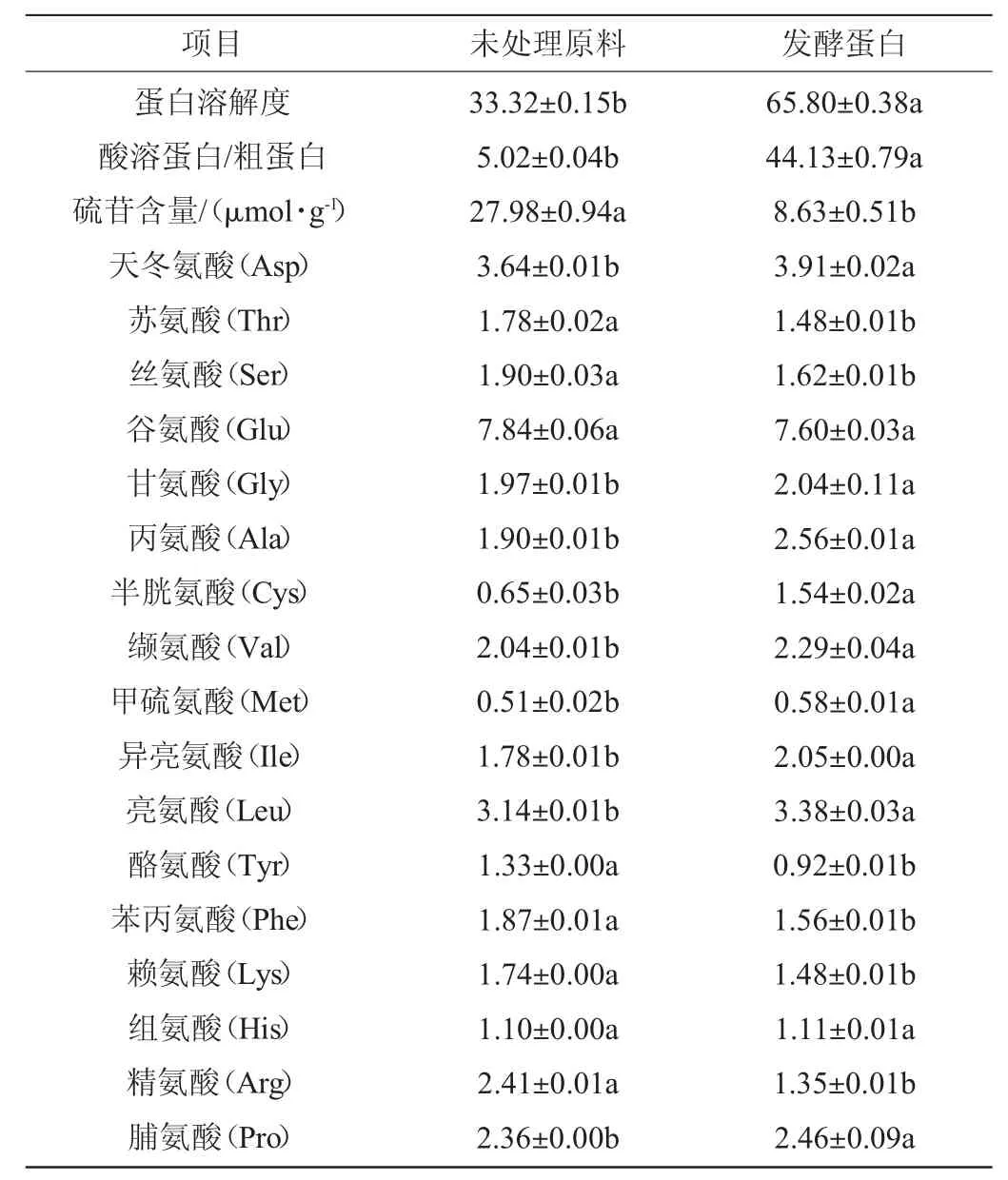
表4 未處理原料、發酵蛋白品質及氨基酸含量分析Table 4 Analysis of untreated raw material,fermented protein quality and amino acid content%
3 結論
本研究采用米曲霉固態發酵+酶解的模式對以菜籽粕為主要原料,豆粕為輔助原料的蛋白原料制作工藝參數進行優化,確定最佳發酵原料組成為70%菜籽粕+30%豆粕;固態發酵的最佳條件為發酵蛋白原料初始含水量45%,米曲霉麩皮種子接種量3%,發酵時間40 h,發酵溫度30 ℃;最佳酶解條件為酶解時間32 h,酶解樣品初始含水量56%,酶解溫度50 ℃。在此工藝條件下,發酵蛋白的蛋白溶解度提高97.49%,酸溶蛋白/粗蛋白提高779.75%,硫苷含量降低69.14%。發酵、酶解兩步工藝充分利用了微生物在發酵過程中產生的酶,無需使用外源酶制劑,生物資源的利用達到最大化。相比傳統固態發酵,固態發酵、酶解兩步法大幅縮短了處理時間,減少了對固態發酵條件的控制依賴,使得終產物得率不僅僅依賴于發酵過程,增大了固態發酵的應用范圍。

