乳腺癌診療指南(2022年版)
中華人民共和國國家衛生健康委員會
乳腺癌是女性常見的惡性腫瘤之一,發病率位居女性惡性腫瘤的首位,嚴重危害婦女的身心健康。目前,通過采用綜合治療手段,乳腺癌已成為療效最佳的實體腫瘤之一。
為進一步規范我國乳腺癌診療行為,提高醫療機構乳腺癌診療水平,改善乳腺癌患者預后,保障醫療質量和醫療安全,特制定本指南。
一、乳腺癌篩查
乳腺癌篩查是指通過有效、簡便、經濟的乳腺檢查措施,在無癥狀婦女中識別和發現具有進展潛能的癌前病變患者以及早期浸潤性癌患者,以期早期發現、早期診斷及早期治療,其最終目的是降低人群乳腺癌的死亡率。
篩查分為群體篩查和機會性篩查。群體篩查是指在轄區或機構有組織、有計劃地組織適齡婦女進行篩查;機會性篩查是指醫療保健機構結合門診常規工作提供乳腺癌篩查服務。
婦女參加乳腺癌篩查的起始年齡:機會性篩查一般建議40歲開始,但對于乳腺癌高危人群可將篩查起始年齡提前到40歲以前。群體篩查國內暫無推薦年齡,國際上推薦40~50歲開始,目前國內開展的群體篩查采用的年齡均屬于研究或探索性質,缺乏嚴格隨機對照研究的不同年齡成本效益分析數據。
(一)一般風險人群婦女乳腺癌篩查策略
1. 20~39歲
(1)每月1次乳腺自我檢查。
(2)每1~3年1次臨床檢查。
2. 40~69歲
(1)適合機會性篩查和群體性篩查。
(2)每1~2年1次乳腺X線檢查和/或乳腺超聲。
(3)對條件不具備的地區或致密型乳腺(腺體為C型或D型),可首選乳腺超聲檢查。
(4)每月1次乳腺自我檢查。
(5)每年1次臨床檢查。
3. 70歲以上
(1)機會性篩查(有癥狀或可疑體征時進行影像學檢查)。
(2)每月1次乳腺自我檢查。
(3)每年1次臨床檢查。
(二)高危人群乳腺癌篩查策略
建議對乳腺癌高危人群提前進行篩查(小于40歲),篩查間期推薦每年1次,篩查手段整體原則應聯合乳腺X線檢查和乳腺超聲,必要時還可以應用MRI等影像學手段。
乳腺癌高危人群符合以下3個條件,即:1.有明顯的乳腺癌遺傳傾向者(見下段基因檢測標準);2.既往有乳腺導管或小葉不典型增生或小葉原位癌(lobular carcinoma in situ,LCIS)的患者;3.既往行胸部放療。
遺傳性乳腺癌-卵巢癌綜合征基因檢測標準如下[a,b]。
(1)具有血緣關系的親屬中有BRCA1/BRCA2基因突變的攜帶者。
(2)符合以下1個或多個條件的乳腺癌患者[c]:①發病年齡≤45歲;②發病年齡≤50歲并且有1個及以上具有血緣關系的近親[d]也為發病年齡≤50歲的乳腺癌患者和/或1個及以上的近親為任何年齡的卵巢上皮癌/輸卵管癌/原發性腹膜癌患者;③單個個體患2個原發性乳腺癌[e],并且首次發病年齡≤50歲;④發病年齡不限,同時2個及以上具有血緣關系的近親患有任何發病年齡的乳腺癌和/或卵巢上皮癌、輸卵管癌、原發性腹膜癌;⑤具有血緣關系的男性近親患有乳腺癌;⑥合并有卵巢上皮癌、輸卵管癌、原發性腹膜癌的既往史。
(3)卵巢上皮癌、輸卵管癌、原發性腹膜癌患者。
(4)男性乳腺癌患者。
(5)具有以下家族史:①具有血緣關系的一級或二級親屬中符合以上任何條件;②具有血緣關系的三級親屬中有2個及以上乳腺癌患者(至少1個發病年齡≤50歲)和/或卵巢上皮癌/輸卵管癌/原發性腹膜癌患者。
注:a.符合1個或多個條件提示可能為遺傳性乳腺癌-卵巢癌綜合征,有必要進行專業性評估。當審查患者的家族史時,父系和母系親屬的患癌情況應該分開考慮。早發性乳腺癌和/或任何年齡的卵巢上皮癌、輸卵管癌、原發性腹膜癌提示可能為遺傳性乳腺癌-卵巢癌綜合征。在一些遺傳性乳腺癌-卵巢癌綜合征的家系中,還包括前列腺癌、胰腺癌、胃癌和黑素瘤。b.其他考慮因素:家族史有限的個體,例如女性一級或二級親屬<2個,或者女性親屬的年齡>45歲,在這種情況下攜帶突變的可能性往往會被低估。對發病年齡≤40歲的三陰性乳腺癌患者可考慮進行BRCA1/2基因突變的檢測。c.乳腺癌包括浸潤性癌和導管內癌。d.近親是指一級、二級和三級親屬。e. 2個原發性乳腺癌包括雙側乳腺癌或者同側乳腺的2個或多個明確的不同來源的原發性乳腺癌。
二、診斷
應當結合患者的臨床表現、體格檢查、影像學檢查、組織病理學等進行乳腺癌的診斷和鑒別診斷。
(一)臨床表現
早期乳腺癌不具備典型癥狀和體征,不易引起患者重視,常通過體檢或乳腺癌篩查發現。以下為乳腺癌的典型體征,多在癌癥中期和晚期出現。
1.乳腺腫塊
80%的乳腺癌患者以乳腺腫塊首診。患者常無意中發現腫塊,多為單發,質硬,邊緣不規則,表面欠光滑。大多數乳腺癌為無痛性腫塊,僅少數伴有不同程度的隱痛或刺痛。
2.乳頭溢液
非妊娠期從乳頭流出血液、漿液、乳汁、膿液,或停止哺乳半年以上仍有乳汁流出者,稱為乳頭溢液。引起乳頭溢液的原因很多,常見的疾病有導管內乳頭狀瘤、乳腺增生、乳腺導管擴張癥和乳腺癌。單側單孔的血性溢液應進一步行乳管鏡檢查,若伴有乳腺腫塊更應重視。
3.皮膚改變
乳腺癌引起皮膚改變可出現多種體征,最常見的是腫瘤侵犯乳房懸韌帶(又稱庫珀韌帶)后與皮膚粘連,出現酒窩征。若癌細胞阻塞了真皮淋巴管,則會出現橘皮樣改變。乳腺癌晚期,癌細胞沿淋巴管、腺管或纖維組織浸潤到皮內并生長,形成皮膚衛星結節。
4.乳頭、乳暈異常
腫瘤位于或接近乳頭深部,可引起乳頭回縮。腫瘤距乳頭較遠,乳腺內的大導管受到侵犯而短縮時,也可引起乳頭回縮或抬高。乳頭乳暈濕疹樣癌即佩吉特病,表現為乳頭皮膚瘙癢、糜爛、破潰、結痂、脫屑、伴灼痛,甚至乳頭回縮。
5.腋窩淋巴結腫大
隱匿性乳腺癌乳腺體檢摸不到腫塊,常以腋窩淋巴結腫大為首發癥狀。醫院收治的乳腺癌患者1/3以上有腋窩淋巴結轉移。初期可出現同側腋窩淋巴結腫大,腫大的淋巴結質硬、散在、可推動。隨著病情發展,淋巴結逐漸融合,并與皮膚和周圍組織粘連、固定。晚期可在鎖骨上和對側腋窩摸到轉移的淋巴結。
(二)乳腺觸診
進行乳腺觸診前應詳細詢問乳腺病史、月經婚姻史、既往腫瘤家族史(乳腺癌、卵巢癌)。絕經前婦女最好在月經結束后進行乳腺觸診。
受檢者通常采用坐位或立位,對下垂型乳房或乳房較大者,亦可結合仰臥位。乳腺體檢應遵循先視診后觸診,先健側后患側的原則,觸診時應采用手指指腹側,按一定順序,不遺漏乳頭、乳暈區及腋窩部位,可雙手結合。
大多數乳腺癌觸診時可以觸到腫塊,此類乳腺癌容易診斷。部分早期乳腺癌觸診陰性,查體時應重視乳腺局部腺體增厚變硬、乳頭糜爛、乳頭溢液,以及乳頭輕度回縮、乳房皮膚輕度凹陷、乳暈輕度水腫、絕經后出現乳房疼痛等,應提高警惕。診斷時要結合影像學和組織病理學檢查結果,必要時可活檢行細胞學診斷。
(三)影像學檢查
乳腺的影像學檢查主要包括乳腺X線檢查、乳腺超聲以及乳腺MRI等。
1.乳腺X線攝影
乳腺疾病的最基本檢查方法,在檢出鈣化方面,具有其他影像學方法無可替代的優勢,但對致密型乳腺、近胸壁腫塊的顯示不佳,且有放射性損害,對年輕女性患者不作為首選檢查方法。
常規投照體位包括雙側內外側斜位及頭尾位。對常規體位顯示不佳或未包全乳腺實質者,可根據病灶位置選擇補充體位,包括外內側位、內外側位、內側頭足軸位、外側頭足軸位、尾葉位、乳溝位。為使病灶顯示效果更佳,必要時可開展一些特殊攝影技術,如局部加壓攝影、放大攝影或局部加壓放大攝影等。
(1)適應癥:適用于篩查性人群及診斷性患者的乳腺檢查。①無癥狀人群的篩查。②適齡女性篩查或其他相關檢查發現乳腺異常改變。③有乳腺腫塊、局部增厚、異常乳頭溢液、乳腺皮膚異常、局部疼痛或腫脹癥狀。④良性病變的短期隨診。⑤乳腺癌保乳術后的隨診。⑥乳房修復重建術后。⑦引導定位及活檢。
對40歲以下、無明確乳腺癌高危因素或臨床查體未見異常的婦女,不建議首先進行乳腺X線檢查。妊娠期女性通常不進行乳腺X線攝影。
(2)診斷報告基本指南:見附件1。
2.乳腺超聲
超聲檢查因其簡便易行、靈活直觀、無創無輻射等特點,適用于所有疑診乳腺病變的人群。可同時進行乳腺和腋窩淋巴結的檢查。乳腺超聲掃描體位常規取仰臥位,掃描范圍自腋窩頂部至雙乳下界,包括全乳及腋窩。
常規超聲檢查可以早期、敏感地檢出乳腺內可疑病變,通過對病變形態、內部結構及周圍組織改變等特征的觀察,結合彩色多普勒血流成像觀察病變內血流情況,確定病變性質。超聲造影可以顯示病灶內微血管分布、走形、血流動力學差異以及病灶與周圍正常組織的關系,對于良惡性病灶的鑒別具有一定的意義。彈性成像可以評價組織硬度,對于部分乳腺病變的良惡性判斷有一定的輔助價值。
(1)適應癥:①有乳腺相關癥狀者:觸診發現乳腺腫物、乳頭溢液、乳頭內陷、局部皮膚改變等。②無癥狀的乳腺癌高危人群乳腺檢查。③作為乳腺X線篩查的補充檢查。④乳腺良性病變的隨訪;乳腺癌術后隨訪;絕經后激素替代治療隨訪等。⑤介入性超聲:超聲引導細針/空芯針穿刺活檢及術前定位等。
(2)診斷報告基本指南:見附件1。
3.乳腺MRI檢查
乳腺MRI檢查的優勢在于敏感性高,能顯示多病灶、多中心或雙側乳腺癌病灶,并能同時顯示腫瘤與胸壁的關系、腋窩淋巴結轉移情況等,為制訂手術方案提供更可靠的依據。缺點在于特異性中等、假陽性率高、對微小鈣化性病變顯示不滿意,此外檢查時間長、費用昂貴。不作為首選檢查方法。建議使用高場強(1.5T及以上)MRI設備及乳腺專用相控陣線圈,掃描體位為俯臥位,掃描序列包括T1加權成像序列(包括不抑脂序列,以及與增強序列相同的抑脂序列)、T2加權成像(加抑脂序列)、彌散加權成像、增強掃描序列(包括橫斷位動態增強掃描及矢狀位掃描)。
(1)適應癥:①乳腺X線攝影和超聲對病變檢出或確診困難者。②乳腺癌術前分期及篩查對側乳腺腫瘤。③評價新輔助化療療效。④尋找腋窩淋巴結轉移患者的原發灶。⑤乳腺癌術后鑒別治療后瘢痕與腫瘤復發。⑥評估腫塊切除術后切緣陽性患者的殘留病灶。⑦乳腺假體植入術后評價。⑧高危人群的乳腺癌篩查。⑨引導乳腺病灶的定位及活檢。
(2)禁忌癥:①體內有起搏器、外科金屬夾等鐵磁性物質及其他不得接近強磁場者。②具有對任何釓螯合物過敏史者。③幽閉恐懼癥者。④妊娠期婦女。⑤一般情況很差,不能耐受磁共振檢查者。
(3)診斷報告基本指南:見附件1。
4.正電子發射計算機體層成像
根據美國國立綜合癌癥網絡(National Comprehensive Cancer Network,NCCN)指南、歐洲腫瘤內科學會(European Society for Medical Oncology,ESMO)指南、日本乳腺癌學會(Japanese Breast Cancer Society,JBCS)指南及中國抗癌協會指南。
(1)正電子發射計算機體層成像(positron emission tomography-computed tomography,PET-CT)檢查適應癥:①臨床局部晚期、分子分型預后差、有癥狀可疑存在遠處轉移的患者療前分期(尤其是常規影像檢查對是否存在遠處轉移難以判斷或存在爭議時)。②術后患者隨訪過程中可疑出現局部復發或轉移,包括查體或常規影像檢查出現異常、腫瘤標志物升高等(對于鑒別復發和放射性纖維化,PET-CT較其他常規影像檢查具有優勢)。關于PET-CT在乳腺癌骨轉移方面的應用,雖有臨床研究提示,其具有與骨顯像相似的靈敏度,更高的特異性,對乳腺癌骨轉移治療后病情的跟蹤優于骨顯像,但目前尚未獲得各個指南的常規推薦。
(2)PET-CT檢查的相對禁忌癥:①妊娠和哺乳期婦女。②嚴重心、肝、腎功能衰竭及對含碘對比劑過敏者不能行增強PET-CT檢查。③病情危重難以配合、不能平臥15分鐘、尿便失禁或有幽閉恐懼癥的患者。④顱腦轉移顱內壓增高患者。
5.骨顯像
(1)浸潤性乳腺癌治療前分期:①對于臨床Ⅰ~ⅡB期浸潤性乳腺癌患者,有局部骨痛或堿性磷酸酶升高時,可行骨顯像檢查評估是否有骨轉移。②臨床Ⅲ期浸潤性乳腺癌患者,可行骨顯像檢查或氟化鈉PET-CT檢查,評估是否有骨轉移(2B類)。③復發或臨床Ⅳ期乳腺癌患者,可行骨顯像檢查或氟化鈉PET-CT檢查,評估是否有骨轉移。
若患者已行的氟代脫氧葡萄糖PET-CT檢查中明確提示有骨骼轉移,且PET及CT的部分均提示有骨骼轉移,那么骨顯像或氟化鈉PET-CT檢查可能不再需要。
(2)隨訪:若患者出現骨痛或堿性磷酸酶升高時,可行骨顯像檢查評估是否有骨轉移;當缺乏臨床信號和癥狀提示復發時,不建議影像學的轉移篩查。
(四)實驗室檢查
1.生化檢查
早期無特異性血生化改變,晚期累及其他臟器時,可出現相應的生化指標的變化。如多發骨轉移時,可出現堿性磷酸酶升高。
2.腫瘤標志物檢測
CA15-3、癌胚抗原是乳腺癌中應用價值較高的腫瘤標志物,主要用于轉移性乳腺癌患者的病程監測。CA15-3和癌胚抗原聯合應用可顯著提高檢測腫瘤復發和轉移的敏感性。由于其對局部病變的敏感性低,且在某些良性疾病和其他器官的惡性腫瘤中也可升高,因此不適合用于乳腺癌的篩查和診斷。
三、組織病理學診斷
病理學診斷是乳腺癌確診和治療的依據。規范化的乳腺癌病理診斷報告不僅需要提供準確的病理診斷,還需要提供正確、可靠的與乳腺癌治療方案選擇、療效預測和預后判斷相關的標志物檢測結果。進行病理學診斷時,臨床醫師需提供完整、確切的臨床情況,以及合格、足量、完整的組織標本。
(一)標本類型及固定
1.標本類型
乳腺標本類型主要包括空芯針穿刺活檢標本、真空輔助活檢標本和各種手術切除標本(乳腺微創旋切術、乳腺腫塊局部切除術、乳腺病變保乳切除術、乳腺單純切除術乳腺改良根治術標本、以及乳腺癌新輔助化療后的改良根治標本)。
2.標本固定
穿刺或切除后的乳腺組織應立即固定(不得超過1小時為宜)。應選擇足夠的磷酸緩沖液配制的4%中性甲醛固定液。活檢標本固定時間6~48小時為宜。對于切除標本,應將其每隔5~10mm切開,宜用紗布或濾紙將相鄰的組織片分隔開,以保障固定液的充分滲透和固定。固定時間12~72小時為宜。
(二)取材及大體描述指南
接受標本后,首先必須核對標本袋信息及病理檢查申請單的信息(包括姓名、性別、年齡、床位號、住院號、標本類型及部位、臨床診斷、送檢者等)。
1.空芯針穿刺活檢標本
(1)大體檢查及記錄:標明穿刺組織的數目、每塊組織的大小,包括直徑和長度。
(2)取材:送檢組織全部取材。空芯針穿刺活檢標本不宜行術中病理診斷。
2.真空輔助(乳腺微創旋切)活檢標本
(1)大體檢查及記錄:標明活檢組織的總大小。
(2)取材:送檢組織全部取材。如臨床送檢組織標記鈣化及鈣化旁,需記錄注明,并將其分別置于不同的包埋盒中。真空輔助活檢標本不宜行術中病理診斷。
3.乳腺腫塊切除標本
(1)大體檢查及記錄:按外科醫師的標示確定送檢標本的部位。若未標記,應聯系外科醫師明確切除標本所在的位置。測量標本3個徑線的大小;若帶皮膚,應測量皮膚的大小。測量腫瘤或可疑病變3個徑線的大小。記錄腫瘤或可疑病變的部位和外觀。記錄每塊組織所對應的切片總數及編號。
(2)取材:術中冰凍取材:沿標本長軸每隔5mm做1個切面,如有明確腫塊,在腫塊處取材。如為鈣化灶,宜對照X線攝片對可疑病變取材或按標記探針位置取材。如無明確腫塊,對可疑病變處取材。
常規標本取材:若腫塊或可疑病變最大徑≤5cm,應至少每1cm取材1塊,必要時[如導管原位癌(ductal carcinoma in situ,DCIS)]宜將病變全部取材后送檢。若腫塊或可疑病變最大徑大于5cm,應每1cm至少取材1塊,如6cm的腫塊至少取材6塊;如已診斷為DCIS,建議將病灶全部取材。乳腺實質的其他異常和皮膚均需取材。
4.乳腺病變保乳切除標本
(1)大體檢查及記錄。冰凍另送切緣者需對切緣檢查及記錄。
ⅰ按外科醫師的標示確定送檢標本的部位。若未標記,應聯系外科醫師明確切除標本所在的位置。
ⅱ測量標本3個徑線的大小,若附帶皮膚,則測量皮膚的大小。
ⅲ根據臨床標記,正確放置標本,建議將標本各切緣(表面切緣、基底切緣、上切緣、下切緣、內切緣、外切緣)涂上不同顏色的染料。待色標略干后,吸干多余的染料。
ⅳ按從表面到基底的方向,沿標本長軸每隔3~5mm做1個切面,將標本平行切分為若干塊組織,并保持各塊組織的正確方向和順序。
ⅴ仔細查找病灶,并測量腫瘤3個徑線的大小;若為化療后標本,則測量瘤床大小;若為局切后標本,則描述殘腔大小及有無殘留病灶。
ⅵ測量腫瘤、瘤床或殘腔距各切緣的距離,觀察最近切緣。
ⅶ記錄每塊組織所對應的切片編號及對應取材內容。
(2)取材。
ⅰ切緣取材:冰凍另送切緣者除外切緣取材。
保乳標本切緣取材主要有2種方法:垂直切緣放射狀取材和切緣離斷取材。2種切緣取材方法各有優缺點。無論采取何種取材方法,建議在取材前將六處標本切緣涂上不同顏色的染料,以便在鏡下觀察時能根據不同顏色對切緣作出準確的定位,并正確測量腫瘤和切緣的距離。保乳標本病理報告中需明確切緣狀態(陽性或陰性)。“陽性切緣”是指墨染切緣處有DCIS或浸潤性癌侵犯。“陰性切緣”的定義并不一致,但多數指南或共識中將“墨染切緣處無腫瘤”定義為“陰性切緣”。對于切緣陰性者,建議報告切緣與腫瘤的最近距離,應盡量用客觀的定量描述,而不建議用主觀描述(如距切緣近等)。
垂直切緣放射狀取材:根據手術醫師對保乳標本做出的方位標記,垂直于基底將標本平行切成多個薄片(建議間隔5mm),觀察每個切面的情況。描述腫瘤大小、所在位置及腫瘤距各切緣的距離,取材時將大體離腫瘤較近處的切緣與腫瘤一起全部取材,大體離腫瘤較遠處的切緣抽樣取材,鏡下觀察時準確測量切緣與腫瘤的距離。垂直切緣放射狀取材的優點是能正確測量病變與切緣的距離,缺點是工作量較大,且對大體離腫瘤較遠的切緣只能抽樣取材。
切緣離斷取材:將六處切緣組織離斷,離斷的切緣組織充分取材,鏡下觀察切緣的累犯情況。切緣離斷取材的優點是取材量相對較少,能通過較少的切片對所有的切緣情況進行鏡下觀察,缺點是不能準確測量病變與各切緣的距離。
ⅱ腫瘤及周圍組織取材:①若腫塊或可疑病變最大徑≤5cm,應沿腫瘤或可疑病變的最大切面至少每1cm取材1塊,必要時(如DCIS)宜全部取材后送檢。若腫塊或可疑病變最大徑大于5cm,則每1cm至少取材1塊;如已診斷為DCIS,建議將病灶全部取材。若為新輔助化療后標本,則參照乳腺癌新輔助治療后病理診斷規范(2020版)進行取材。若為手術殘腔:送檢代表性的切面,包括可疑的殘留病灶。②乳腺實質的其他異常。③皮膚。
ⅲ補充切緣取材:若首次切除時為陽性切緣,需再次送檢切緣。補充切緣亦可作為單獨的標本同切除組織一同送檢。若外科醫師已對補充切緣中真正的切緣做了標記,可用染料對真正切緣處進行涂色,并垂直于標記處切緣將標本連續切開并送檢。如果標本較小,所有組織應全部送檢。
5.乳腺切除術(包括單純切除術和改良根治術)
(1)大體檢查及記錄:①按正確的方向擺放標本以便識別腫瘤所在的象限:改良根治術標本可通過識別腋窩組織來正確定位(腋窩組織朝向外上方)。單純切除術標本,需根據外科醫師的標記來定位,若未標記方向,則與外科醫師聯系以確定標本的正確方向。建議標本的基底切緣涂上染料以便鏡下觀察切緣情況。②測量整個標本及附帶皮膚、腋窩組織的大小。描述皮膚的外觀,如有無手術切口、穿刺點、瘢痕、紅斑或水腫等。③從基底部水平切開乳頭,取乳頭水平切面組織一塊以觀察輸乳管的橫斷面,而后垂直于乳腺表面切開乳頭其他組織。描述乳頭、乳暈的外觀,如有無破潰及濕疹樣改變等。④垂直于基底將標本切成連續的薄片。⑤仔細查找病灶,記錄病灶所在象限位置,描述腫瘤(質地、顏色、邊界、與皮膚及深部結構的關系)的特征。若有明確腫塊,則測量腫瘤3個徑線的大小;若為化療后標本,則測量瘤床大小;若為局切后標本,則描述手術殘腔大小及有無殘留病灶。測量腫瘤、殘腔、瘤床距最近表面切緣及基底切緣的距離。⑥描述非腫瘤乳腺組織的情況。⑦將腋窩脂肪組織同標本離斷后,仔細尋找淋巴結,對規范的腋窩清掃標本宜至少找及15枚淋巴結。描述淋巴結的總數目及最大徑范圍、有無融合、有無與周圍組織粘連。注意需附帶淋巴結周圍的結締組織。
(2)取材。
ⅰ原發腫瘤和手術殘腔的取材:若為腫瘤:送檢腫瘤的最大切面;若腫塊或可疑病變最大徑≤5cm,應至少每1cm取材1塊,必要時(如DCIS)宜全部取材后送檢。若標本腫塊或可疑病變最大徑>5cm,則每1cm至少取材1塊,如已診斷為DCIS,應將病灶全部取材。
若為化療后瘤床:參照乳腺癌新輔助治療后病理診斷規范(2020年版)取材。
若為手術殘腔:送檢代表性的切面,包括可疑的殘留病灶。
ⅱ其余組織的異常病灶:乳頭:距腫瘤最近處表面被覆皮膚;距腫瘤最近處基底切緣,盡可能取切緣的垂直切面;周圍象限乳腺組織每個象限代表性取材1塊。
腋窩淋巴結:若淋巴結肉眼觀察為陰性,則送檢整個淋巴結行組織學檢查;若淋巴結肉眼陽性,則沿淋巴結最大徑剖開后取組織送檢,注意需附帶淋巴結周圍的結締組織,以識別淋巴結被膜外的腫瘤轉移灶。
6.前哨淋巴結活檢
乳腺癌前哨淋巴結活檢(Sentinel lymph node biopsy,SLNB)已逐漸取代傳統的腋窩淋巴結清掃來評估早期乳腺癌患者的區域淋巴結情況,SLNB陰性者可避免腋窩淋巴結清掃。
(1)前哨淋巴結轉移灶的定義。
ⅰ孤立腫瘤細胞(isolated tumor cells,ITC):淋巴結中的腫瘤病灶直徑≤0.2mm:淋巴結中,或單張切片上的腫瘤細胞<200個。AJCC定義其為pN0(i+)。目前大部分臨床乳腺癌診療指南認為ITC無臨床意義,推薦按腋窩淋巴結陰性處理。
ⅱ微轉移:腫瘤轉移灶最大徑>0.2mm,但不超過2mm。AJCC定義其為pN1mi。ITC與微轉移有著本質的不同,前者為pN0,后者為pN1,兩者的鑒別非常重要。本標準中推薦將前哨淋巴結間隔2mm切成若干片組織,主要目的是為了最大程度檢測出微轉移病灶。
ⅲ宏轉移:腫瘤轉移灶最大徑>2mm。
(2)術中病理評估:前哨淋巴結中術中病理評估的主要目的是檢測出淋巴結中的轉移病灶,從而進行腋窩淋巴結清掃,以避免二次手術。但目前對前哨淋巴結術中病理評估是否必要存在爭議。術中病理評估的方法主要包括術中細胞印片和術中冷凍切片。
ⅰ術中細胞印片:將淋巴結每間隔2mm切成若干片組織,仔細檢查每片組織上是否存在肉眼可見的轉移灶,對每個切面行細胞印片。推薦巴氏染色和HE染色。術中細胞印片的優點是可保全整個淋巴結組織,對組織無損耗,可對淋巴結的不同切面取材,價廉,所需時間短,制作流程簡單;缺點是在印片的高細胞背景下辨認出分散的癌細胞(如小葉癌)有一定難度。術中細胞印片有很好的診斷特異性,但其診斷敏感性受多種因素的影響。
ⅱ術中冷凍切片:將淋巴結每間隔2mm切成若干片組織,仔細檢查每片組織上是否存在肉眼可見的轉移灶,每片組織制成冷凍切片行病理評估。術中冷凍切片的優點是診斷特異性好,能夠避免因假陽性而造成不必要的腋窩淋巴結清掃;缺點是組織損耗,用時長,費用較高,且難以評估脂肪化的淋巴結等。
(3)術后常規石蠟病理評估:術后石蠟切片是前哨淋巴結診斷的金標準,可明顯減少微小轉移的漏診。但是關于如何切分淋巴結、是否需要連續切片、切多少張連續切片、連續切片之間間隔多少尚無統一意見。推薦石蠟切片方案:①將淋巴結每間隔2mm切成若干片組織;②每片組織均包埋成石蠟組織塊;③每個蠟塊至少切一張切片;有條件的單位推薦連續切片,間隔150~200μm,切6個切面。
(三)病理診斷分類、分級和分期方案
1.組織學分型
參見附件2,組織學分型主要依據2012和2019版WHO乳腺腫瘤分類,某些組織學類型的準確區分需行免疫組化后確定。
對乳腺浸潤性癌進行準確的組織學分型對患者的個體化治療具有非常重要的臨床意義。在NCCN乳腺癌臨床實踐指南有關乳腺浸潤性癌的術后輔助治療方案中,針對小管癌、黏液癌這兩類預后較好的乳腺癌,制定了與其他類型的浸潤性癌不同的內分泌治療及放化療方案,因此要嚴格掌握這些特殊類型乳腺癌的診斷標準。對于炎性乳腺癌這類預后較差的乳腺癌,NCCN乳腺癌臨床實踐指南也制定了有別于其他浸潤性癌的手術及術前術后輔助治療方案。過去認為髓樣癌預后較好,但目前的研究表明其轉移風險與其他高度惡性的浸潤性癌相當,其診斷重復性在不同觀察者之間的差異也很明顯。因此NCCN指南建議,對伴有髓樣特征的浸潤性癌患者應根據其臨床和病理分期接受與浸潤性導管癌(invasive ductal carcinoma,IDC)一樣的治療。某些特殊類型的乳腺癌具有較特殊的臨床特征,如浸潤性微乳頭狀癌較易出現淋巴結轉移,即使出現較少比例的浸潤性微乳頭狀癌,也應在病理報告中注明百分比。對于混合性癌,建議報告不同腫瘤類型所占的比例,并分別報告2種或以上成分的腫瘤分子生物標記的表達情況。
2.組織學分級
(1)浸潤性乳腺癌(參見附件3):組織學分級是重要的預后因素,多項研究顯示在浸潤性乳腺癌中,組織學分級與預后明確相關。目前應用最廣泛的浸潤性癌病理分級系統是改良的Scarff-Bloom-Richardson(Nottingham)組織計分系統,根據腺管形成的比例、細胞的異型性和核分裂象計數三項重要指標,每項指標分別獨立評估,各給予1~3分,相加后根據總分將浸潤性癌劃分為1、2、3共三個級別。
腺管分化程度的評估針對整個腫瘤,需要在低倍鏡下評估。只計數有明確中央腺腔且由有極向腫瘤細胞包繞的結構,以腺管/腫瘤區域的百分比表示。
細胞核多形性的評估要選取多形性最顯著的區域。該項評估參考周圍正常乳腺上皮細胞的核大小、形狀和核仁大小。當周邊缺乏正常細胞時,可用淋巴細胞作為參照。當細胞核與周圍正常上皮細胞的大小和形狀相似、染色質均勻分布時,視為1分;當細胞核比正常細胞大,形狀和大小有中等程度差異,可見單個核仁時,視為2分;當細胞核的大小有顯著差異,核仁顯著,可見多個核仁時應視為3分。
只計數明確的核分裂象,不計數核濃染和核碎屑。核分裂象計數區域必須要根據顯微鏡高倍視野的直徑進行校正。核分裂象計數要選取增殖最活躍的區域,一般常見于腫瘤邊緣,如果存在腫瘤中的異質性,要選擇核分裂象多的區域。
(2)乳腺DCIS的分級:對于DCIS,病理報告中應該包括分級,并建議報告是否存在壞死,組織學結構、病變大小或范圍、切緣狀況。目前乳腺原位癌的分級主要是細胞核分級,診斷標準如下。
低核級DCIS:由小而一致的癌細胞組成,呈僵直搭橋狀、微乳頭狀、篩狀或實體狀結構。細胞核大小一致,染色質均勻,核仁不明顯,核分裂象少見。
中核級DCIS:形態介于低級別和高級別DCIS之間,細胞的大小、形狀、極性有輕-中等差異。染色質粗細不等,可見核仁,核分裂象可見,可出現點狀壞死或粉刺樣壞死。
高核級DCIS:由高度不典型的細胞組成,形成微乳頭狀、篩狀或實體狀。細胞核多形性明顯,缺乏極性排列,染色質粗凝塊狀,核仁明顯,核分裂象較多。管腔內常出現伴有大量壞死碎屑的粉刺樣壞死。但腔內壞死不是診斷高級別DCIS的必要條件,有時導管壁襯覆單層細胞,但細胞高度異型,也可以診斷為高級別DCIS。
3.乳腺癌的分期方案
參見附件4。腫瘤分期包括了腫瘤的大小、累及范圍(皮膚和胸壁受累情況)、淋巴結轉移和遠處轉移情況。正確的腫瘤分期是指導患者個體化治療決策的基礎。乳腺癌患者要進行臨床分期和病理分期。
第8版AJCC乳腺癌分期對腫瘤大小的測量做出了詳盡的規定。腫瘤大小的測量有多種方法,包括臨床觸診、影像學評估、病理大體測量和顯微鏡下測量。乳腺癌分期中涉及的腫瘤大小是指浸潤性癌的大小。由于體檢、影像學及大體檢查均無法區分浸潤性癌和導管內癌,因此顯微鏡下測量應該是最準確的測量方式。如果浸潤性癌范圍較大,無法用1個蠟塊全部包埋,則以巨檢時的腫瘤大小為準。若浸潤性癌病灶局限,可以用1個蠟塊全部包埋,則腫瘤大小以顯微鏡下測量的大小為準。(1)如果腫瘤組織中有浸潤性癌和原位癌2種成分,腫瘤的大小應該以浸潤性成分的測量值為準,可注明原位癌的范圍和比例等。(2)原位癌伴微浸潤:出現微浸潤時,應在報告中注明,并測量微浸潤灶最大徑;如為多灶微浸潤,浸潤灶大小不能累加,需在報告中注明多灶微浸潤,并測量最大浸潤灶的大小。(3)對于肉眼能確定的發生于同一象限的2個以上多個腫瘤病灶,應在病理報告中注明為多灶性腫瘤,并分別測量大小。(4)對于肉眼能確定的發生于不同象限的2個以上多個腫瘤病灶,應在病理報告中注明為多中心性腫瘤,并分別測量大小。(5)如果腫瘤組織完全由DCIS組成,應盡量測量其范圍。淋巴結狀態是決定乳腺癌患者治療和預后的重要因素,對于淋巴結轉移數位于分期臨界值(如1、3和10個轉移)附近時,要特別仔細觀察淋巴結的轉移數目,從而做出準確的pN分期。
新輔助治療后標本的分期需結合臨床檢查、影像學檢查和病理檢查信息,根據手術切除標本的情況對治療后的yT和yN進行判定。
4.免疫組化和腫瘤分子病理檢測及其質量控制
應對所有乳腺浸潤性癌病例進行雌激素受體(estrogen receptor,ER)、孕激素受體(progesterone receptor,PR)、HER2免疫組化染色,HER2(2+)病例應進一步行原位雜交檢測。評估ER、PR狀態的意義在于確認內分泌治療獲益的患者群體以及預測預后,ER和/或PR陽性患者可采用他莫昔芬和芳香化酶抑制劑等內分泌治療。ER、PR的規范化病理報告需要報告陽性細胞強度和百分比。ER及PR陽性定義:≥1%的陽性染色腫瘤細胞。評估HER2狀態的意義在于確認適合HER2靶向治療的患者群體以及預測預后。HER2陽性定義:經免疫組織化學檢測,超過10%的細胞出現完整胞膜強著色(3+)和/或原位雜交檢測到HER2基因擴增(單拷貝HER2基因 >6或HER2/CEP17比值>2.0)。ER、PR檢測參考《中國乳腺癌ER、PR檢測指南》(參見附件5)。HER2檢測參考《中國乳腺癌HER2檢測指南》(參見附件6)。
Ki-67增殖指數在乳腺癌治療方案選擇和預后評估上起著越來越重要的作用,應對所有乳腺浸潤性癌病例進行Ki-67檢測,并對癌細胞中陽性染色細胞所占的百分比進行報告。對于Ki-67計數,目前尚缺乏相關共識。建議在低倍鏡下評估整張切片,觀察陽性細胞分布是否均勻:
若腫瘤細胞中陽性細胞分布較均勻,可隨機選取3個或以上浸潤性癌高倍視野計數,得出一個平均的Ki-67增殖指數。
若腫瘤細胞中陽性細胞分布不均勻,出現明顯的Ki-67增殖指數高表達區域(熱點區)。主要有2種情況:①在腫瘤組織邊緣與正常組織交界處出現熱點區,而腫瘤組織內Ki-67增殖指數相對較低,推薦選取腫瘤邊緣區域熱點區≥3個浸潤性癌高倍視野進行Ki-67增殖指數評估;②在腫瘤組織內出現熱點區,可對整張切片的Ki-67增殖指數進行平均評估,選取視野時應包括熱點區域在內的≥3個浸潤性癌高倍視野。當Ki-67增殖指數介于10%~30%的臨界值范圍時,建議盡量評估500個以上的浸潤性癌細胞,以提高結果的準確度。
開展乳腺癌免疫組化和分子病理檢測的實驗室應建立完整有效的內部質量控制,不具備檢測條件的單位應妥善地保存好標本,以供具有相關資質的病理實驗室進行檢測。
具有合格資質的病理實驗室應滿足以下條件:
(1)應建立完善的標準操作程序,并嚴格遵照執行,做好每次檢測情況的記錄和存檔工作。應開展同一組織不同批次染色結果的重復性分析。檢測相關的儀器和設備應定期維護、校驗。任何操作程序和試劑變化均應重新進行嚴格的驗證。
(2)從事乳腺癌免疫組化和分子病理檢測的實驗技術人員和病理醫師應定期進行必要的培訓、資格考核和能力評估。
(3)實驗室外部質控可通過參加有關外部質控活動來實現。外部質控的陽性和陰性符合率應達到90%以上。外部質控活動推薦每年參加1~2次。
5.病理報告內容及指南
乳腺浸潤性癌的病理報告(參見附件5)應包括與患者治療和預后相關的所有內容,如腫瘤大小、組織學類型、組織學分級、有無并存的DCIS、有無脈管侵犯、神經侵犯、乳頭、切緣和淋巴結情況等。還應包括ER、PR、HER2、Ki-67等指標的檢測情況。若為治療后乳腺癌標本,則應對治療后反應進行病理評估。DCIS的病理診斷報告應報告核級別(低、中或高級別)和有無壞死(粉刺或點狀壞死)、手術切緣情況以及ER和PR表達情況。對癌旁良性病變,宜明確報告病變名稱或類型。對保乳標本的評價宜包括大體檢查及顯微鏡觀察中腫瘤距切緣最近處的距離、若切緣陽性,應注明切緣處腫瘤的類型(原位癌或浸潤性癌)。淋巴管/血管侵犯需要與乳腺癌標本中經常出現的組織收縮引起的腔隙鑒別。相對而言,收縮腔隙在腫瘤組織內更常見,而在腫瘤主體周圍尋找脈管侵犯更可靠。
四、鑒別診斷
乳腺癌需與乳腺增生、纖維腺瘤、囊腫、導管內乳頭狀瘤、乳腺導管擴張癥(漿細胞性乳腺炎)、乳腺結核等良性疾病,與乳房惡性淋巴瘤、間葉源性肉瘤以及其他部位原發腫瘤轉移到乳腺的繼發性乳腺惡性腫瘤進行鑒別診斷。鑒別診斷時需要詳細地詢問病史和仔細地體格檢查,并結合影像學檢查(乳腺超聲、乳腺X線攝影及乳腺磁共振等),最后還需要細胞學和/或病理組織學檢查明確診斷。
臨床查體可觸及腫塊的乳腺癌約占80%,可以進行外科手術活檢行病理組織學診斷,在有條件的醫院可借助穿刺活檢盡快明確診斷。但臨床觸診陰性的乳腺癌增加了診斷的困難,需借助影像學定位進行病灶穿刺,或在乳腺X線技術引導下放置金屬定位線,再經外科切除活檢明確診斷。
少數乳腺癌患者伴有乳頭溢液,需與乳腺增生、導管擴張、乳汁潴留、導管內乳頭狀瘤及乳頭狀瘤病等鑒別。有條件的醫院可借助乳頭溢液細胞學涂片查找癌細胞,通過乳管內鏡檢查,了解乳管內有無占位性病變,需要時再經活檢明確診斷。
五、治療
(一)治療原則
乳腺癌應采用綜合治療的原則,根據腫瘤的生物學行為和患者的身體狀況,聯合運用多種治療手段,兼顧局部治療和全身治療,以期提高療效和改善患者的生活質量。
1.非浸潤性乳腺癌的治療
(1)LCIS:經典型LCIS中的小葉內終末導管或腺泡呈實性膨大,其中充滿均勻一致的腫瘤細胞。腫瘤細胞體積小而一致,黏附性差。細胞核呈圓形或卵圓形,染色質均勻,核仁不明顯。細胞質淡染或淡嗜酸性,可含黏液空泡致細胞核偏位呈印戒細胞樣,細胞質也可透亮。LCIS包括多種亞型:多形性型、旺熾型、透明型、肌樣細胞型等。其中較為重要的是多形性亞型。多形性LCIS中的腫瘤細胞黏附性差,細胞核顯著增大,有明顯的多形性,可有顯著的核仁和核分裂象,有時可見粉刺樣壞死或鈣化,需與高級別DCIS相鑒別。非典型性小葉增生(atypical lobular hyperplasia,ALH)和LCIS在形態學上具有相似之處,但累犯終末導管小葉單位(terminal ductal lobular unit,TDLU)的程度不同。當TDLU單位中≥50%的腺泡被診斷性細胞所充滿并擴張時可診斷為LCIS,小于50%時則診斷為ALH。根據AJCC(第8版),將LCIS當做乳腺良性病變,然而專家團認為仍需謹慎適用,推薦對非經典型LCIS需積極處理。
LCIS發展為浸潤性癌的風險相對較小,具有癌變間期長、雙側乳房和多個象限發病的特點。一些研究發現,在診斷為ALH和LCIS的婦女中,終生發生癌變的概率為5%~32%,平均癌變率為8%。LCIS癌變發生于雙側乳房的機會均等,而不僅局限于原發LCIS部位。多數觀點認為,LCIS是癌變的危險因素,有些研究則認為LCIS是癌前病變。有研究顯示,LCIS多數進展為浸潤性小葉癌,但是也可進展為IDC。這是一個值得重視的癌前病變,對其治療需要更有效而確切的方法。
LCIS可無任何臨床癥狀,亦可沒有乳房腫塊、乳頭溢液、乳頭腫脹及皮膚改變等體征,有時僅有類似增生樣改變。依據中國女性乳腺特點,應完善乳腺X線、乳腺超聲檢查,必要時可行乳腺MRI;擬行保乳手術患者,術前必須行乳腺X線檢查。在乳腺X線檢查發現有鈣化、腫塊、結構紊亂后,其通過穿刺活檢(包括空芯針穿刺以及真空輔助穿刺活檢)或開放活檢均可被診斷。如穿刺活檢提示為經典型LCIS患者,則可以進行常規的影像學隨訪而不行開放活檢。若穿刺活檢提示為多形性LCIS或穿刺結果與影像學檢查不符,需行開放活檢以除外DCIS及浸潤癌。LCIS亦有因其他乳房病變進行手術活檢時發現。典型的LCIS與低級別的DCIS很相似,可采用E-鈣黏蛋白及P120免疫組織化學染色來鑒別。
LCIS如果行廣泛切除后,絕經前可予他莫昔芬(三苯氧胺)治療5年;絕經后口服他莫昔芬或雷洛昔芬降低風險;若不能排除多形性LCIS可行全乳切除術,視情況進行乳房重建。
(2)DCIS:又稱導管內癌,為非浸潤性癌,多數發生于TDLU,也可發生于大導管,是局限于乳腺導管內的原位癌。典型的DCIS在乳腺X線檢查上多表現為不伴腫塊的簇狀微小鈣化灶,惡性鈣化還可表現為細小點樣、線狀、分支狀鈣化等。在實際工作中,多采用以核分級為基礎,兼顧壞死、核分裂象及組織結構的分級模式,將DCIS分為3級,即低級別、中級別和高級別。高級別DCIS往往由較大的多形性細胞構成,核仁明顯、核分裂象常見。管腔內常出現伴有大量壞死碎屑的粉刺樣壞死,但腔內壞死不是診斷高級別DCIS的必要條件。低級別DCIS由小的單形性細胞組成,細胞核圓形,大小一致,染色質均勻,核仁不明顯,核分裂象少見。腫瘤細胞排列成僵直搭橋狀、微乳頭狀、篩狀或實體狀。中級別DCIS結構表現多樣,細胞異型性介于高級別和低級別DCIS之間。
DCIS可能是IDC的前驅病變,DCIS不經治療最終可能會發展為IDC。對最初誤診為良性病變而導致未能獲得治療的DCIS研究顯示,從DCIS進展為IDC的比例為14%~53%。
依據中國女性乳腺特點,應完善乳腺X線檢查、乳腺超聲檢查,必要時可行乳腺MRI。擬行保乳手術的患者,術前必須行乳腺X線檢查診斷。至少有90%的DCIS是在乳腺X線檢查篩查中被發現,多數表現為微小鈣化灶,部分表現為微小鈣化灶伴腫塊影或致密影,約10%患者有可觸及的腫塊,約6%患者乳腺X線檢查表現為假陰性。DCIS的典型MRI表現為沿導管分布的導管樣或段樣成簇小環狀強化,也可表現為局灶性、區域性或彌漫性強化,孤立性或多發性腫塊。超聲下DCIS多表現為邊界不清的腫塊,內部呈低回聲,腫塊內多具有彌漫、成堆或簇狀分布的針尖樣、顆粒狀鈣化,腫塊內血流多較豐富。空芯針穿刺活檢及開放活檢都是獲取DCIS組織學診斷的手段,但穿刺活檢提示為DCIS患者,可選擇開放活檢以明確有無浸潤癌。在穿刺結果為DCIS患者中,25%有IDC成分;在穿刺結果為LCIS患者中,開放活檢后有17%~27%病理升級為DCIS或浸潤性癌。因此建議穿刺活檢后行開放活檢。DCIS的病理診斷,推薦完整取材、規范取材。
ⅰ局部擴大切除并全乳放射治療。
ⅱ全乳切除,視情況進行SLNB和乳房重建。
對于單純原位癌患者,在未獲得浸潤性乳腺癌證據或者未證實存在腫瘤轉移時,不建議行全腋窩淋巴結清掃。然而,仍有一小部分臨床診斷為單純原位癌的患者在進行手術時被發現為浸潤性癌,應按浸潤癌處理。單純LCIS的確診必須依據手術活檢結果。
ⅲ以下情形考慮采用他莫昔芬治療5年以降低保乳手術后同側乳腺癌復發風險:①接受保乳手術(腫塊切除術)加放療的患者,尤其是ER陽性的DCIS患者;ER陰性的DCIS患者他莫昔芬治療效果尚不確定。②對于接受全乳切除術的DCIS患者術后可通過口服他莫昔芬或雷洛昔芬來降低對側乳腺癌風險,但需權衡化學預防的臨床獲益與不良反應。
2.浸潤性乳腺癌的治療
(1)保乳手術加放射治療。
(2)乳腺癌全乳切除聯合腋窩淋巴結清掃手術(改良根治術),視情況進行乳房重建。
(3)全乳切除并SLNB,視情況進行乳房重建。
(4)老年人乳腺癌:局部擴大切除或全乳切除(根據手術及麻醉風險),受體陽性患者需進行內分泌治療,視情況做SLNB。
(二)手術治療
1.手術治療原則
乳腺癌手術范圍包括乳腺和腋窩淋巴結兩部分。乳腺手術有腫瘤擴大切除和全乳切除。腋窩淋巴結可行SLNB和腋窩淋巴結清掃,除原位癌外均需了解腋窩淋巴結狀況。選擇手術術式應綜合考慮腫瘤的臨床分期和患者的身體狀況。
2.乳腺手術
(1)乳房切除手術:適應癥為TNM分期中0、Ⅰ、Ⅱ期及部分Ⅲ期且無手術禁忌,患者不具備實施保乳手術條件或不同意接受保留乳房手術;局部進展期或伴有遠處轉移的患者,經全身治療后降期,亦可選擇全乳切除術。
Halsted傳統根治術中采用的乳房切除術需同時切除胸大小肌,創傷大,并發癥發生率高,目前已被改良根治術所取代。其切除范圍包括上至鎖骨下、下至腹直肌前鞘、內至胸骨旁、外至背闊肌的解剖邊界內,連同胸大肌筋膜完整切除乳腺組織及乳頭乳暈復合體,只有當胸肌受累時才需切除部分或全部胸肌。部分學者認為可保留胸大肌筋膜,尤其是需要進行術中即刻假體/擴張器重建時。
目前的乳房切除術已由改良根治術發展為保留皮膚的乳房切除+乳腺重建手術,兩者治療效果類似,但后者美容效果更好。此外,保留乳頭乳暈的乳房切除術在臨床上的應用也日趨廣泛,但還缺乏長期研究數據,需進一步完善患者選擇問題。
(2)保留乳房手術:嚴格掌握保乳手術適應癥。實施保乳手術的醫療單位應具備保乳手術切緣的組織學檢查設備與技術,保證切緣陰性;保乳術后放射治療的設備與技術。保留乳房手術后美容效果評價標準見附件7。
保乳手術適用于患者有保乳意愿,乳腺腫瘤可以完整切除,達到陰性切緣,并可獲得良好的美容效果、同時可接受術后輔助放療的患者。年輕不作為保乳手術的禁忌,≤35歲的患者有相對高的復發和再發乳腺癌的風險,在選擇保乳時,應向患者充分交代可能存在的風險。
保乳手術的絕對禁忌癥包括病變廣泛或彌漫分布的惡性特征鈣化灶,且難以達到切緣陰性或理想外形;T4期乳腺癌,包括侵犯皮膚、胸壁及炎性乳腺癌;腫瘤經局部廣泛切除后切緣陽性,再次切除后仍不能保證病理切緣陰性者;妊娠期乳腺癌,預估術后放療無法等到分娩后者;患者拒絕行保留乳房手術。相對禁忌癥包括腫瘤直徑大于3cm和累及皮膚的活動性結締組織病,尤其是硬皮病和紅斑狼瘡等。
3.腋窩淋巴結的外科手術
處理腋窩淋巴結是浸潤性乳腺癌標準手術中的一部分。其主要目的是為了了解腋窩淋巴結的狀況,以確定分期,選擇最佳治療方案。
(1)乳腺癌SLNB:SLNB具有創傷小且相關并發癥少等優點,是指對最早接受乳腺癌區域淋巴引流和發生腫瘤轉移的1個(或幾個)淋巴結進行切除活檢,以評估腋窩淋巴結狀態,NCCN乳腺癌臨床實踐指南推薦臨床腋窩淋巴結陰性的早期乳腺癌患者選擇SLNB作為腋窩淋巴結處理的優選手術方式。在SLNB手術前,需進行前哨淋巴結示蹤,目前SLNB常用的示蹤方法有染料法(專利藍、異硫藍、亞甲藍和納米炭)、核素法、染料聯合核素法及熒光示蹤法,運用最廣泛的示蹤方法為藍染法聯合核素法。SLNB技術能夠準確地進行乳腺癌腋窩淋巴結分期,對于臨床檢查腋窩淋巴結無明確轉移的患者,進行SLNB后,淋巴結陰性的患者可以免除腋窩淋巴結清掃,以減少上肢水腫等并發癥的發生;若SLNB陽性,可進行腋窩淋巴結清掃。
(2)腋窩淋巴結清掃:腋窩淋巴結清掃的指征包括:①臨床腋窩淋巴結陽性且經穿刺/手術活檢證實有轉移的患者;②前哨淋巴結陽性,且不符合ACOSOG Z0011入組標準的患者如T3、超過2枚前哨淋巴結陽性以及需全部乳腺切除者;③近期不充分的腋窩淋巴結清掃;④前哨淋巴結驗證試驗;⑤SLNB失敗;⑥SLNB發現臨床可疑的淋巴結;⑦T4;⑧不能施行SLNB;⑨SLNB后腋窩復發。
通常情況下,腋窩淋巴結清掃范圍應包括背闊肌前緣至胸小肌外側緣(Level Ⅰ)、胸小肌外側緣至胸小肌內側緣(Level Ⅱ)的所有淋巴結。清掃腋窩淋巴結要求在10個以上,以保證能真實地反映腋窩淋巴結的狀況。只有當LevelⅠ~Ⅱ明顯轉移或者LevelⅢ(胸小肌內側緣至腋靜脈入口處)探及增大轉移的淋巴結時才需進行Ⅰ~Ⅲ水平的全腋窩淋巴結清掃。
4.乳房修復與重建
乳腺癌改良根治手術后的乳房缺損與保乳術后的乳房畸形均需要整形外科進行再造和修復,且已成為乳腺癌完整治療方案中不可或缺的一個重要組成部分。乳房再造提高術后患者的生活質量及心理滿意度。我國乳房再造的數量逐年增加,方法越來越完善,乳房再造的理念和意識被越來越多的腫瘤外科醫師所認識和接受。
乳房再造的腫瘤學安全性是肯定的。是否行乳房再造、再造的時機及再造方式不影響乳腺癌患者術后的生存率和生存時間。乳房再造對外科手術或腫瘤復發、轉移的檢出沒有影響。
正常情況下,乳房再造不影響術后化療的進行。除非即刻再造術后出現較嚴重并發癥(如感染、切口裂開等),否則不會對化療的臨床應用及治療效果造成顯著影響。即刻乳房再造術后輔助化療不會增加再造術后并發癥發生率,不會降低即刻乳房再造成功率,不會影響傷口愈合,也不會影響再造效果。但新輔助化療會增加即刻乳房再造術后皮瓣感染及壞死的發生率。化療可造成人體免疫功能下降、抗感染能力降低,化療期間不適合做任何乳房再造手術。
無論自體組織再造,還是假體再造,均不是放射治療的禁忌癥,也不會對放療效果產生明顯影響。即刻乳房再造增加了術后放療野設計的技術難度,但周密設計的放療方案不影響放療效果。放療會影響再造的遠期美學滿意度及總體滿意度。
乳腺癌切除乳房再造的基本原則如下:
(1)必須將腫瘤治療放在首位。乳房再造的任何整形外科治療都不應推遲乳腺癌輔助治療的時間,不應影響乳腺癌輔助治療的進行。
(2)必須將乳房再造納入乳腺癌的整個治療方案,醫師有義務告知患者有選擇進行乳房再造的權利。
(3)在乳腺切除過程中,應在不違反腫瘤學原則的前提下,盡可能保留乳房的皮膚、皮下組織以及重要的美學結構(如乳房下皺襞等),最大限度地為乳房再造保留條件,提高再造乳房美學效果和患者滿意度。
(4)乳腺癌的治療應當在多學科團隊合作框架下進行,包括放射科、乳腺外科、整形外科、影像科、病理科、心理科、核醫學科、免疫科等。
乳房再造的術前檢查、評估和教育:術前應對患者的條件進行檢測與評估,分析腫瘤學情況、內科情況、組織條件、對側乳房情況等,綜合這些條件選擇創傷小、手術簡化、費用少、并發癥發生率低且效果良好的手術方案。
禁忌行乳房再造的乳腺癌類型與分期:Ⅳ期浸潤性乳腺癌、復發轉移性乳腺癌。通常認為放化療期間、放療后半年內禁行乳房再造,對于接受過放療或準備進行放療的患者,應謹慎選擇乳房再造的時機和手術方式。嚴重肥胖和吸煙、嚴重內科疾病、外周血管疾病都是術后出現并發癥的重要風險因素,是乳房再造術的相對禁忌癥。
治療周期及費用:①乳房再造是一個序列化的治療,通常需要多次手術才能達到理想的效果。采用組織擴張法進行乳房再造。②即刻乳房再造在總體治療時間和費用上較二期乳房再造具有優勢。
乳房再造的基本方法:包括皮膚覆蓋的再造和乳房體積的再造。皮膚覆蓋的再造方法包括組織擴張和自體皮瓣移植等,乳房體積的再造方法包括:應用假體、皮瓣組織瓣移植、游離自體脂肪移植等。自體組織乳房再造常用的皮瓣包括:背闊肌肌皮瓣、腹直肌肌皮瓣、腹壁下動脈穿支皮瓣等。
隨訪時間:乳房再造的隨訪時間應從術后開始,至術后5年以上,根據乳房再造方式不同,定期進行隨訪。觀察指標:包括乳腺癌的腫瘤學隨訪、乳房外形與對稱性、切口瘢痕、供區功能、假體完整性、包膜攣縮、其他并發癥。必要時還應包括心理變化、生活質量變化等。檢查項目:腫瘤學檢查、乳房體表測量值、照相、供區運動功能測定、乳房假體包膜攣縮分級,必要時行超聲、磁共振等特殊檢查。建議指導:乳房再造術后,應給患者進行詳細的術后指導,包括日常注意事項、運動、腫瘤學檢查、復查時間等。
(三)放射治療
1.早期乳腺癌保乳術后放射治療
(1)適應癥:原則上,所有接受保乳手術的患者均需接受放射治療。對年齡>70歲、乳腺腫瘤≤2cm、無淋巴結轉移、ER陽性、能接受規范內分泌治療的女性患者,可以考慮省略保乳術后放療。
(2)照射范圍。
ⅰ在有條件的單位,對經嚴格選擇的低危患者,可以考慮行部分乳腺照射,具體的患者選擇標準及治療方式參見“(三)1.(5)部分乳腺照射”章節。
ⅱ腋窩淋巴結清掃或SLNB未發現淋巴結轉移的患者,照射范圍為患側乳腺。
ⅲ前哨淋巴結陽性且未行腋窩淋巴結清掃的患者,對于T1~2期、1~2個前哨淋巴結陽性的浸潤性乳腺癌,可考慮予以全乳高位切線野放療(即切線野上界位于肱骨頭下2cm以內),如采用調強放療(intensity-modulated radiotherapy,IMRT)技術則需注意將低、中位腋窩與患側全乳設為一體化靶區進行勾畫與照射;但對于不符合該標準的保乳術后患者,照射范圍建議包括患側乳房,鎖骨上及腋窩淋巴結引流區。
ⅳ接受腋窩淋巴結清掃,陽性淋巴結數為1~3個的患者,為了盡可能降低復發風險,原則上建議行淋巴引流區照射,可選擇復發風險低危患者予以免除淋巴引流區照射。照射范圍包括患側鎖骨上、下區,內乳照射應根據個體情況決定。年輕、激素受體(Hormone Receptor,HR)陰性、廣泛脈管癌栓、原發灶位于內側/中央象限、組織學分級高級別等危險因素的重疊可能會增加淋巴引流區照射的重要性。
ⅴ接受腋窩淋巴結清掃且淋巴結轉移≥4個的患者,照射靶區需包括患側乳腺、鎖骨上/下及內乳淋巴引流區(保證心肺安全前提下)。
ⅵ內乳照射目前存在爭議,推薦具備下列條件患者考慮行內乳照射:①腋窩淋巴結清掃術后淋巴結轉移≥4個;②原發腫瘤位于內象限或中央區且伴有腋窩淋巴結轉移;③年齡<35歲且伴有腋窩淋巴結轉移;④初診時影像學診斷內乳淋巴結轉移或經病理證實內乳淋巴結轉移但未行內乳淋巴結清掃。內乳照射建議應用現代精準放療技術,以便準確評估心臟等正常組織照射劑量,同時把握全身治療及放療對心臟相關損傷與內乳預防照射的獲益與風險,必要時多學科充分溝通,或鼓勵患者參加臨床試驗。
ⅶ腋窩清掃徹底的患者,不需要預防照射。腋窩放療可用于具有以下腋窩復發高危因素的患者,但需要權衡腫瘤復發風險和放療增加淋巴水腫的風險。高危因素包括:①腋窩清掃不徹底,根據患者術前腋窩轉移淋巴結負荷、術中淋巴結與周圍血管粘連情況及手術清掃的徹底程度、放療前腋窩查體及影像學綜合評估判斷淋巴結是否殘留;②淋巴結包膜外侵犯;③腋窩淋巴結轉移數目較多同時陽性百分比高;④腋窩淋巴結陽性,腋窩淋巴結清掃總數<10個。但需要區分腋窩淋巴結總數少是因為手術清掃不足還是病理科取材不充分,必要時與外科醫師和病理科醫師進行溝通。
ⅷ對接受全乳放療的患者,對符合以下標準的患者,建議瘤床補量:①浸潤性乳腺癌:年齡≤50歲、任意級別,或51歲至70歲、高級別,或切緣陽性;②DCIS:年齡≤50歲,或高級別,或切緣邊距<2mm,或陽性切緣。對符合以下標準的復發風險較低的患者,可考慮不行瘤床補量:①浸潤性乳腺癌:年齡>70歲、激素受體陽性、低中級別并有足夠的陰性切緣(邊距≥2mm);②DCIS:年齡>50歲、經篩查發現、腫瘤大小≤2.5cm、低中級別、并有足夠的陰性切緣(邊距≥3mm)。對于不符合上述標準的患者,醫師可以根據患者情況權衡利弊(腫瘤控制和美容效果),做出個體化決策。
(3)照射技術:保乳術后放療可以通過三維適形放療、固定野或旋轉調強等照射技術進行。無論采取何種技術,推薦采用CT定位并勾畫靶區,將CT圖像導入三維計劃治療系統上進行計劃評估,以準確評估靶區及危及器官的劑量分布。CT定位時,應采用鉛絲標記患側乳腺外輪廓及乳腺原發灶手術瘢痕,以利于確定全乳腺及瘤床補量照射范圍。呼吸控制技術,如深吸氣屏氣、俯臥定位等,可能進一步降低正常器官,主要是心肺的照射劑量,推薦在有條件的單位中開展。
與二維放療相比,三維適形及調強照射有助于改善靶區內的劑量均勻性,降低正常組織的受照劑量,更好地處理乳腺與區域淋巴結照射野的銜接,在乳腺體積大、需要進行區域淋巴結照射的情況下更有優勢,但增加了計劃設計的復雜程度。推薦根據患者的病情、照射范圍及合并癥情況等個體化地選擇照射技術。
乳腺瘤床補量可采用術中放療、組織間插植、電子線或X線外照射等方式實現。推薦外科醫師在腫瘤切緣放置鈦夾,為瘤床補量提供參照。
(4)照射劑量及分割模式:推薦全乳±區域淋巴結的照射劑量為50Gy/2Gy/25f。外照射瘤床補量可序貫于全乳放療后,序貫照射劑量為10~16Gy/2Gy/5~8f;在有經驗的單位,可以考慮瘤床同步加量照射,如瘤床同步照射劑量60Gy/2.4Gy/25f。對僅行全乳照射的患者,推薦可給予大分割放療40Gy/15f或42.5Gy/16f;在有經驗的單位,也可采用43.5Gy/15f/3w的分割模式。外照射瘤床補量序貫于全乳大分割放療后,可采用常規分割模式10~16Gy/2Gy/5~8f或大分割模式 10~12.5Gy/4~5f;在有經驗的單位,也可采用大分割序貫補量模式8.7Gy/3f。推薦開展針對瘤床同步大分割加量模式的臨床研究,如瘤床同步照射劑量49.5Gy/15f。
在有經驗的單位,對于行全乳+區域淋巴結照射的患者,可考慮采用大分割照射模式,照射劑量與全乳大分割照射相同。
(5)部分乳腺照射:數項研究提示,在低危乳腺癌保乳術后患者中,部分乳腺照射可能獲得與全乳照射相同的療效。目前鼓勵患者參加部分乳腺照射相關的臨床試驗;除臨床試驗外,接受部分乳腺照射的患者需要嚴格選擇,在有經驗的醫療中心結合自身的技術條件和患者意愿有序開展,推薦適應癥如下:①年齡≥50歲;②浸潤性癌腫瘤大小≤3cm(T1、小T2),陰性切緣≥2mm;③單純低-中級別DCIS、篩查發現、腫瘤大小≤2.5cm、陰性切緣≥3mm;④SLNB或腋窩淋巴結清掃證實為N0;⑤單中心病灶;⑥無淋巴血管侵犯;⑦無廣泛導管內癌成分;⑧未接受新輔助化療;⑨最好是ER陽性且排除浸潤性小葉癌(非必須條件)。
部分乳腺照射可以通過術中放療、近距離插植或外照射進行。照射范圍為乳腺瘤床。推薦的照射劑量包括:術中放療20Gy,單次完成;近距離插植34Gy/3.4Gy/10f,每天2次,間隔至少6小時,總治療時間5天,或者其他等效生物分割劑量模式;外照射38.5Gy/10f,每天2次,5天完成。RAPID研究的隨訪結果提示,外照射這種分割方式進行部分乳腺放療的晚期美容效果相對較差,考慮到國內加速器相對不足的實際情況,也可采用38.5Gy/10f每天1次或40Gy/10f每天1次的照射模式。
2.改良根治術后放射治療
(1)適應癥:符合以下任一條件的改良根治術后患者,應考慮給予術后輔助放療:①原發腫瘤最大直徑>5cm,或腫瘤侵及乳腺皮膚、胸壁。②腋窩淋巴結轉移≥4個,或存在鎖骨上或內乳淋巴結轉移。③原發腫瘤分期T1~2且腋窩淋巴結轉移1~3個的患者,推薦在改良根治術后接受放射治療。但對其中的無明顯高危復發因素,即年齡≥50歲、腫瘤分級Ⅰ~Ⅱ級、無脈管瘤栓、腋窩淋巴結轉移數1個、激素受體陽性的患者,可考慮省略放療。④對改良根治術前接受新輔助化療的患者,術后放療指證參見“三、1.新輔助化療后術后放射治療”章節。
(2)照射范圍。
ⅰ需要接受改良根治術后放療的患者,照射范圍應包括胸壁及鎖骨上下區。
ⅱ內乳照射目前存在爭議,推薦具備下列條件患者考慮行內乳照射:①腋窩淋巴結清掃術后淋巴結轉移≥4個;②原發腫瘤位于內象限或中央區且伴有腋窩淋巴結轉移;③年齡<35歲且伴有腋窩淋巴結轉移;④初診時影像學診斷內乳淋巴結轉移或經病理證實內乳淋巴結轉移但未行內乳淋巴結清掃。內乳照射建議應用現代精準放療技術,以便準確評估心臟等正常組織照射劑量,同時把握全身治療及放療對心臟相關損傷與內乳預防照射的獲益與風險,必要時多學科充分溝通,或鼓勵患者參加臨床試驗。
ⅲ對腋窩淋巴結清掃徹底的患者,放療靶區不推薦包括患側腋窩;對SLNB后發現淋巴結轉移,但未行腋窩清掃或腋窩清掃不徹底的患者,放療靶區應考慮包括腋窩。
(3)照射技術:改良根治術后放療可以通過二維照射、三維適形放療、固定野或旋轉調強等照射技術進行。無論采取何種技術,均推薦采用CT定位并勾畫靶區及危及器官,將CT圖像導入三維計劃治療系統上進行個體化計劃評估,以準確評估靶區及危及器官的劑量分布。同時,無論采取何種照射技術,應注意在胸壁表面增加組織補償物(40%~60%照射劑量),以確保足夠的皮膚劑量。
可參照傳統二維照射方式設計照射野,如:鎖骨上照射可采用單前野或前后對穿野照射,內乳淋巴引流區可采用電子線野照射,但要求鎖骨上、內乳區90%的靶體積應達到90%的照射劑量。胸壁可采用切線野或電子線野照射,采用電子線照射時,照射范圍可參照傳統二維布野方式,包全手術疤痕和游離皮瓣范圍。
與二維放療相比,三維適形及調強放療有助于保證靶區達到處方劑量、改善靶區內的劑量均勻性,降低正常組織的受照劑量,更好地處理胸壁與區域淋巴結照射野的銜接,個體化地治療患者,但增加了計劃設計的復雜程度。推薦根據患者的病情、照射范圍及合并癥情況等個體化地選擇照射技術。采用適形調強放療時,應準確勾畫靶區,確保心肺安全,不顯著增加其他正常器官,如甲狀腺、健側乳腺、患側肩關節等的受照劑量。
(4)照射劑量及分割模式:推薦的改良根治術后的照射劑量為50Gy/2Gy/25f。在有經驗的單位,可考慮給予大分割放療40~43.5Gy/15f/3w。
(5)放射治療與全身治療的時序安排:對于有輔助化療指征的患者,術后放射治療應該在完成輔助化療后開展;如果無輔助化療指征,在切口愈合良好的前提下,術后8周內開始放射治療。輔助赫塞汀治療可以和術后放射治療同期開展。放射治療開始前,要確認左心室射血分數(left ventricular ejection fraction,LVEF)大于50%,同時盡可能降低心臟的照射劑量,尤其是患側為左側。輔助內分泌治療可以與術后放射治療同期開展。
3.特殊情況下的放射治療
(1)新輔助化療后術后放射治療。
ⅰ新輔助化療后保乳術后放療:對于接受新輔助化療降期后行保乳手術的患者,無論治療反應如何,均應行術后全乳+瘤床補量放療。瘤床靶區一般根據新輔助化療后保乳手術的實際切除范圍來確定,必要時也應參考化療前臨床分期及術后病理分期確定(關鍵是手術前對原發腫瘤退縮情況和方式的準確評估,以及陰性切緣的保障)。新輔助化療術后病理淋巴結陽性的所有患者或新輔助化療前初始臨床分期為Ⅲ期的患者,術后常規行全乳聯合淋巴引流區照射。對于初始分期Ⅱ期區域淋巴結陽性的cN 1期患者,在新輔助化療后達ypN 0期者,原則上仍需行術后全乳聯合淋巴引流區照射;臨床實踐中也可以選取一些低危患者予以謹慎地個體化免除淋巴引流區照射,如原發灶和腋窩淋巴結新輔助化療后均達pCR,年齡>40歲,不合并相關病理危險因素(如組織學3級、脈管癌栓、激素受體陰性等)。
新輔助化療后保乳術后的預防放療劑量,參照前述無新輔助化療情況。
ⅱ新輔助化療后改良根治術后放療:新輔助化療后的輔助放療決策尚無Ⅲ期隨機對照臨床試驗結果可以參考,目前推薦為結合患者新輔助治療前的臨床分期和新輔助化療后的病理分期,結合患者、腫瘤特征,進行放療決策。放療指征如下:①新輔助化療前初始分期為Ⅲ期及新輔助后腋窩淋巴結陽性的患者,推薦術后放療;②初始臨床分期為Ⅱ期(cN 1期),新輔助化療后術后病理腋窩淋巴結陰性,是否行術后放療存在爭議,鼓勵患者參加臨床研究。臨床上可選擇有高危因素患者行術后放療:年齡≤40歲、ypT>2cm、脈管瘤栓陽性、預后不良的分子亞型(激素受體陰性、HER2陽性且未行靶向治療)等。
新輔助化療后放療的照射范圍、劑量及分割模式和未接受新輔助治療的改良根治術后放療基本相同。初診局部晚期乳腺癌(locally advanced breast cancer,LABC)新輔助化療后術后放療時需要注意,明顯皮膚受侵或診斷為炎性乳癌的LABC,可以考慮在全胸壁照射50Gy分25次后,對游離皮瓣范圍的胸壁給予補量照射10~16Gy;放療時可增加皮膚表面填充物的使用次數,保證皮膚劑量充分。初診時有鎖骨上或內乳淋巴結轉移的患者,在局部區域預防照射后應對原鎖骨上或內乳淋巴結轉移部位加量照射。如果化療后鎖骨上或內乳淋巴結達到完全緩解,加量10Gy分5次;如果化療后鎖骨上或內乳淋巴結仍有殘存,加量16~20Gy分8~10次。要求患者初診基線評估時行CT檢查明確最初的淋巴結轉移部位,并穿刺明確病理學診斷,為后續放療確定補量照射范圍提供參考。
(2)乳腺重建術后放射治療:全乳切除術后乳房重建患者的放療指征與相同分期、未做重建的患者一樣,但在決策時需要額外權衡重建植入物的放療并發癥風險以及重建對放療技術的挑戰。自體重建組織可以很好地耐受放療,放療未增加自體重建患者的并發癥風險。由于放療后可能會導致自體植入物組織萎縮,可以在手術時將重建乳房體積設計略大于對側乳腺。假體重建的使用逐年上升,放療增加假體包膜攣縮風險,降低美容效果。分階段重建時,放療介入時機可以在永久假體植入之前或之后。在永久假體植入之前放療,直接照射組織擴張器,對后續的假體包膜攣縮影響小,但重建失敗率增高。在永久假體植入之后放療,重建失敗率低,但包膜攣縮并發癥增加。此外,放療介入時機的選擇還需要考量因植入永久假體手術而導致的放療延遲對腫瘤療效影響,對復發高危患者最好不要過長延遲放療。在永久假體植入之前放療的患者,為提高重建成功率,放療定位前需要完成擴張器注水程序保證充分的組織擴張,直到放療結束都不允許往擴張器內注入或者抽出鹽水,以保證靶區的體積和位置始終一致。放療需要照射同側胸壁+區域淋巴引流區,淋巴引流區照射原則同未做重建的患者。放療劑量采用常規分割50Gy分25次,5周完成。傳統的根治術將會有5%~10%的腺體殘留,皮下組織內豐富的淋巴管網是腫瘤轉移至腋窩或內乳淋巴結的重要途徑,這些均是重建術后胸壁放療的重要靶區。因為位置表淺,部分靶區位于劑量建成區,放療計劃設計時特別注意,在有擺位誤差的情況下,照射野包全靶區。根據所使用放療技術的建成區范圍,推薦在胸壁皮膚表面墊組織填充物照射10~15次,以保證靶區劑量充分。
(3)局部區域復發后的放射治療:胸壁和鎖骨上淋巴引流區是乳腺癌根治術或改良根治術后復發最常見的部位。胸壁單個復發原則上手術切除腫瘤后進行放射治療;若手術無法切除,應先進行放射治療。既往未做過放射治療的患者,放射治療范圍應包括全部胸壁和鎖骨上/下區域。鎖骨上復發的患者如既往未進行術后放射治療,照射靶區需包括患側全胸壁及鎖骨上淋巴引流區。如腋窩或內乳淋巴結無復發,無需預防性照射腋窩和內乳區。預防部位的放射治療劑量為DT45~50Gy/25f/5w,復發部位縮野補量至DT60~66Gy/30~33f/6~6.5w。既往做過放射治療的復發患者,需要參考腫瘤復發間隔時間、首程放療的劑量范圍和不良反應程度,以及再程放療的可能療效和不良反應,來決定是否進行再程放療。再程放療時,僅照射復發腫瘤部位,不推薦大范圍預防照射。
局部區域復發患者在治療前需取得復發灶的細胞學或組織學診斷。
(四)化療
1.乳腺癌輔助化療
對患者基本情況(年齡、月經狀況、血常規、重要器官功能、有無其他疾病等)、腫瘤特點(病理類型、分化程度、淋巴結狀態、HER2及激素受體狀況、有無脈管瘤栓等)、治療手段(如化療、內分泌治療、靶向藥物治療等)進行綜合分析,醫師根據治療的耐受性、術后復發風險、腫瘤分子分型和治療敏感性選擇相應治療,并權衡治療給患者帶來的風險-受益,若接受化療的患者受益有可能大于風險,可進行術后輔助化療。乳腺癌術后復發風險的分層見附件8;乳腺癌分子分型的判定見附件9。
(1)適應癥:①腋窩淋巴結陽性。②對淋巴結轉移數目較少(1~3個)的絕經后患者,如果具有受體陽性、HER2陰性、腫瘤較小、腫瘤分級Ⅰ級等其他多項預后較好的因素,或者患者無法耐受或不適合化療,也可考慮單用內分泌治療。③對淋巴結陰性乳腺癌,術后輔助化療只適用于那些具有高危復發風險因素的患者(患者年齡<35歲、腫瘤直徑>2cm、腫瘤分級Ⅱ~Ⅲ級、脈管瘤栓、HER2陽性、ER/PR陰性等)。
(2)相對禁忌癥:①妊娠期:妊娠早期患者通常禁用化療,妊娠中期患者應慎重選擇化療。②明顯衰竭或惡病質。③患者拒絕術后輔助化療。④有嚴重感染、高熱、水電解質及酸堿平衡失調的患者。⑤胃腸道梗阻或穿孔者。⑥骨髓儲備功能低下,治療前白細胞≤3.5×109/L,血小板≤80×109/L者。⑦心血管、肝腎功能損害者。
(3)輔助化療方案的選擇:常用的輔助化療方案見附件10。
ⅰ常用方案:①以蒽環類為主的方案,如AC(多柔比星/環磷酰胺),EC(表柔比星/環磷酰胺)。雖然吡柔比星(THP)循證醫學證據有限,但在我國臨床實踐中,用吡柔比星代替多柔比星也是可行的,THP推薦劑量為40~50mg/m2。②蒽環類與紫杉類聯合方案,例如TAC(T:多西他賽)。③蒽環類與紫杉類序貫方案,例如AC→紫杉醇(每周1次),AC→多西他賽(每3周1次),劑量密集型AC續貫紫杉醇(每2周1次),劑量密集型AC續貫紫杉醇(每周1次)。④不含蒽環類的聯合化療方案:TC方案(多西他賽/環磷酰胺4或6個療程),適用于有一定復發風險的患者。⑤卡培他濱的強化(聯合或序貫)可考慮在三陰性乳腺癌中使用。
ⅱHER2陽性乳腺癌:常用方案參見乳腺癌術后輔助抗HER2靶向治療部分中的相應內容。
(4)注意事項:①早期乳腺癌輔助化療的目的是爭取治愈,所以強調標準、規范的化療。②化療時應注意化療藥物的給藥順序、輸注時間和劑量強度,嚴格按照藥品說明和配伍禁忌使用。③根據患者的復發風險、耐受程度、患者意愿及循證醫學證據選擇化療方案,并制定預防嘔吐、骨髓抑制的支持方案。④不同化療方案的周期數不同,一般為4~8個周期。若無特殊情況,不建議減少周期數和劑量。70歲以上患者需個體化考慮輔助化療。⑤輔助化療一般不與內分泌治療或放療同時進行,化療結束后再開始內分泌治療,放療與內分泌治療可先后或同時進行。⑥一般推薦首次給藥劑量應按推薦劑量使用,若有特殊情況需調整時,通常不低于推薦劑量的85%,后續給藥劑量應根據患者的具體情況和初始治療后的不良反應,可以1次下調20%~25%。每個輔助化療方案一般僅允許劑量下調2次。⑦激素受體陰性的絕經前患者,在輔助化療期間可考慮使用卵巢功能抑制藥物保護患者的卵巢功能。推薦化療前1~2周給藥,化療結束后2周給予最后一劑藥物。⑧蒽環類藥物有心臟毒性,使用時須評估LVEF,一般每3個月1次。⑨所有化療患者均需要先行簽署化療知情同意書。
2.新輔助化療
新輔助化療是指為降低腫瘤臨床分期,提高切除率和保乳率,在手術或手術加局部放射治療前,首先進行全身化療。
(1)適應癥:①不可手術降期為可手術,臨床分期為ⅢA(不含T3、N1、M0)、ⅢB、ⅢC。②期望降期保乳患者,臨床分期為ⅡA、ⅡB、ⅢA(僅T3、N1、M0)期,除了腫瘤大小以外,符合保乳手術的其他適應癥。對希望縮小腫塊、降期保乳的患者,也可考慮新輔助治療。③對不可手術的隱匿性乳腺癌行新輔助治療是可行的(其中隱匿性乳腺癌定義為腋窩淋巴結轉移為首發癥狀,而乳房內未能找到原發灶的乳腺癌)。
(2)禁忌癥:①未經組織病理學確診的乳腺癌:推薦進行組織病理學診斷,并獲得ER、PR、HER2及Ki-67等免疫組化指標,不推薦將細胞學作為病理診斷標準。②妊娠早期女性為絕對禁忌:而妊娠中、晚期女性患者應慎重選擇新輔助化療,為相對禁忌,國外有成功應用的個案報道。③心血管、肝腎功能顯著損害者。④原發腫瘤為廣泛原位癌成分,未能明確浸潤癌存在者需謹慎使用。⑤腫瘤臨床無法觸及或無法評估。⑥患者拒絕術前新輔助治療。⑦有嚴重感染、高熱、水電解質及酸堿平衡紊亂的患者。⑧骨髓儲備不足,治療前中性粒細胞≤1.5×109/L,血小板≤75×109/L者。
(3)新輔助化療方案的選擇。
ⅰ對于HR陽性/HER2陰性的乳腺癌患者,有降期或保乳等需求的,優先推薦輔助化療提前到新輔助階段。
ⅱ對于HER2陽性和三陰性乳腺癌患者,可適當放寬新輔助治療適應癥,通過新輔助治療早期評價治療療效,并通過術后是否病理完全緩解制定升/降階梯輔助治療。
ⅲ對于HER2陽性的乳腺癌患者,符合新輔助適應癥的,應采用含蒽環聯合紫杉方案或非蒽環方案聯合曲妥珠單抗±帕妥珠單抗進行新輔助治療。加用帕妥珠單抗會進一步提高pCR率,在HR陰性、淋巴結陽性的患者獲益更多。
ⅳ對于三陰性乳腺癌患者,新輔助推薦含蒽環類和紫杉類的常規方案。鉑類可作為三陰性患者新輔助治療方案的一部分,以增加腫瘤退縮的概率和pCR的可能性,但決策加鉑類應該權衡潛在的獲益與傷害,因為未必轉化為DFS的遠期獲益。單純BRCA1/2致病或疑似致病性突變,不足以成為選擇含鉑治療的理由。對于有心臟基礎疾患的患者,可以考慮單純紫杉類+鉑類的新輔助治療。PD-1/PD-L1抗體在國內尚未獲得相關適應癥,遠期毒性和獲益未明,不常規推薦在該類患者新輔助治療中添加免疫檢查點抑制劑。
(4)注意事項:①化療前必須對乳腺原發灶行空芯針活檢明確組織學診斷及免疫組化檢查,區域淋巴結轉移可以采用細胞學診斷。②明確病理組織學診斷后實施新輔助化療。③不建議Ⅰ期患者選擇新輔助化療。④在治療有反應或疾病穩定的患者中,推薦手術前用完所有的既定周期數。⑤應從體檢和影像學2個方面評價乳腺原發灶和腋窩淋巴結轉移灶療效,按照實體腫瘤療效評估標準RECIST或WHO標準評價療效。⑥無效時暫停該化療方案,改用手術、放射治療或者其他全身治療措施(更換化療方案或改行新輔助內分泌治療)。⑦新輔助化療后,即便臨床上腫瘤完全消失,也必須接受既定的后續手術治療,根據個體情況選擇乳腺癌根治術、乳腺癌改良根治術或保留乳房手術。⑧術后輔助化療應根據術前新輔助化療的周期、療效及術后病理檢查結果確定治療方案。⑨推薦根據化療前的腫瘤臨床分期來決定是否需要輔助放療及放療范圍。
(5)全身處理:對于新輔助化療未達到pCR的患者(已完成足療程的新輔助治療),尤其是三陰性乳腺癌患者,可考慮術后追加6~8個療程卡培他濱治療;HER2陽性患者,優先考慮采用T-DM1強化輔助治療的方式,也可采用繼續完成曲妥珠單抗聯合帕妥珠單抗共1年的方式。無論是否達到pCR,部分研究顯示特定人群奈拉替尼延長治療1年可進一步降低復發風險。對于HR陽性的患者,需要給予內分泌治療,內分泌治療是否需要強化,以及強化的方式可主要依據患者新輔助前的狀態進行評估。
3.晚期乳腺癌化療
晚期乳腺癌的主要治療目的不是治愈患者,而是提高患者生活質量、延長患者生存時間。治療手段以化療和內分泌治療為主,必要時考慮手術或放射治療等其他治療方式。根據原發腫瘤特點、既往治療、無病生存期、轉移部位、進展速度、患者狀態等多方面因素,因時制宜、因人制宜,選擇合適的綜合治療手段,個體化用藥。
有轉移或復發表現的乳腺癌患者的分期評估檢查包括病史、體格檢查、實驗室檢查、胸部X線或CT、腹部超聲、骨顯像等。對疼痛或骨顯像異常患者行骨的放射學檢查,還可考慮腹部診斷性CT或MRI、頭顱CT或MRI。通常不建議使用PET-CT對患者進行評估,在其他檢查結果不確定或可疑時PET-CT是可選擇的。腫瘤轉移灶或第一復發灶的活檢應作為晚期乳腺癌患者病情評估的一部分,同時檢測ER、PR、HER2、Ki-67等分子標志物,以制訂針對性治療方案。
(1)符合下列某一條件的患者可考慮化療:①ER/PR陰性或低表達。②內臟危象或有癥狀的內臟轉移。③ER/PR陽性內分泌治療耐藥者(特別是原發性耐藥)。
(2)化療藥物與方案:晚期乳腺癌常用化療方案見附件11。
晚期乳腺癌常用的化療藥物包括蒽環類、紫杉類、長春瑞濱、卡培他濱、吉西他濱、鉑類等。應根據疾病的范圍、腫瘤的分子特征、既往治療及患者的特點來制訂個體化的化療方案。制訂方案時應充分考慮患者的意愿,疾病的不可治愈性,平衡生活質量和生存期。在疾病發展的不同階段合理選擇單藥或聯合化療。
ⅰ單藥化療:對腫瘤發展相對較慢,腫瘤負荷不大,無明顯癥狀,特別是老年耐受性較差的患者優選單藥化療。
蒽環類(紫杉類)治療失敗的常用定義為使用蒽環類(紫杉類)解救化療過程中發生疾病進展,或輔助治療結束后12個月內發生復發轉移。對于既往蒽環類治療失敗的患者,通常首選以紫杉類(如紫杉醇、多西他賽及白蛋白結合型紫杉醇)為基礎的單藥或聯合方案;對于既往蒽環類和紫杉類治療均失敗的患者,目前尚無標準化療方案,可考慮其他單藥或聯合方案。
常用的單藥包括:蒽環類,如多柔比星、表柔比星、吡柔比星及聚乙二醇化脂質體多柔比星;紫杉類,如紫杉醇、多西他賽、白蛋白結合型紫杉醇;抗代謝藥如卡培他濱、吉西他濱等;非紫杉類微管形成抑制劑,如長春瑞濱、艾立布林、優替德隆等;依托泊苷膠囊、環磷酰胺片等口服方便,可以作為后線治療的選擇。
ⅱ聯合化療:適合病情進展較快,腫瘤負荷較大或癥狀明顯的患者。聯合化療方案的選擇多種多樣,主要基于既往循證醫學的證據、聯合藥物之間的相互作用、聯合藥物的毒性譜、患者的個體狀態來綜合制定,不推薦聯合三種或三種以上的化療藥物。
①對于三陰性乳腺癌,可選擇GP方案(吉西他濱聯合順鉑)、GC方案(吉西他濱聯合卡鉑)、AP方案(白蛋白紫杉醇聯合順鉑/卡鉑)、PC方案(其他紫杉類藥物聯合卡鉑/順鉑)。②單藥或聯合化療均可在循證證據支持下聯合靶向治療。③聯合化療時,是采用持續方式還是4~8個療程后停藥或維持治療需權衡療效、藥物不良反應和患者生活質量。④對多程化療失敗的患者無標準治療,鼓勵患者參加新藥臨床試驗或對癥支持治療。對于三陰性乳腺癌,sacituzumab govitecan是一種重要的靶向治療選擇,已獲得美國FDA批準,但尚在中國開展臨床研究。⑤對HER2陽性患者,化療同時應聯合抗HER2靶向藥物。
ⅲ維持化療:對完成了4~6周期化療,治療有效、耐受性較好的患者,可以持續治療至病情進展或出現不能耐受的毒性。聯合化療有效但不能耐受或無意愿繼續聯合化療者可考慮維持治療,可選擇原先聯合方案中的一個單藥化療維持,激素受體陽性者還可考慮內分泌±靶向治療維持。維持治療中應該加強患者管理,定期評估療效和不良反應。
(五)內分泌治療
1.輔助內分泌治療
(1)適應癥。
ⅰ激素受體ER和/或PR陽性的浸潤性乳腺癌患者,皆應接受術后輔助內分泌治療。依據最新ASCO/CAP指南,盡管ER免疫組織化學染色為1%~100%的腫瘤皆被視為ER陽性,但ER免疫組織化學染色為1%~10%為ER低表達。ER低表達的生物學行為通常與ER陰性乳腺癌相似,在術后輔助內分泌中的獲益較少,在做治療決策時也應當考慮到這一點。
ⅱ原位癌患者如出現以下情況可考慮行5年內分泌治療:①保乳手術后需要放療患者,特別是其中激素受體陽性的DCIS;②僅行局部切除DCIS患者;③行乳腺全切患者,用于預防對側乳腺癌發生。
(2)禁忌癥:①使用內分泌藥物有禁忌的患者:有深部靜脈血栓或肺栓塞史者。②嚴重肝腎功能損傷者慎用。③孕婦及既往應用內分泌治療藥物過敏者。
(3)藥物選擇:①絕經前患者輔助內分泌治療首選他莫昔芬。②對于中高復發風險的絕經前患者(具體需綜合考量年齡、腫塊大小、淋巴結狀態、組織學分級、Ki-67增殖指數等,具體可參見《中國早期乳腺癌卵巢功能抑制臨床應用專家共識(2018年版)》)推薦在輔助內分泌治療中應用卵巢抑制劑。對于年輕的(<35歲)的乳腺癌患者,更推薦卵巢功能抑制加芳香化酶抑制劑。他莫昔芬或芳香化酶抑制劑加卵巢切除或卵巢抑制治療5年。③他莫昔芬治療期間,如果患者已經絕經,可以換用芳香化酶抑制劑。④絕經后患者優先選擇第三代芳香化酶抑制劑,建議起始使用。⑤不能耐受芳香化酶抑制劑的絕經后患者,仍可選擇他莫昔芬。
(4)注意事項。
ⅰ患者應在化療之前進行激素水平的測定,判斷月經狀態,絕經定義見附件12。
ⅱ術后輔助內分泌治療的治療期限為5年,延長內分泌治療需要根據患者的具體情況個體化處理,需要結合腫瘤復發的高危因素和患者的意愿綜合決策;對于高危絕經前患者,若在他莫昔芬治療滿5年后患者仍未絕經,可以根據情況增加至10年,如果患者在治療過程中絕經,可考慮延長芳香化酶抑制劑治療,直至完成10年的內分泌治療。
ⅲ輔助內分泌治療(促黃體素釋放激素激動劑除外)不建議與輔助化療同時使用,一般在化療之后使用,可以和放療及曲妥珠單抗治療同時使用。
ⅳER和PR陰性的患者,不推薦進行輔助內分泌治療。
ⅴ內分泌治療中常見不良反應的監測和管理:①在應用他莫昔芬過程中應注意避孕,需要對子宮內膜進行超聲監測,每6~12個月進行1次婦科檢查。②對于應用芳香化酶抑制劑患者應監測骨密度和補充鈣劑及維生素D。對于嚴重骨質疏松患者可進行正規抗骨質疏松治療。③患者在接受芳香化酶抑制劑治療期間應監測血脂,必要時應給予血脂異常患者相應的治療。對于在內分泌治療中嚴重的不良反應需要考慮停藥或者更換治療方案。
2.晚期乳腺癌的內分泌治療
(1)首選內分泌治療的適應癥:①患者年齡>35歲。②無病生存期>2年(聯合部分靶向藥物時可適當突破該界限)。③僅有骨和軟組織轉移。④無癥狀的內臟轉移。⑤ER和/或PR陽性。⑥受體不明或受體為陰性的患者,如臨床病程發展緩慢,也可以試用內分泌治療。
(2)藥物選擇。
ⅰ絕經后患者的內分泌治療推薦:芳香化酶抑制劑包括非甾體類(阿那曲唑和來曲唑)、甾體類(依西美坦)、ER調變劑(他莫昔芬和托瑞米芬)、ER下調劑(氟維司群)、孕酮類藥物(甲地孕酮)、雄激素(氟甲睪酮)及大劑量雌激素(乙炔基雌二醇)。
ⅱ絕經前患者內分泌治療推薦:在卵巢功能抑制基礎上(主要是使用促黃體素釋放激素激動劑和手術去勢),可參照絕經后乳腺癌處理。未行卵巢功能抑制的,可考慮ER調變劑(他莫昔芬和托瑞米芬)、孕酮類藥物(甲地孕酮)、雄激素(氟甲睪酮)及大劑量雌激素(乙炔基雌二醇)。
ⅲ絕經前和絕經后患者均可考慮在內分泌治療的基礎上聯合靶向治療(CDK4/6抑制劑、HDAC抑制劑等)。
(3)晚期乳腺癌一線內分泌治療的選擇。
ⅰ芳香化酶抑制劑聯合CDK4/6抑制劑(哌柏西利、阿貝西利)是HR陽性/HER2陰性絕經后(自然絕經或手術去勢)或絕經前但經藥物去勢后乳腺癌患者一線內分泌治療的優先選擇。
ⅱ當CDK4/6抑制劑不可及時,單藥內分泌治療也是可行的;絕經后(自然絕經或手術去勢)患者可使用氟維司群、芳香化酶抑制劑(Aromatase Inhibitor,AI)、雌激素受體(Estrogen Receptor,ER)調變劑(他莫昔芬和托瑞米芬);絕經前患者可使用卵巢功能抑制(Ovarian Function Suppression,OFS)聯合氟維司群、OFS聯合AI、OFS聯合ER調變劑、單純ER調變劑。
ⅲ絕經前患者在使用卵巢功能抑制劑后,可按照絕經后模式處理。
(4)晚期乳腺癌二線內分泌治療的選擇:一線內分泌治療失敗后,非內臟危象的患者仍然可以選擇二線內分泌治療±靶向治療。不推薦重復使用輔助治療或一線治療已被證明耐藥的內分泌藥物。
ⅰ對于尚未使用過CDK4/6抑制劑的患者:①氟維司群聯合CDK4/6抑制劑(哌柏西利、阿貝西利)是HR陽性/HER2陰性絕經后(自然絕經或手術去勢)或絕經前但經藥物去勢后乳腺癌患者二線內分泌治療的優先選擇。②甾體/非甾體芳香化酶抑制劑(±OFS)或他莫昔芬(±OFS)聯合CDK4/6抑制劑亦可選用。對于已經使用過CDK4/6抑制劑的患者,目前并無充分證據支持CDK4/6抑制劑的跨線治療。
ⅱ當以上聯合的小分子靶向藥物不可及時,單藥內分泌治療也是可行的;絕經后(自然絕經或手術去勢)患者可使用氟維司群、AI、ER調變劑(他莫昔芬和托瑞米芬);絕經前患者可使用OFS聯合氟維司群、OFS聯合AI、OFS聯合ER調變劑、單純ER調變劑。
(3)注意事項:①連續兩線內分泌治療后腫瘤進展,通常提示內分泌治療耐藥,應該換用細胞毒藥物治療或進入臨床試驗研究。②在內分泌治療期間,應每2~3個月評估1次療效,對達到治療有效或疾病穩定患者應繼續給予原內分泌藥物維持治療,如腫瘤出現進展,應根據病情決定更換其他機制的內分泌治療藥物或改用化療等其他治療手段。
(六)靶向治療
目前,針對HER2陽性的乳腺癌患者可進行靶向治療,國內主要藥物是曲妥珠單抗、帕妥珠單抗、吡咯替尼、T-DM1、拉帕替尼等。
1.HER2陽性的定義
(1)HER2基因擴增:免疫組化染色3+、FISH陽性或者色素原位雜交法(CISH)陽性。
(2)HER2免疫組化染色(2+)的患者,需進一步行FISH或CISH檢測HER2基因是否擴增。
⒉注意事項
(1)治療前必須獲得HER2陽性的病理學證據。(2)曲妥珠單克隆抗體6mg/kg(首劑8mg/kg)每3周方案,或2mg/kg(首劑4mg/kg)每周方案。
(3)首次治療后觀察4~8個小時。
(4)一般不與阿霉素化療同期使用,但可以序貫使用。
(5)與非蒽環類化療、內分泌治療及放射治療可同期應用。
(6)曲妥珠單克隆抗體開始治療前應檢測LVEF,使用期間每3個月監測1次LVEF。治療中若出現LVEF<45%或低于治療前16%以上,應暫停治療,并跟蹤監測LVEF動態變化,直至恢復到45%以上方可繼續用藥。若不恢復,或繼續惡化或出現心力衰竭癥狀則應當終止曲妥珠單抗治療。
3.術后輔助靶向治療
(1)適應癥:①原發浸潤灶>1cm(T1c及以上)的HER2陽性乳腺癌患者推薦使用曲妥珠單抗。②原發浸潤灶在0.6~1cm的HER2陽性淋巴結陰性乳腺癌患者(T1bN0)及腫瘤更小、但腋窩淋巴結有微轉移的患者(pN1mi)可推薦使用曲妥珠單抗。③原發浸潤灶<0.5cm(T1a)的HER2陽性淋巴結陰性乳腺癌患者一般不推薦使用曲妥珠單抗,但伴有高危因素的患者,例如激素受體陰性、分級較高、Ki-67高等可以考慮使用。
(2)相對禁忌癥:①治療前LVEF<40%。②患者拒絕術后輔助靶向治療。
(3)治療方案選擇:常用治療方案見附件13。①可選擇TCH(P)、AC-TH(P)方案,對于心臟安全要求較高的患者可選擇TCH、TC4H(此處C為CTX)和wPH治療方案;對于高危復發風險患者(如淋巴結陽性)的患者,推薦曲妥珠單抗與帕妥珠單抗雙靶向治療聯合輔助化療,其中帕妥珠單抗,3周1次,劑量為420mg(首次劑量為840mg),共1年;如ER+,亦可考慮在曲妥珠單抗治療結束后,給予1年的奈拉替尼強化。②小腫瘤患者(腫瘤直徑≤1cm)可以選擇紫杉醇周療加曲妥珠單抗(wPH)方案治療。
(4)注意事項:①與蒽環類藥物同期應用必須慎重,但可以在前、后階段序貫應用。與非蒽環類藥物化療、內分泌治療或放療都可同期應用。②目前曲妥珠單克隆抗體輔助治療期限仍為1年。
4.術前新輔助靶向治療
HER2陽性乳腺癌對抗HER2靶向治療敏感性高,在這部分患者的新輔助治療方案中應包含抗HER2靶向治療。
(1)新輔助靶向治療藥物的選擇與原則:①曲妥珠單抗、帕妥珠單抗雙靶向是目前新輔助靶向治療的首選治療策略。②對于HER2陽性的乳腺癌患者,符合新輔助適應癥的,應采用含蒽環聯合紫杉方案或非蒽環方案聯合曲妥珠單抗±帕妥珠單抗進行新輔助治療。③在新輔助靶向治療中加入帕妥珠單抗可以進一步提高病理完全緩解率,在HR陰性、淋巴結陽性的患者獲益更多。④有蒽環類藥物使用禁忌、高齡或其他心臟疾病隱患的患者可以使用不含蒽環方案如TCH(P)方案。
(2)注意事項:①新輔助治療期間應嚴密監測療效,按照RECIST或WHO標準評價原發灶和/或淋巴結的療效,應用曲妥珠單抗治療期間進展的患者在后續新輔助治療中可考慮保留曲妥珠單抗。②接受新輔助靶向治療的患者輔助階段應補足輔助曲妥珠單抗±帕妥珠單抗治療至1年。③對未達到pCR的HER2陽性患者,優先考慮采用T-DM1強化輔助治療的方式,也可采用繼續完成曲妥珠單抗聯合帕妥珠單抗共1年的方式。無論是否達到pCR,部分研究顯示特定人群奈拉替尼延長治療1年可進一步降低復發風險。④單獨新輔助靶向治療或與內分泌治療聯用尚缺乏足夠的證據,應用應限制于臨床研究。
5.晚期HER2陽性乳腺癌的靶向治療選擇
持續的抗HER2治療是HER2陽性晚期乳腺癌重要的治療原則,常用治療方案見附件14。
(1)HER2陽性晚期腫瘤的一線治療選擇。
ⅰ首選曲妥珠單抗、帕妥珠單抗雙靶向治療聯合紫杉類藥物。其他可選方案包括曲妥珠單抗單靶聯合紫杉類藥物,曲妥珠單抗也可聯合長春瑞濱、卡培他濱等其他化療藥物。
ⅱ對于未使用過曲妥珠單抗或符合曲妥珠單抗再使用條件(曲妥珠單抗輔助治療結束后超過1年以上復發轉移的)的患者,應首選以曲妥珠單抗±帕妥珠單抗為基礎的一線治療。而停用曲妥珠單抗至復發間隔時間≤6~12個月患者則建議選用二線抗HER2方案治療。
ⅲ對于HER2陽性/HR陽性的患者,如不適合化療或病情進展緩慢者可以考慮抗HER2治療聯合內分泌藥物作為一線治療選擇。
(2)經曲妥珠單抗±帕妥珠單抗治療后疾病進展的治療選擇。
ⅰ曲妥珠單抗治療病情進展后,仍應持續使用抗HER2靶向治療。
ⅱ當一線治療后病情進展時可選擇以下治療策略:①對于曲妥珠單抗±帕妥珠單抗治療失敗患者,單藥恩美曲妥珠單抗(trastuzumab emtansine,T-DM1)可延長無進展生存時間和總生存時間。②吡咯替尼聯合卡培他濱較拉帕替尼聯合卡培他濱可延長無進展生存時間。③其他抗HER2靶向藥物:伊尼妥單抗聯合長春瑞濱等化療也可作為曲妥珠單抗非耐藥患者的抗HER2治療選擇之一。單純兩種靶向藥物的聯合(如拉帕替尼聯合曲妥珠單抗)也有證據改善OS。④曲妥珠單抗允許進行跨線治療。⑤多線抗HER2治療失敗,無法獲得進一步治療的,建議參加臨床研究。
(3)注意事項。①曲妥珠單抗、帕妥珠單抗:治療前LVEF<50%。應用前應進行心功能基線評估,對于心血管事件高危人群應盡量避免使用。②同時進行蒽環類藥物化療。應盡量避免同時使用蒽環類等具有協同損害效應的藥物。③治療過程中應定期進行心功能評估,若LVEF較基線下降≥15%或低于正常范圍且下降≥10%,應暫停抗HER2治療,于3~4周內復查LVEF,再次評估是否能繼續抗HER2治療。④T-DM1:基線及用藥期間應行血小板規范監測,若出現血小板減少應及時減量或停藥。出現2級及以上血小板減少時應警惕發展為持續性血小板減少癥的可能,若常規升血小板治療效果不佳,應及時請專科醫師會診并處理。⑤吡咯替尼:用藥前應針對腹瀉等不良反應及管理方案進行患者教育,用藥期間應對腹瀉進行監測和管理。
(七)中醫治療
中醫藥有助于減輕放療、化療、內分泌治療的副作用和不良反應,調節患者免疫功能和體質狀況,改善癌癥相關癥狀和生活質量,可能延長生存期,可以作為乳腺癌治療的重要輔助手段。
內傷情志、痰瘀互結、正氣虧虛是乳腺癌的主要病因、病機,疏肝解郁、化痰散瘀、調補氣血、滋補肝腎是相應主要治法。在辨證論治法則基礎上,采用中藥湯劑治療是中醫治療的主要方式。此外,秉承中醫外科治療思想,以“陰證”“陽證”論治乳腺癌是臨床常用方法。小金丸和西黃丸是治療乳腺癌“陰證”“陽證”的代表性中成藥,臨床中得到廣泛應用。在中醫師指導下正確使用中成藥,患者的安全性和耐受性均較好。
六、診療流程
(一)診斷流程
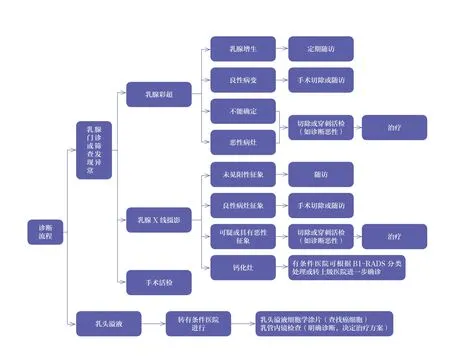
(二)治療流程
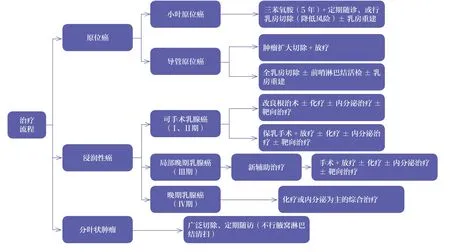
七、隨訪
(一)臨床體檢:最初2年每4~6個月1次,其后3年每6個月1次,5年后每年1次。
(二)乳腺超聲:每6個月1次。
(三)乳腺X線攝影:每年1次。
(四)X線胸片或胸部CT:每年1次。
(五)腹部超聲:每6個月1次,3年后改為每年1次。
(六)存在腋窩淋巴結轉移4個以上等高危因素的患者,行基線骨顯像檢查,全身骨顯像每年1次,5年后可改為每2年1次。
(七)血常規、血液生化、乳腺癌標志物的檢測每6個月1次,3年后每年1次。
(八)應用他莫昔芬的患者每年進行1次盆腔檢查。
附件:
1.乳腺影像學診斷報告基本指南
2.乳腺癌的組織學分型
3.乳腺浸潤性癌組織學分級
4.乳腺癌的pTNM分期(AJCC第8版)
5.乳腺癌病理報告內容及基本格式
6.乳腺癌HER2/neu FISH檢測報告基本格式
7.保留乳房手術后美容效果評價標準
8.乳腺癌術后復發風險的評估
9.乳腺癌分子分型
10.常用的輔助化療方案
11.晚期乳腺癌常用化療方案
12.絕經的定義
13.術后輔助靶向治療常用治療方案
14.晚期HER2陽性乳腺癌的靶向治療常用治療方案
15.乳腺癌診療指南(2022年版)編寫審定專家組

