葉酸-人血白蛋白-索拉非尼納米粒的制備與體外抗腫瘤活性評價*
高文慧,吳錦俊,簡曉順
(1.廣州醫科大學附屬腫瘤醫院藥學部,廣州 510095;2.廣州中醫藥大學國際中醫藥轉化醫學研究所,廣州 510006)
肝癌是我國第4位高發的惡性腫瘤和第2位腫瘤致死病因[1],外科手術能延長早期患者生存期,是首選治療方法。但肝癌早期檢出率很低,很多患者確診時已到中晚期,無法實施手術,全身治療成為這些患者的最終選擇。索拉非尼(sorafenib,SRF)是肝癌首選一線治療藥物,具有雙重抗腫瘤作用:既可以阻斷RAF/MEK/ERK通路抑制腫瘤增殖,也可以抑制血管內皮生長因子受體(vascular endothelial growth factor receptor,VEGFR)和血小板衍生生長因子受體(platelet derived growth factor receptor,PDGFR),減少腫瘤血管生成。然而在臨床實際應用中,索拉非尼無進展生存期僅為167 d,治療效果并不理想。
納米技術為改善抗腫瘤藥物腫瘤靶向性和療效提供了有效途徑:將藥物載入納米材料,制備成納米藥物傳遞系統,已被證明能提高藥物靶向性、抗腫瘤活性和全身用藥安全性[2-3]。白蛋白是天然親水性納米材料,通過gp60受體和分泌型富含半胱氨酸的酸性蛋白(secreted protein acidic and rich in cysteine,SPARC)在腫瘤部位特異性蓄積,對腫瘤具有天然親和力,是理想的抗腫瘤藥物載體[4-5]。
將腫瘤特異性配體連接到納米藥物傳遞系統表面,可進一步提高其腫瘤靶向性。研究表明,肝癌組織葉酸(folic acid,FA)受體表達率88.9%,其表達水平與已知高表達葉酸受體的Hela細胞相當[6],因此葉酸是理想的肝腫瘤特異性靶向配體。FANSU等[7]制備的葉酸-牛血清白蛋白-黃芩苷納米粒能顯著提高黃芩苷對乳腺癌細胞體外和體內的抗腫瘤活性,說明葉酸修飾的白蛋白納米粒能提高抗腫瘤藥物對葉酸受體高表達腫瘤的靶向能力。
本研究采用葉酸修飾的白蛋白(folic acid-human serum albumin,FA-HSA)包載索拉非尼,制備葉酸-人血白蛋白-索拉非尼納米粒(folic acid-human serum albumin-sorafenib nanoparticles,FA-HSA-SRF-NPs),以提高索拉非尼對HepG2肝腫瘤細胞的靶向性和抗腫瘤活性,為該藥的納米劑型在肝癌治療中的應用提供參考。
1 材料與方法
1.1藥品與試劑 索拉非尼(中國阿拉丁公司,批號:1528035,含量≥99.9%);1-乙基-3-[3-二甲基氨基丙基]碳二亞胺鹽酸鹽[1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC,上海麥克林生化科技有限公司];(N)-N-二環己基碳二酰胺(N,N'-dicyclohexylcarbodiimide,DCC,上海麥克林生化科技有限公司);N-羥基琥珀酰亞胺(N-hydroxy succinimide,NHS,上海麥克林生化科技有限公司);胎牛血清(fetal bovine serum,FBS,Gibco公司);人血清白蛋白(美國Sigma公司,批號:A0307A,含量≥96%);葉酸(上海源葉生物科技有限公司,批號:JM0310RB14,含量≥96%);無葉酸1640培養基(Gibco公司,批號:1968452);胰蛋白酶(Gibco公司,批號:2046777);二甲亞砜(dimethyl sulfoxide,DMSO,上海麥克林生化科技有限公司,批號:2540C551);4',6-二脒基-2-苯基吲哚二鹽酸鹽(4',6-diamidino-2-phenylindole dihydro-chloride,DAPI,上海麥克林生化科技有限公司);Annexin V-FITC/PI凋亡試劑盒(Annexin V-FITC-PI apoptosis detection kit,聯科生物科技股份有限公司,批號:A10714);BCA蛋白測定試劑盒(BCA protein assay kit,賽默飛世爾科技公司,批號:UF281363);苯甲基磺酰氟蛋白酶抑制劑(phenylmethanesulfonyl fluoride,PMSF,大連美侖生物技術有限公司,批號:20171011,100 mmol·L-1);聚(ADP-核糖)聚合酶(poly ADP-ribose polymerase,PARP,9542P-RabbitmAb,CST公司,批號:15);β-tubulin(556321-MousemAb,BD公司,批號:8347561);聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF,Millipore公司);增強型化學發光液(enhanced chemiluminescence,ECL,美國Bio-Rad公司,批號:102031360)。
1.2儀器與設備 HEPA Class 100二氧化碳(CO2)培養箱(德國Thermo電子公司);5810R低溫離心機(德國Eppendorf公司);光學顯微鏡(德國Leica公司);生物安全柜(Thermo電子公司);多道可調移液器(Eppendorf 德國);LC-20AT高效液相色譜儀(島津公司);1290超高效液相色譜儀(美國Agilent公司);6460型三重四級桿質譜(美國Agilent公司);超聲波細胞粉碎儀(美國Branson公司);ELX800多功能酶標儀(BioTek公司);恒溫水浴箱(德國Thermo Scientific公司);FACSCanto II流式細胞儀(BD公司);超純水儀(美國Millipore公司);液氮罐(德國Thermo Scientific公司)等。膠片(柯達公司);6孔細胞培養板(美國Coming公司);96孔細胞培養板(美國Coming公司);超純水;6孔細胞培養板(美國Coming公司);細胞刮;蓋玻片;流式細胞管等。
1.3細胞復蘇與傳代 HepG2細胞(廣州醫科大學腫瘤研究所贈)。37 ℃水浴融化凍存管,離心棄去上清液,完全培養基分散后繼續培養。當瓶底細胞面積達80%~90%時棄去培養基,磷酸鹽緩沖溶液(phosphate buffered saline,PBS)蕩洗,胰酶消化,無菌吸管吹打分散細胞,離心,棄去上清液,用完全培養基分散,取50%重新培養。
1.4實驗方法
1.4.1納米粒的制備 ①人血白蛋白-索拉非尼納米粒(HSA-SRF-NPs):將索拉非尼10 mg溶于DMSO1 mL中,渦旋至完全溶解,逐滴加入人血白蛋白47.6 mL中(0.5%,超純水),攪拌30 min,加入EDC 3 mg交聯2 h,PBS透析,每次12 h,共2次。
②葉酸活性酯(folic acid-N-hydroxysuccinimide,FA-NHS):稱取葉酸約300 mg、DCC約99 mg和NHS約78 mg,加入DMSO 10 mL中,攪拌使充分溶解,加入三乙胺溶液500 μL,避光反應過夜,過濾除去反應副產物,充分攪拌條件下逐滴加入冷丙酮/乙醚溶液中,過濾并真空干燥。
③葉酸-人血白蛋白:精密稱取FA-NHS15 mg,加入DMSO 0.1 mL,渦旋至完全溶解。稱取人血白蛋白0.119 g,加入pH 值9.6碳酸鹽緩沖液20 mL,攪拌至完全溶解后加入上述FA-NHSDMSO溶液,避光反應1 h,超純水透析24 h,每12 h換水一次。
④葉酸-人血白蛋白-索拉非尼納米粒:精密稱取索拉非尼5 mg,加入DMSO 0.25 mL,渦旋至完全溶解。將上述FA-HSA溶液稀釋至23.8 mL(0.5%),攪拌下加入索拉非尼的DMSO溶液,攪拌30 min后加入EDC3 mg,避光反應1 h,PBS透析24 h,每12 h換水一次。
1.4.2熒光標記HSA和FA-HSA制備 將FITC 10 mg用DMSO 1 mL溶解,配制成10 mg·mL-1儲備液。
FITC-HSA的制備:稱取白蛋白30 mg,用碳酸鈉-碳酸氫鈉緩沖液(sodium carbonate-sodium bicarbonate buffer solution,CBS)5 mL溶解,加入FITC溶液(含FITC 0.5 mg)50 μL,避光反應過夜,PBS透析48 h,每12 h換透析液1次,直至外液澄清無顏色,4~8 ℃下避光保存。
FITC-FA-HSA的制備:稱取白蛋白30 mg,CBS 5 mL溶解,加入FA-NHS 2 mg避光反應1 h后,加FITC溶液50 μL(含FITC 0.5 mg),避光反應過夜,PBS透析48 h,每12 h換透析液一次,直至外液澄清無顏色,4~8 ℃下避光保存。
FITC溶液的配制:將FITC溶液50 μL(含FITC 0.5 mg)加入PBS7 mL中,混勻,4~8 ℃下避光保存。
1.4.3葉酸-人血白蛋白-索拉非尼納米粒的表征 激光粒度分布和電位測定儀測定粒徑分布和Zeta電位,透射電鏡(transmission electron microscope,TEM)觀察形態特征(3%磷鎢酸染色,pH值7.0)。HPLC法測定載藥量和包封率,超高效液相色譜串聯質譜(ultra-high-performance liquid chromatography tandem mass spectrometry,UHPLC-MS/MS)系統測定葉酸偶聯量。
1.4.4細胞對納米材料的攝取
①共聚焦顯微鏡觀察:6孔板中放置蓋玻片,將HepG2細胞接種于蓋玻片上,接種密度:每孔5×104個。培養24 h,分別加入FITC、FITC-HSA和FITC-FA-HSA100 μL,培養3 h。取出蓋玻片,PBS清洗,室溫下4%多聚甲醛固定30 min,超純水洗3次,DAPI染色細胞核(藍色)。將蓋玻片正面朝下放在載玻片上,共聚焦顯微鏡上觀察并攝影(×20),每張圖片用Image J軟件測量熒光強度并計算平均吸光度。
②HepG2細胞內索拉非尼的含量測定:將HepG2細胞接種于6孔板,接種密度每孔5×105個,培養24 h,棄去上清液,加入含6 μmol·L-1索拉非尼、HSA-SRF-NPs或FA-HSA-SRF-NPs完全培養基,分別培養1,2,3 h后,PBS洗滌3次,吸干殘留PBS,加入裂解液0.1 mL,4~8 ℃裂解30 min,再加入DMSO 0.05 mL,將裂解細胞刮入1.5 mL離心管,超聲粉碎1~2 s,加入乙腈0.15 mL沉淀蛋白,渦旋混勻,12 000 r·min-1離心15 min (r=5 cm),取上清液進樣20 μL,HPLC法測定索拉非尼含量。
HPLC色譜條件。色譜柱:C18柱(150 mm×4.6 mm,5 μm);檢測溫度:室溫;流動相:乙腈和純化水(70:30),純化水中含有三乙胺(20 mL/1000 mL)并用磷酸調節pH值至5.4;流速:1 mL·min-1;檢測波長:265 nm;進樣量:20 μL。
1.4.5細胞毒性評價 將HepG2細胞接種于96孔板,接種密度每孔5×103個,培養24 h,棄去上清液,依次加入含有索拉非尼、HSA-SRF-NPs或FA-HSA-SRF-NPS的完全培養基,使各孔索拉非尼的濃度分別為1.5,3,4.5,6,7.5,9 μmol·L-1,繼續培養48 h。每孔加入MTT 10 μL,培養箱中孵化4 h,各孔加入DMSO 150 μL,震蕩溶解10 min,酶標儀測定波長490 nm處吸光度值(A值)。根據公式:細胞存活率(%)=(實驗組A值-空白組A值)/(對照組A值-空白組A值)×100%,計算分析樣品的細胞毒性并進行比較(實驗組:加藥孔;對照組:未加藥組;空白組:無細胞,只加培養液、MTT)。
1.4.6細胞凋亡檢測 將HepG2細胞接種于6孔板,接種密度每孔1×105個,培養24 h,加入含13.5 μmol·L-1索拉非尼、HSA-SRF-NPs或FA-HSA-SRF-NPs的完全培養基,繼續培養24 h。消化細胞,1×PBS洗滌3次。加入預冷1×binding buffer重懸細胞500 μL,分別加入Annexin V-FITC和PI5 μL染色,室溫避光孵育5 min,混勻,上機,采用flowjo7.6版軟件進行凋亡分析,計算細胞凋亡比例。
1.4.7凋亡相關蛋白的表達 將HepG2細胞接種于6孔板,接種密度每孔5×105個,培養24 h,不加藥或分別加入13.5 μmol·L-1索拉非尼、HSA-SRF-NPs和FA-HSA-SRF-NPs,繼續培養24 h,棄去培養基,每孔加入預冷PBS洗滌3次,加入細胞裂解液,收集裂解細胞并超聲粉碎,離心取上清液,測定蛋白含量。將相當于蛋白含量40 μg的樣品上樣,60 V恒壓電泳后進行轉膜。采用5%脫脂奶粉封閉PVDF膜,置于一抗孵育液PARP(1:1000)和β-tubulin(1:1000)中4 ℃過夜,二抗(1:5000)孵育2 h。配置ECL發光底物,化學發光并于暗室中顯影、定影,檢測目標條帶。采用Image J軟件測量Cl-PARP的Western blotting圖中灰度值,將Cl-PARP灰度與β-tubulin相比進行歸一化,計算相對蛋白表達量。
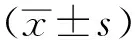
2 結果
2.1FA-HSA-SRF-NPs的表征 FA-HSA-SRF-NPs水合粒徑為(85.4±3.3) nm(圖1A),多分散系數(polydispersity index,PDI)為0.154;Zeta電位為(-22.47±0.90) mV(圖1B),絕對值較高,穩定性較好(圖1)。由圖1 C可知,FA-HSA-SRF-NPs呈球形,大小約100 nm。最終測得納米粒載藥量和包封率分別為(3.83±0.26)%和(91.09±6.14)%,葉酸偶聯量為(13.97±0.27) μg·mg HSA-1。
A.粒徑;B.Zeta電位;C.TEM圖像。
2.2細胞對納米材料的攝取 共聚焦顯微鏡下FITC、FITC-HSA和FITC-FA-HSA在HepG2細胞內蓄積情況見圖2。圖中藍色熒光為DAPI染色細胞核,綠色熒光為進入細胞質內FITC、FITC-HSA或FITC-FA-HSA。FITC僅可進入死細胞,活細胞內不會蓄積該熒光染料。由圖2可知,FITC組HepG2細胞中未見熒光,FITC-HSA組僅少量HepG2細胞中有綠色熒光,FITC-FA-HSA組HepG2細胞中綠色熒光顯著增加(F=419.555,P<0.05)。組間兩兩比較結果表明,FITC-FA-HSA組與其他兩組均差異有統計學意義(P<0.01),說明葉酸能促進白蛋白在HepG2細胞中的蓄積。
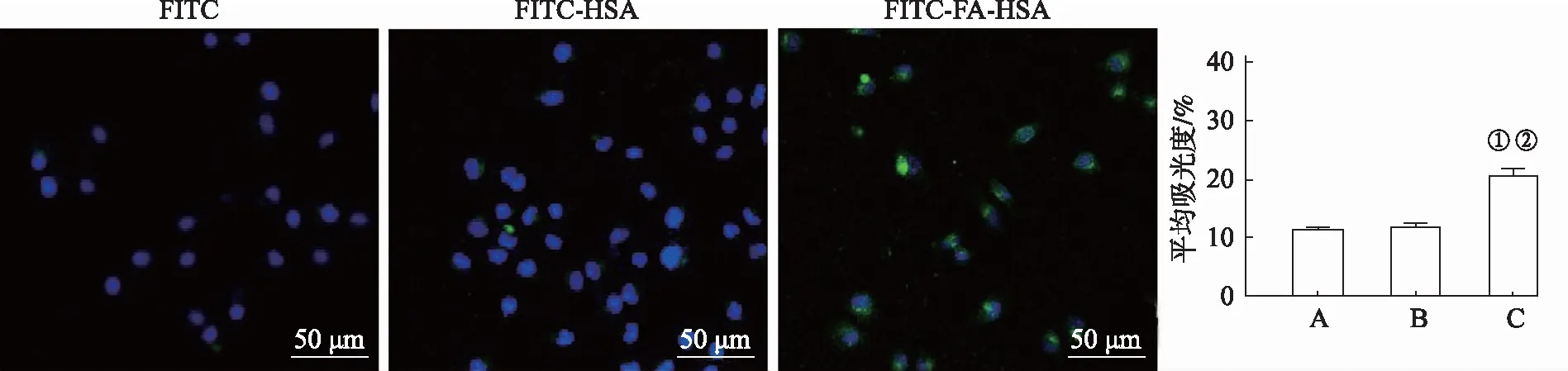
A.FITC組;B.FITC-HSA組;C.FITC-FA-HSA組;①與FITC組比較,P<0.01;②與FITC-HSA組比較,P<0.01。
2.3細胞對納米粒的攝取 HPLC法測定索拉非尼、HSA-SRF-NPs和FA-HSA-SRF-NPs 3組HepG2細胞內索拉非尼含量,結果見圖3。3組藥物細胞攝取量均隨時間延長而增加。加藥1 h后,3組之間攝取量差異無統計學意義;加藥2 h和3 h后,FA-HSA-SRF-NPs組HepG2細胞內索拉非尼含量顯著增加(F2 h=11.287,F3 h=25.916,P<0.05),組間兩兩比較結果表明,FA-HSA-SRF-NPs組與其他兩組間均差異有統計學意義(P<0.05和P<0.01),證明嫁接葉酸能提高HepG2細胞對FA-HSA-SRF-NPs的攝取。
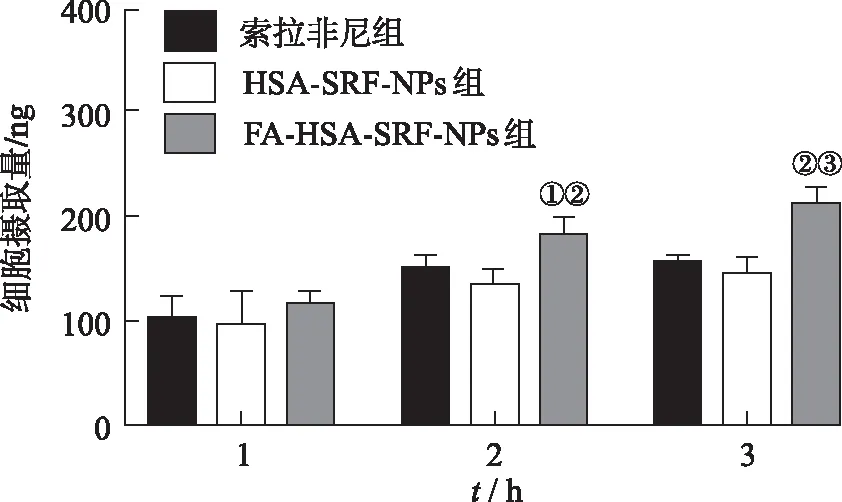
①與索拉非尼組比較,P<0.05;②與HSA-SRF-NPs組比較,P<0.01;③與索拉非尼組比較,P<0.01。
2.4細胞毒性實驗 不同濃度索拉非尼、HSA-SRF-NPs與FA-HSA-SRF-NPs對HepG2細胞存活率的影響見圖4。由圖4可知,索拉非尼組與HSA-SRF-NPs組細胞存活率差異無統計學意義,甚至加藥濃度為9 μmol·L-1時,HSA-SRF-NPs體外細胞毒性顯著低于索拉非尼(P<0.01)。隨著藥物濃度增加,FA-HSA-SRF-NPs組細胞存活率顯著降低(F6 μmol·L-1=7.463,F7.5 μmol·L-1=9.880,F9 μmol·L-1=26.531,P<0.05),組間兩兩比較結果表明,FA-HSA-SRF-NPs組細胞的存活率顯著低于其他兩組(P<0.05),說明葉酸修飾能增強索拉非尼的抗腫瘤活性。索拉非尼、HSA-SRF-NPs和FA-HSA-SRF-NPs對HepG2細胞IC50分別為6.83,8.09和5.78 μmol·L-1。
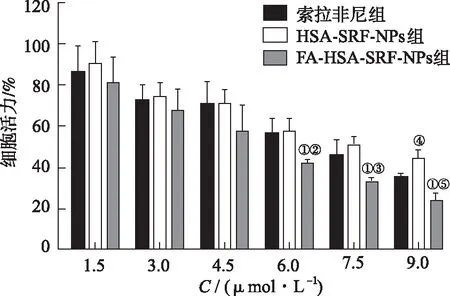
①與索拉非尼組比較,P<0.05;②與HSA-SRF-NPs組比較,P<0.05;③與HSA-SRF-NPs組比較,P<0.01;④與索拉非尼組比較,P<0.01;⑤與HSA-SRF-NPs組比較,P<0.01。
2.5細胞凋亡實驗 索拉非尼、HSA-SRF-NPs與FA-HSA-SRF-NPs對HepG2細胞凋亡的影響見圖5。由圖5可知,對照組、索拉非尼組、HSA-SRF-NPs組與FA-HSA-SRF-NPs組凋亡細胞率分別為6.5%,21.8%,16.4%和33.1%(包括早期凋亡細胞和晚期凋亡細胞)。FA-HSA-SRF-NPs對HepG2細胞具有顯著的促凋亡作用(F=24.727,P<0.05),組間兩兩比較結果表明,FA-HSA-SRF-NPs組凋亡細胞百分比顯著高于其他兩給藥組(P<0.01)。

A.不加藥物以及分別加入索拉非尼、HSA-SRF-NPs和FA-HSA-SRF-NPs培養24 h后各組細胞凋亡圖;B.3給藥組細胞凋亡百分比柱狀圖;a.索拉非尼組;b.HSA-SRF-NPs組;c.FA-HSA-SRF-NPs組。
2.6凋亡相關蛋白的表達 圖6為HepG2細胞未處理以及用索拉非尼、HSA-SRF-NPs和FA-HSA-SRF-NPs處理后,各組PARP/Cl-PARP的Western blotting圖和Cl-PARP相對表達量圖。由圖6可知,FA-HSA-SRF-NPs組Cl-PARP蛋白表達量顯著增加(F=796.876,P<0.05),Cl-PARP在各組間表達量均差異有統計學意義(P<0.01),表達量由高到低依次為:FA-HSA-SRF-NPs>索拉非尼>HSA-SRF-NPs>對照組。
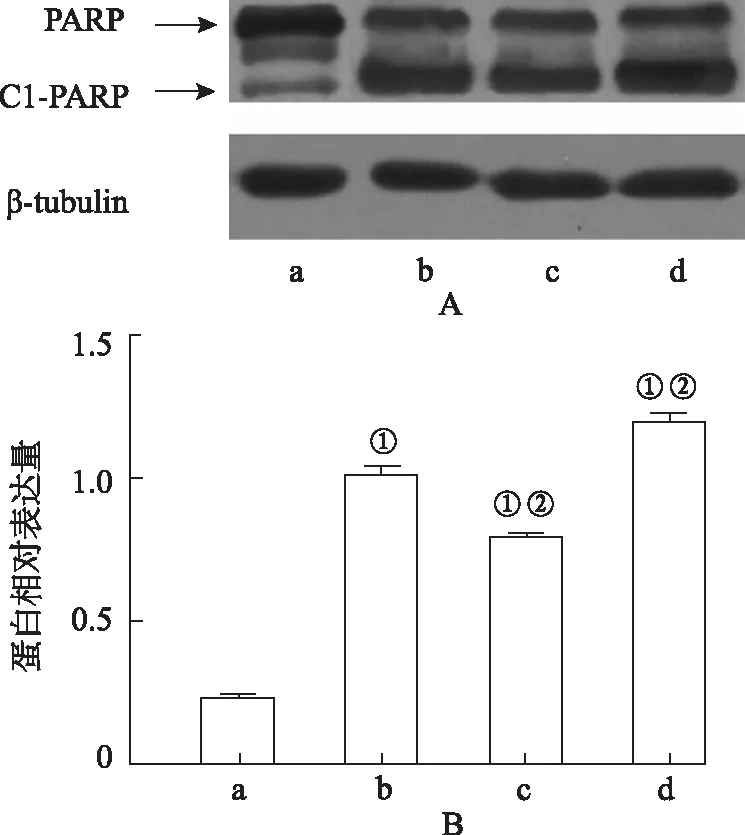
A.對照組;b.索拉非尼組;c.HSA-SRF-NPs組;d.FA-HSA-SRF-NPs組;①與對照組比較,P<0.01;②與索拉非尼組比較,P<0.01。
3 討論
筆者在本研究采用化學交聯法成功制備葉酸修飾的人血白蛋白索拉非尼納米粒。通常情況下,葉酸嫁接是通過FA-NHS與白蛋白納米粒表面的活性氨基反應,共價結合到納米粒表面。實際制備過程中發現,該反應的發生需要堿性條件,但溶液pH值升高會使索拉非尼從白蛋白納米粒中析出,導致制劑不穩定,降低索拉非尼載藥量和包封率,并且僅有少量葉酸嫁接到白蛋白表面,影響納米粒主動靶向能力。通過查閱文獻[8],筆者改變制備步驟:先在堿性條件下將葉酸嫁接到白蛋白上,再在pH值7的溶液中用FA-HSA包載索拉非尼。該方法制備的FA-HSA-SRF-NPs水合粒徑(85.4±3.3) nm,Zeta電位(-22.47±0.90) mV,穩定性較好;載藥量與包封率分別為(3.83±0.26)%和(91.09±6.14)%,包封率顯著高于同類研究[9];葉酸嫁接量達(13.97±0.27) μg·mgHSA-1,與目前文獻報道的嫁接量相近[10]。
細胞水平研究發現,FA-HSA-SRF-NPs在HepG2細胞中的攝取、細胞毒性和促凋亡能力均顯著優于索拉非尼。共聚焦顯微鏡觀察實驗中,FITC-HSA熒光密度與FITC相比差異無統計學意義。ZHANG等[11]制備聚合物共載索拉非尼和多柔比星納米粒,其表面用PEG修飾以增加親水性,發現其在HepG2細胞中的吞噬量與溶液劑相比差異無統計學意義。推測HepG2細胞可能對白蛋白親和力較弱,因此HSA-SRF-NPS并未增加索拉非尼進入HepG2細胞的量。然而,嫁接葉酸后無論是FITC-FA-HSA還是FA-HSA-SRF-NPs,進入HepG2細胞的量均顯著提高,抗腫瘤活性顯著增加,說明嫁接葉酸能促進HepG2細胞對白蛋白納米粒的攝取,這可能與葉酸受體介導的內吞作用有關:更多納米粒被轉運入HepG2細胞中,提高了抗腫瘤活性[12]。
然而,FA-HSA-SRF-NPs的抗腫瘤活性仍可進一步提高:FA-HSA-SRF-NPs粒徑小,表面又有很多活性基團,因此可在其表面繼續連接其他抗肝腫瘤藥物或肝腫瘤特異性配體等[13]。未來筆者也將繼續改進該納米制劑,同時在整體動物水平評價其抗腫瘤活性,為其向臨床轉化提供理論基礎。

