基于網絡藥理學研究逍遙散治療經前期綜合征的作用機制
曹一鳴 劉雁峰 王悅竹 史亞婷 宮瑋珩
(北京中醫藥大學東直門醫院,北京,100020)
經前期綜合征(Premenstrual Syndrome,PMS)是情志病研究領域的代表性病種,當今醫學界最為關注的問題。是指經前2周開始出現涉及身體(水腫、盆腔沉重墜脹感、頭暈、頭痛、乳脹)、情緒(煩躁易怒、悲傷欲哭、焦慮抑郁)和行為障礙(失眠、思想不集中)等多系統癥狀,一般在經前3~5 d最明顯,對生活和工作均會帶來一定的影響。患者常隨月經周期性出現相應癥狀,經期癥狀逐漸減輕后消失。青壯年發病率高,其中較嚴重者或可合并不孕[1]。其發病機制尚不明確,目前普遍接受的有社會和心理、卵巢激素、遺傳、中樞神經遞質和自主神經系統學說[2]。
目前現代醫學對PMS缺乏規范化的治療方法,主要是對癥治療、調控精神癥狀、抑制排卵治療等,雖大多能較快緩解癥狀,但也存在著一些局限性,如抑制排卵治療對身體危害較大、不良反應多;抗抑郁焦慮類藥物治療遠期療效不理想[3]。而中醫藥治療強調辨證論治,整體調節,在臨床上得到廣泛應用。
中醫認為PMS的癥狀較為復雜多樣,個體差異較大,與多個臟腑相關,其中與肝的關系最為密切,其證型最常見的則是肝失疏泄及肝氣郁滯。大部分醫家將PMS的病因責之于情志因素。本病的發生于肝、脾、腎三臟關系密切,其中又以肝最為密切[4]。王曉娟等[5]認為經前期臟腑功能失調導致了此類證候的發生,其中肝郁氣滯最為主要。對PMS中醫證型分布的臨床流行病學調查研究也提示其與肝的密切關系,鄭宸君[6]通過對502例PMS患者的流行病學調查發現其中醫證型主要為肝氣逆證、肝郁氣滯證、陰虛肝旺證、肝氣乘脾證、肝火上炎證。
逍遙散出自《太平惠民和劑局方》,具有疏肝養脾,養血調經之效,是治療PMS最為廣泛應用的方劑之一。方中柴胡疏肝解郁,為君藥;當歸養血調經,白芍柔肝養血,共為臣藥;白術、茯苓健脾祛濕,甘草和中健脾,共為佐藥;薄荷透肝經郁熱,生姜溫胃和中,共為使藥。臨床隨機對照試驗研究也驗證了逍遙散加減治療PMS的療效[7-11],其臨床總有效率為83.30%~98.00%。
因此,運用網絡藥理學的方法研究逍遙散治療PMS分子水平上的作用機制,可為應用逍遙散治療PMS提供理論支持[12]。
本研究應用網絡藥理學方法,探討逍遙散治療PMS的分子作用機制,以求為該法的臨床應用帶來更強的理論依據和新的思路。
1 資料與方法
1.1 逍遙散有效成分及潛在靶點獲取 應用中藥分子作用機制的生物信息學分析工具(Bioinformatics Analysis Tool for Molecular Mechanism of Traditional Chinese Medicine,BATMAN-TCM)和中藥系統藥理學數據庫與分析平臺(Traditional Chinese Medicine Systems Pharmacology and Analysis Platform,TCMSP)檢索并獲得逍遙散中所有活性成分數據,按口服生物利用度(Oral Bioavailability,OB)≥30%、類藥性(Drug Likeness,DL)≥0.18為條件篩選出有效活性成分。以此篩選出具有較高活性的化學成分,構建逍遙散的化學成分數據庫。合并2個平臺數據庫的成分預測靶點,從而得到逍遙散八味中藥有效化學成分-潛在靶點的數據集。
1.2 PMS靶點的獲取 在GeneCards和在線人類孟德爾遺傳數據庫(Online Mendelian Inheritance in Man,OMIM,http://www.omim.org)檢索疾病名稱“premenstrual syndrome”,從而得到PMS的相關靶點。
1.3 藥物活性成分-疾病靶點網絡圖 通過構建逍遙散-PMS靶標韋恩圖,得到藥物和疾病的共同靶點,并獲取映射信息。再用Cytoscape 3.7.2繪制網絡圖,用“節點”表示逍遙散,藥物活性成分、PMS和作用靶點,“邊”則表示節點與節點之間的關系。
1.4 藥物-疾病核心蛋白質-蛋白質相互作用(Protein-protein Interaction,PPI)網絡構建 登錄STRING平臺,“物種”選擇“人”,導入得到的靶點交集數據集,從而構建逍遙散治療PMS的PPI網絡。打開Cytoscape 3.7.2軟件,導入所得STRING數據庫文件,選擇“Network Analyze”,設定篩選標準:Degree值大于平均值,進行網絡拓撲分析并篩選出核心靶點。節點代表蛋白質,邊代表蛋白質與蛋白質之間的作用關系,網絡連接程度越高說明蛋白質之間關系越密切。將網絡圖以TSV格式導入Cytoscape,以“Degree≥5”為標準篩選核心蛋白基因。
1.5 基因本體(Gene Ontology,GO)富集分析和京都基因和基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析 打開DAVID平臺,導入篩選后的PPI網絡核心靶標,分別在網頁中選擇并獲取生物過程(Biological Process,BP),細胞組分(Cellular Component,CC),分子功能(Molecular Function,MF)以及KEGG通路分析。設定篩選標準為“P≤0.05”,從而篩選出符合條件KEGG通路及GO富集結果,分別以氣泡圖、表格的形式展示。
2 結果
2.1 逍遙散有效化學成分收集及潛在靶點預測 檢索TCMSP和BATMAN-TCM平臺數據庫得到逍遙散八味中藥的活性成分主要有槲皮素、豆甾醇、山柰酚、柚苷配基、谷固醇等,最終得到162種潛在核心化合物,預測出化合物對應靶點2 618個。
2.2 逍遙散治療PMS潛在作用靶點 共得到逍遙散治療PMS潛在作用靶點768個。
2.3 藥物活性成分-疾病靶點網絡圖 獲取逍遙散和PMS共同靶點21個。見圖1。圖2矩形表示方劑逍遙散,八邊形表示PMS,三角形表示疾病和有效成分的共同潛在作用靶點(以基因表示),橢圓形代表有效化學成分;共有節點36個,其中逍遙散、PMS各1個,有效成分105個,逍遙散治療PMS潛在靶點21個。拓撲結構分析發現,節點的自由度前5位的有效成分為槲皮素(23)、豆甾醇(13)、山柰酚(13)、柚苷配基(11)、谷固醇(10),這些成分與疾病的關系較大。

圖1 逍遙散-PMS潛在靶點韋恩圖

圖2 逍遙散成分-PMS-靶點調控網絡
2.4 藥物-疾病的核心靶點PPI網絡圖 PPI網絡圖3共有21個節點,48條邊,平均節點度4.57。篩選后共得到10個核心靶點的網絡,核心靶點包括IKBKB、IL-6、IGFBP3、PGR、IGF2、PLAU、HIF1A、VEGFA、ESR1、CASP8。見圖4。
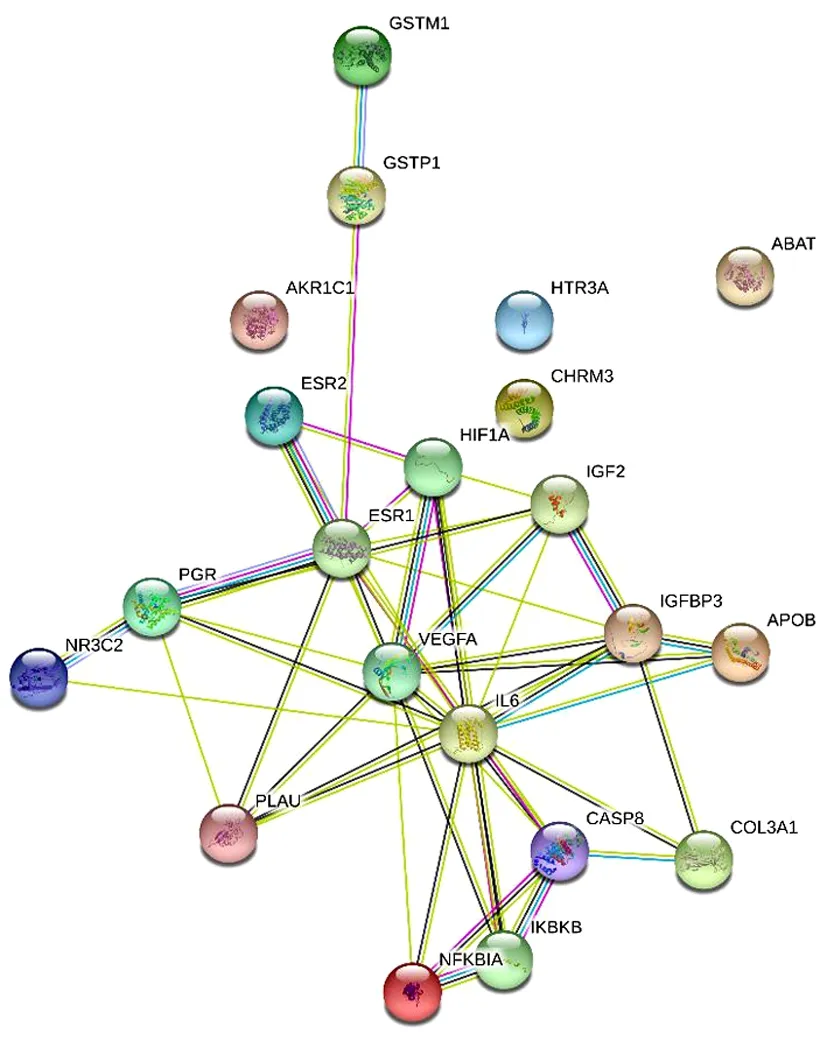
圖3 逍遙散治療PMS潛在靶標相互作用網絡

圖4 逍遙散治療PMS核心靶標相互作用網絡
2.5 GO功能富集結果分析 GO生物過程分析得到分子功能、生物過程和細胞組分條目共92個。最終篩選出分子功能19條、生物過程43條和細胞組分6條。將19條分子功能、6條細胞組分,和所得的43個生物過程條目按P值從小到大的順序排序取前20個條目,以氣泡圖的形式分別展示(圖5~7)。其中分子功能包括Steroid binding(類固醇結合)、Enzyme binding(酶結合)、Steroid hormone receptor activity(類固醇激素受體活性)、Protein binding(蛋白質結合)等;生物過程包括Signal transduction(信號轉導)、Transcription initiation from RNA polymerase Ⅱ promoter(RNA聚合酶Ⅱ的轉錄起始)、Negative regulation of IκB kinase/NF-κB signaling(IκB激酶/核因子κB信號的負調控)、Negative regulation of apoptotic process(凋亡過程的負調控)等;細胞組分包括Extracellular space(細胞外空間)、Extracellular region(細胞外區域)、Cytoplasm(細胞質)等。
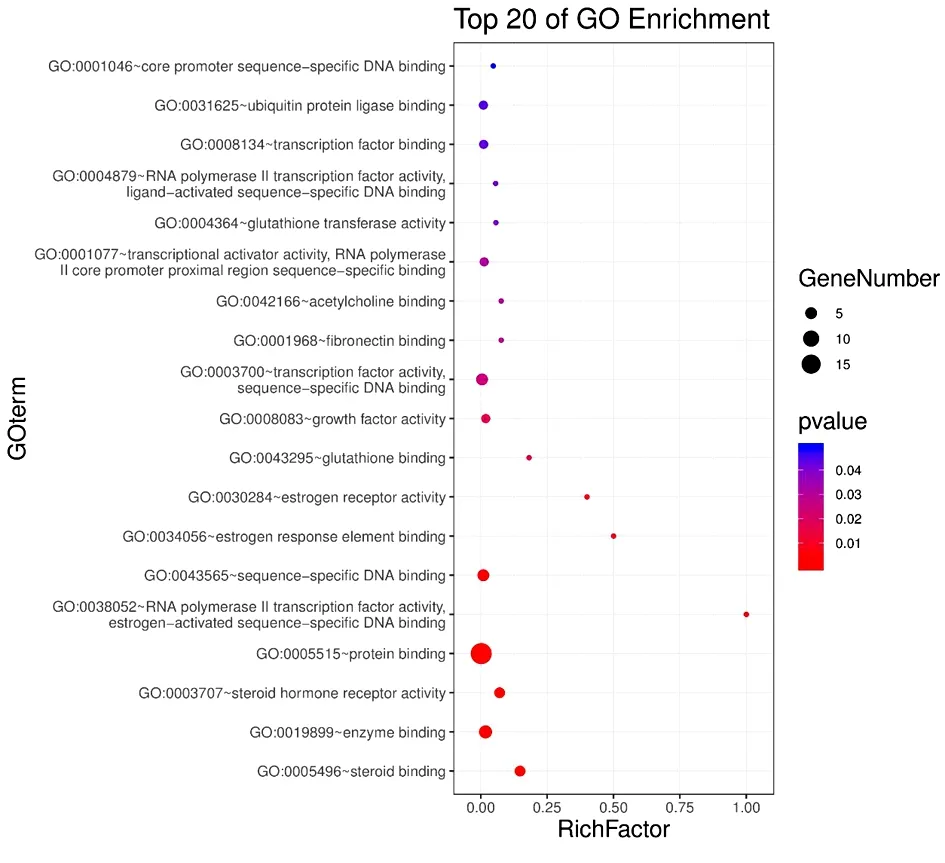
圖5 逍遙散治療PMS的分子功能分析

圖6 逍遙散治療PMS的生物過程分析

圖7 逍遙散治療PMS的細胞組分分析
2.6 KEGG通路富集分析 KEGG通路富集分析得到21條KEGG通路,最終篩選出信號通路17條。見表1。包括NOD樣受體信號通路、癌癥通路、癌癥中的蛋白多糖、查加斯病(美國錐蟲病)、Toll樣受體信號通路、腫瘤壞死因子信號通路等,逍遙散治療PMS可能通過以上通路產生療效。

表1 KEGG富集分析
3 討論
中醫古典醫籍中并不曾記載過PMS這一病名,但將其不同的癥狀分別論述于“月經前后諸證”中。PMS是一種以情感、行為和身體障礙為特征的綜合征,隨月經周期反復出現,其癥狀常于黃體后期出現,月經期逐漸減輕至消失[13]。中醫認為“女子以肝為先天”,PMS的發生與肝的關系最為密切,喬明琦等[14]的流行病學調查顯示PMS中肝氣逆、肝氣郁二證分別占58.9%和27.5%。大部分醫家均認為從肝論治PMS可取得較好療效。
本文運用網絡藥理學的方法,系統分析經典方劑逍遙散治療PMS的機制。首先把檢索獲取到的逍遙散有效成分和PMS潛在靶點信息取交集,從而描繪“藥物-成分-疾病”PPI網絡圖。進一步通過GO和KEGG的富集分析,得到藥物潛在重要靶點干預的疾病通路和基本生物學通路,以期揭示逍遙散治療PMS的分子層次原理,從而對中醫臨床應用,辨證用藥提供強有力的依據。
3.1 活性成分 通過檢索TCMSP和BATMAN-TCM平臺數據庫得到逍遙散八味中藥的活性成分主要有槲皮素、豆甾醇、山柰酚、柚苷配基、谷固醇等,這些活性成分可能與治療PMS有關。
Yarjanli等[15]發現槲皮素藥理作用廣泛,包括抗炎、抗焦慮和認知增強等。王佳等[16]發現山柰酚對大鼠具有顯著抗抑郁作用,其原理可能通過提高前額葉皮質部位去甲腎上腺素(Norepinephrine,NE)、多巴胺(Dopamine,DA)和5-羥色胺(5-hydroxytryptamine,5-HT)遞質水平達到抗抑郁作用。Tayyab等[17]發現柚苷配基除了抗抑郁作用外,還可抑制抑郁大鼠行為異常,緩解認知障礙,緩解海馬CA1區和皮質的形態異常。另外槲皮素和山柰酚均屬于異黃酮類,其結構類似己烯雌酚以及雌二醇,是一種弱雌激素樣物質,在體內起雌性激素樣和抗雌性激素樣的雙重調節作用[18],或可通過對雌激素的調節,降低醛固酮血管緊張素Ⅱ,改善水鈉潴留導致的水腫、體質量增加等癥狀[19]。由此可見,逍遙散中諸多活性成分具有明確的抗抑郁、抗焦慮、對雌激素的雙向調節作用,提示逍遙散對PMS情感、行為、軀體障礙均有潛在的治療作用。
3.2 靶點 通過“藥物-疾病”網絡圖可以發現雌激素受體(Estrogen Receptor,ESR)1、ESR2、孕酮受體(Progesterone Receptor,PGR)、毒蕈堿型乙酰膽堿受體M3(Muscarinic Acetylcholine ReceptorM3,CHRM3)、鹽皮質激素受體基因(Mineralocorticoid Receptor Gene,NR3C2)、谷胱甘肽轉移酶(Glutathione Transferase P1,GSTP1)、胱天蛋白酶8(CASP8)等是藥物治療疾病的關鍵靶點。
研究發現,采用促性腺激素釋放激素激動劑抑制卵巢功能使PMS癥狀得到控制后,加用外源性雌、孕激素反相添加,PMS癥狀有不同程度的重現,可見黃體后期雌、孕激素的異常對PMS的發生有一定程度的作用[20-21]。李學智[22]研究發現PMS獼猴和大鼠下丘腦ESR1和ESR2mRNA的表達水平、ESR2蛋白都有不同程度的下調;孕酮受體(Progesterone Rceptor,PGR)mRNA有所上調。于艷紅等[23]研究發現PMS獼猴邊緣系統中,ESR1和ESR2 mRNA表達降低,PGR mRNA表達升高。提示逍遙散可能通過激素調節的方式治療PMS。核受體亞家族3組C分子2(Nuclear Receptor Subfamily 3,Group C,Member 2,Nr3c2,一種鹽皮質激素受體)是公認的焦慮抑郁相關基因[24],張利蕊[25]研究發現NR3C2中多個位點可能與暴力攻擊行為有關聯。Lombardi等[26]研究發現PMS患者腎上腺皮質對促腎上腺皮質激素的釋放反應高于非PMS患者。Cornelisse等[27]發現,NR3C2有決定下丘腦-垂體-腎上腺軸(Hypothalamic-pituitary-adrenal Axis,HPA)活化閾值的作用。提示逍遙散可能通過調節HPA的方式治療PMS。
3.3 富集結果分析 GO功能富集結果顯示分子功能包括類固醇結合、酶結合、類固醇激素受體活性、蛋白質結合等,涉及的生物過程包括信號轉導、凋亡過程的負調控、IκB激酶/核因子κB信號的負調控、RNA聚合酶Ⅱ的轉錄起始等。KEGG通路分析顯示逍遙散活性成分及靶點通過以上表格中多通路作用于PMS。
目前,人體內共發現10種Toll樣受體(Toll-like Receptor,TLR)TLR1~TLR10[28],其中TLR4與抑郁的發生關系最為密切[29],在神經元的形成、5-HT生成、HPA的平衡、抗抑郁藥物恢復神經功能等過程中都扮演重要角色[30]。Pandey等[31]通過對死亡抑郁癥患者的尸檢發現,其中背外側前額葉皮質TLR3和TLR4的mRNA水平增加。激活的TLR4可激活β干擾素Toll/白細胞介素1受體結構域銜接蛋白信號轉導通路,最終活化下游核因子κB信號通路,核因子κB進入核內調節炎癥介質的基因表達和轉錄,進而引起各種神經病理改變[32-33]。長期服用PMS的一線藥物氟西汀能夠明顯地降低TLR4基因的表達[34]。提示逍遙散可能通過抗抑郁,調節神經遞質來治療PMS。
綜上所述,應用網絡藥理學的方法,系統分析并總結了逍遙散中主要有效成分、潛在的作用靶點及通路,揭示了逍遙散治療PMS分子機制。但仍有一定的局限性,如能進一步通過實驗驗證本文中所述靶點通路的有效性,則能為臨床提供更加有力的依據。

