非酒精性脂肪性肝病患者血清胱抑素C、脂蛋白α和nesfatin-1水平變化及其臨床意義探討*
樊 葉,張喜梅,張 巖
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是指除酒精和其他明確的肝損因素所致,肝組織內出現脂質沉積超過肝臟質量5%或以上,顯微鏡下顯示彌漫性肝細胞脂肪變的一種臨床病理綜合征[1,2]。肝活檢屬侵入性有創操作,推廣應用存在一定的困難,因此尋找一種簡單且無創的疾病識別方法并對病情進展實施監控是十分必要的[3]。胱抑素C(cystatin C,CysC)是一種半胱氨酸蛋白酶細胞外抑制劑,與高血壓、胰島素抵抗、肥胖等疾病有關,可反映機體的炎癥反應狀態[4]。NAFLD患者肝臟合成和代謝功能均出現異常。脂蛋白α(lipoprotein α,Lp-α)在脂蛋白代謝過程中參與脂類運輸過程,發揮脂蛋白及其受體的結合引導和酶活性調節等作用[5]。人新飽食分子蛋白1( nesfatin-1) 是新發現的可抑制食欲的生物大分子,在維持能量穩態和正常糖代謝過程中具有重要的生理作用,參與胰島素抵抗、肥胖、糖尿病等代謝性疾病的發病過程[6]。本研究檢測了NAFLD患者血清CysC、Lp-α和nesfatin-1水平變化,分析了運用它們評估疾病嚴重程度的價值,現報道如下。
1 資料與方法
1.1 一般資料 2019年7月~2021年11月我院診治的NAFLD患者119例,男性68例,女性51例;年齡為30~64歲,平均年齡為(37.5±9.8)歲。符合《非酒精性脂肪性肝病防治指南》[7]的診斷標準。排除標準:酒精性或病毒性肝炎、藥物性肝損傷、自身免疫性肝病;存在全身感染性疾病或惡性腫瘤;存在嚴重的臟器功能損害;近期有創傷或手術等;近1個月內服用過非甾體類抗炎藥或質子泵抑制劑等;孕期或哺乳期婦女。另選擇同期經性別和年齡匹配的健康體檢者65例作為對照組,其中男性37例,女性28例;年齡為30~65歲,平均年齡為(38.2±8.4)歲。本研究經我院醫學倫理委員會審核、通過。
1.2 NAFLD嚴重程度評估 參照《非酒精性脂肪性肝病診療指南》[8]中超聲診斷分度標準,將NAFLD分為輕、中、重度。①肝區近場彌漫性增強回聲,且較腎和脾強,遠場回聲則呈現衰減形式;②肝內管道呈現不清晰;③肝臟呈現輕或中度腫大且邊緣較為圓鈍;④肝內血管走向正常,但血流信號減少;⑤肝右葉包膜、橫膈回聲均不完整或是不清晰。輕度:具①和②~④中任意一項者;中度:具①和②~④中任意兩項;重度:具①和②~④中任意兩項再加上第⑤項。
1.3 血清指標檢測 采用ELISA法檢測血清CysC、Lp-α和nesfatin-1(武漢優爾生生物工程有限公司);使用羅氏Modular全自動生化分析儀檢測血生化指標和空腹血糖(Fasting plasma glucose,FPG)水平(寧波美康生物科技公司)。
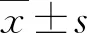
2 結果
2.1 兩組血糖和血脂水平比較 NAFLD患者FPG、TG和LDL-C水平顯著高于對照組(P<0.05,表1)。

表1 兩組血糖和血脂水平比較
2.2 兩組血清CysC、Lp-α和nesfatin-1水平比較 NAFLD患者血清CysC水平顯著高于對照組,而血清Lp-α和nesfatin-1水平顯著低于對照組(P<0.05,表2)。

表2 兩組血清CysC、Lp-α和nesfatin-1水平比較
2.3 輕、中、重度NAFLD患者血清CysC、Lp-α和nesfatin-1水平比較 重度NAFLD患者血清CysC水平顯著高于中度或輕度患者,而血清Lp-α和nesfatin-1水平顯著低于中度或輕度患者(P<0.05,表3)。

表3 不同脂肪變程度的NAFLD患者血清CysC、Lp-α和nesfatin-1水平比較
2.4 影響NAFLD嚴重程度的多因素Logistic回歸分析 經Logistic回歸分析結果顯示,血清CysC、FPG、TG和LDL-C高水平或血清Lp-α和nesfatin-1低水平是影響NAFLD嚴重程度的獨立危險因素(P<0.05,表4)。

表4 影響NAFLD嚴重程度的Logistic回歸分析
2.5 應用血清CysC、Lp-α和nesfatin-1評估重度NAFLD的效能 聯合應用血清CysC、Lp-α和nesfatin-1水平評估重度NAFLD發生的曲線下面積(AUC)顯著高于三項指標單獨評估(P<0.05),其效能較高(表5、圖1)。

表5 應用血清CysC、Lp-α和nesfatin-1評估重度NAFLD的效能

圖1 血清CysC、Lp-α和nesfatin-1評估重度NAFLD的效能
3 討論
NAFLD主要發生機制在于胰島素抵抗和系統性炎癥反應。隨著現階段肥胖和糖尿病等疾病發生率呈現逐年升高的趨勢,NAFLD發生率也隨之升高[9]。近年來,相關研究數據顯示[10],普通成人NAFLD患病率達 20%~33%,在發達國家,NAFLD業已成為肝功能異常和慢性肝病發生的首要原因之一。
CysC經有核細胞恒定速率生成,在正常情況下分泌和排泄速率基本保持恒定,而受年齡、性別、飲食等因素的影響較小,與慢性肝臟炎癥性疾病等關系密切,且隨著病程進展,血清CysC水平呈現升高趨勢。因此,CysC作為一種標志物可在一定程度上用于臨床對肝臟功能的監測[11,12]。既往研究[13]比較了脂肪性肝炎、單純性脂肪肝和健康人群血清CysC水平差異,結果顯示,脂肪性肝炎和單純性脂肪肝患者血清CysC水平顯著升高,且隨著病情加重,血清CysC水平進一步升高。本研究也顯示NAFLD患者血清CysC水平升高。一方面,隨著血清Cys C水平變化,影響機體胰島功能,促進糖尿病發生發展進程;另一方面,Cys C可能通過氧化應激方式直接影響肝臟代謝,多種細胞成分均發生變化,包括DNA、脂質、蛋白質等,這些均與 NAFLD病理學改變相關。按超聲診斷分度標準,將NAFLD患者分為輕、中、重度,結果隨疾病嚴重程度增加,血清Cys C水平也隨之升高。Cys C可在人體網膜組織、皮下脂肪組織表達,誘發脂肪相關性疾病的發生,進而對肝臟代謝產生影響,參與肝臟病理學改變過程,影響慢性肝病的發展[14]。
Lp-α是一種球形脂蛋白顆粒,中性脂質部分富含膽固醇,具疏水性,外周包繞Apo B100和Apo (a),構成復合物[15]。Lp-α特征性成分apo(a)由肝細胞合成,在內質網和高爾基體中加工成熟后,分泌到細胞外。在血循環中,與LDL顆粒組成完整的Lp-α分子[16]。本研究NAFLD患者血清Lp-α水平顯著低于對照組。Lp-α主要合成場所在肝臟,因此肝臟疾病發生時,肝細胞受到損害,Lp-α合成減少,血清Lp-α水平相應降低。相關研究顯示[17],中重度慢性肝炎患者血清Lp-α水平顯著低于輕度慢性肝炎患者。隨著肝損傷程度加重,Lp-α合成受損,血清Lp-α水平持續降低。本研究比較了輕度、中度、重度NAFLD患者血清Lp-α水平差異,結果顯示隨著NAFLD患者病情加重,血清Lp-α水平也隨之降低,與上述研究結果一致,表明Lp-α參與脂質代謝和蛋白質代謝,是NAFLD患者肝功能損傷的敏感指標和早期生物標志物,臨床上可通過檢測血清Lp-α水平變化評估NAFLD的嚴重程度。
nesfatin-1于外周脂肪組織、胰腺、心肌、胃、小腸、睪丸等部位廣泛分布,在糖脂代謝、能量穩態等能量代謝過程中發揮重要的作用[18]。既往研究[19]通過對糖尿病肥胖患者應用艾塞那肽8周,發現患者血清nesfatin-1水平明顯升高。同時,患者肝臟脂肪含量顯著下降。本研究NAFLD患者血清nesfatin-1水平顯著低于對照組,nesfatin-1水平下降是嚴重NAFLD發生的獨立危險因素。隨著疾病進展,血清nesfatin-1水平進一步降低。糖代謝紊亂帶來的初次打擊和肝細胞脂肪變性后氧化應激帶來的二次打擊是NAFLD發病的分子機制。NAFLD患者血清nesfatin-1水平下降致使體內能量平衡出現紊亂,進一步促進NAFLD的發生和發展[20]。本研究經ROC曲線分析血清CysC、Lp-α和nesfatin-1三者聯合檢測評估重度NAFLD方面的價值,結果顯示其AUC為0.887,具有較高的評估效能。血清CysC、Lp-α和nesfatin-1水平與NAFLD有密切的關系,或為NAFLD的發病機制和治療研究提供了一個新的思路和靶點。
綜上所述,NAFLD患者血清CysC水平升高,而血清Lp-α和nesfatin-1水平降低。隨著疾病嚴重程度的加重,血清CysC水平呈升高趨勢,而Lp-α和nesfatin-1水平下降更明顯,檢測這些指標的變化可能有助于評估患者病情。

