經頸靜脈肝內門體分流術聯合胃冠狀靜脈栓塞術治療乙型肝炎肝硬化并發食管胃靜脈曲張患者效果分析*
孫 靜,張偉偉,馬智勇,代樹本,鄧彥東
肝硬化是以肝組織彌漫性纖維化、再生結節和假小葉形成為主要特征的慢性肝病,常由一種或多種病因長期或反復作用形成的進行性、彌漫性肝損害。臨床主要表現為肝功能減退和門脈高壓癥,并隨病情進展出現多種并發癥[1,2]。門靜脈海綿樣變(cavernous transformation of the portal vein, CTPV)是肝硬化的重要并發癥之一,是由肝硬化引起門靜脈回流入肝血流受阻,使腸系膜上靜脈、腸系膜下靜脈和脾靜脈血流代償性匯流入門靜脈,使門靜脈管徑逐漸增大,出現CTPV[3,4]。肝硬化并發CTPV患者常出現食管胃底靜脈曲張(EV)加重,嚴重時可造成曲張靜脈破裂引起上消化道大出血。如不及時治療,可導致死亡[5]。目前,臨床多采用手術方法治療肝硬化并發CTPV患者,常見的手術方法包括經頸靜脈肝內門體分流術(transjugular intrahepatic portosystemic stent, TIPS)、脾靜脈栓塞術、內鏡下食管靜脈曲張套扎術(endoscopic esophageal varices ligation, EVL)和胃冠狀靜脈栓塞術(gastric coronary vein embolization, GCVE)等,其中TIPS聯合EVL可在降低門靜脈壓力的基礎上有效套扎曲張靜脈,達到防治食管靜脈曲張破裂出血(EVB)的目的,但單獨治療1~2次效果并不理想,需多次套扎才能取得長期的療效[6,7]。GCVE是常見的治療胃底靜脈曲張的外科介入治療手術,具有見效快、創傷小、安全性好的優勢,與TIPS聯合應用,兼具分流降低門靜脈壓力和栓塞曲張靜脈的優勢,降低了上消化道出血患者再出血的風險[8]。本研究采用TIPS聯合GCVE或TIPS聯合EVL治療肝硬化并發EV患者,觀察了臨床療效,現報道如下。
1 資料與方法
1.1 病例來源 2018年1月~2020年12月我院收治的乙型肝炎肝硬化并發EV患者62例,男47例,女15例;年齡為35~60歲,平均年齡為(45.9±3.7)歲。符合肝硬化診治指南的標準[9]。排除標準:并發嚴重的凝血功能障礙、多器官功能衰竭、門靜脈廣泛血栓、全身各器官組織急慢性感染、惡性腫瘤或存在心理和精神性疾病。將患者分為A組和B組,分別接受TIPS聯合GCVE治療33例和接受TIPS聯合EVL治療29例,兩組性別、年齡和病情等一般資料比較,差異無統計學意義(P>0.05),具有可比性。本研究經我院醫學倫理委員會審核,患者及其家屬簽署知情同意書。
1.2 手術方法 TIPS操作方法:患者取仰臥位,局部麻醉,穿刺右側頸內靜脈,使穿刺針與皮膚表面呈20~30°角,將單彎管帶導絲的10F長鞘送至下腔靜脈,再將美國COOK公司提供的RUPS-100穿刺系統引入門靜脈,使用德國西門子AXIOM Artis型數字減影血管造影機進行門靜脈造影,記錄門靜脈壓力和靜脈曲張程度。門靜脈造影見粗大的胃冠狀靜脈,交換加硬導絲后導入球囊擴張穿刺通路,擴張門靜脈與肝靜脈間的肝實質。置入直徑8 mm的金屬裸支架,于金屬裸支架內肝實質段置入8 mm覆膜支架,再次測定門靜脈壓并行靜脈造影,確定分流道通暢,完成手術;GCVE操作方法:經肝穿刺將導管插入門靜脈,使用導絲將美國COOK公司生產的直徑3~12 mm的彈簧圈3~18枚推送至胃冠狀靜脈血管進行栓塞,將門靜脈造影可見的曲張靜脈栓塞至遠端,直至無造影劑通過;EVL治療方法:患者術前15 min口服西甲硅油15 mL,以消除胃內粘液及其泡沫,行胃鏡檢查評估靜脈曲張程度。安裝六聯發套扎器,從食管胃結合部開始套扎,用套圈套住曲張靜脈基底部后緩慢停止負壓吸引,繼續間隔3~5 cm采用螺旋狀套扎其他的曲張靜脈,直至所有曲張靜脈被結扎。間隔4 w進行一次EVL,直到曲張靜脈完全消失。術后,臥床休息24 h,持續心電監護,強化護肝治療。隨訪12 m。
1.3 檢測與檢查 使用德國Siemens公司生產的ADVIA2400型全自動生化分析儀檢測血生化指標;使用超聲檢測肝內支架血流速度,記錄門靜脈血流速度(portal vein blood flow velocity,PVFV)、門靜脈壓力(portal venous pressure, PVP)和門靜脈壓力梯度(portal vein pressure gradient,PPG)。
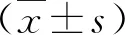
2 結果
2.1 兩組PVP和PPG比較 兩組手術均獲得成功。在術后1個月,TIPS聯合GCVE組PVFV顯著快于TIPS聯合EVL組,而PVP和PPG顯著低于TIPS聯合EVL組,差異有統計學意義(P<0.05,圖1、表1)。

表1 兩組PVP和比較

圖1 肝硬化并發CTPV患者腹部超聲檢查表現
2.2 兩組肝功能指標比較在術前和術后1個月,兩組肝功能指標比較,差異無統計學意義(P>0.05,表2)。

表2 兩組肝功能指標比較
2.3 兩組分流道功能和分流效果比較 在術后12個月,A組食管胃曲張靜脈再出血率發生率顯著低于B組,差異有統計學意義(P<0.05,表3)。

表3 兩組分流道功能和分流效果(%)比較
2.4 兩組生存分析 在治療12個月,TIPS聯合GCVE組患者死亡5例(15.1%),而TIPS聯合EVL組死亡12例(41.3%,P<0.05,圖2);A組死亡原因為上消化道出血2例,肝性腦病1例,肺部感染1例,肝腎綜合征1例,而B組為上消化道出血7例,肝性腦病2例,肺部感染2例,肝腎綜合征1例。

圖2 兩組Kaplan-Meier生存曲線
3 討論
肝硬化并發EV患者存在門靜脈高壓,有發生靜脈曲張破裂出血(EVB)的風險,需采取有效的方法進行積極的治療[[10-13]。臨床多采用EVL等內鏡手術治療肝硬化并發EV患者,但需多次反復操作,限制了其臨床應用。TIPS是限制性門體分流術,可在肝實質中建立肝靜脈與門靜脈間的人工分流通道,達到降低門靜脈壓力,控制EVB的風險,但單純TIPS對再出血的預防作用較為有限[14]。在TIPS基礎上聯合GCVE治療可降低門靜脈壓,有助于減少新的側枝血管的形成,降低再出血發生率。本研究主要分析了采用TIPS聯合GCVE治療肝硬化并發EV患者的臨床療效,為臨床治療提供經驗參考。
本研究結果顯示,術后1個月TIPS聯合GCVE組門靜脈血流速度顯著快于TIPS聯合EVL組,而PVP和PPG顯著低于TIPS聯合EVL組,說明TIPS聯合GCVE可有效改善肝硬化并發EV患者門靜脈血流速度。PVP和PPG是目前測量門靜脈壓力的可靠指標。PVP升高主要與門靜脈回流受阻有關。肝硬化并發EV患者門靜脈高壓可使肝臟血流量顯著減少,血流速度減慢,甚至出現血流瘀滯和血管內形成渦流,引起門靜脈血栓,導致肝外門靜脈阻塞,表現為PVP和PPG升高[15]。TIPS是一種通過在肝靜脈與門靜脈間植入支架、建立分流道達到降低門靜脈壓力的微創干預措施,是預防EVB最有效的方法[16,17]。GCVE可通過栓塞胃左靜脈達到控制食管胃底曲張靜脈破裂出血的作用,兩種方法聯合應用于治療肝硬化并發EV患者,既可減少病理性分流,也可起到斷流止血的作用,有利于降低門靜脈壓力,快速控制EVB[18,19]。本研究采用TIPS聯合GCVE治療肝硬化并發EV患者術后1個月血清TBIL、INR和ALT水平TIPS術后入肝血流量減少和在穿刺過程中對肝組織的擠壓是導致肝功能受損的原因,但研究術后一個月,兩組肝功能指標穩定。
本研究結果顯示,在采用TIPS聯合GCVE治療肝硬化并發EV患者術后12個月,食管胃曲張靜脈再出血率和肝性腦病發生率顯著低于TIPS聯合EVL治療組,兩組分流道通暢率類似。TIPS聯合GCVE治療在降低門脈高壓的同時,直接栓塞出血血管,減輕靜脈曲張程度,使分流道血流增加,造成分流道狹窄和閉塞的風險下降,起到協同互補的作用,從而降低再出血發生率[20]。 TIPS術后發生肝性腦病的風險與術后入肝有效灌注減少和氨代謝受到影響有關。TIPS聯合 GCVE治療可有效增加入肝血流量,使肝性腦病發生率下降。失代償期肝硬化患者門靜脈高壓和食管胃底靜脈曲張是一個長期的漸進發展的過程。分流手術后曲張靜脈的病理學改變仍持續存在,因此單純行TIPS術對預防再出血的效果并不理想。EVL可在降低門靜脈壓力的基礎上有效套扎曲張靜脈,達到預防出血的作用,但常需多次套扎才可達到較為理想的預防再出血的目的。TIPS聯合GCVE手術可降低門靜脈壓力,具有分流、斷流互補的作用,大幅度降低了再出血發生率和保持分流道通暢率。失代償期肝硬化患者肝性腦病的發生機制與TIPS分流后源于腸道的毒性代謝產物在肝臟清除不徹底、不及時有關,未徹底及時清除的代謝產物可直接進入體循環并穿過血腦屏障,引起肝性腦病,嚴重時危及患者生命。采用TIPS聯合GCVE手術具有良好的分流、斷流作用,可通過顯著降低門靜脈壓力達到清除體循環代謝毒物的作用,使再出血率和肝性腦病發生率下降,也可使患者的生存率得到有效提高。本研究以兩組肝硬化并發EV患者12個月生存資料建立Kaplan-Meier生存模型,并進行Log-rank檢驗,結果顯示,經TIPS聯合GCVE治療組12個月生存率顯著高于TIPS聯合EVL治療組,差異具有統計學意義,提示采用TIPS聯合GCVE手術可改善失代償期肝硬化患者生存率。

