草甘膦對苦草種子萌發及幼苗生長的影響
沈路遙,張世懿,彭自然,張馨予,何文輝
上海海洋大學海洋生態與環境學院,上海 201306
草甘膦是一種內吸傳導型廣譜滅生性有機磷類除草劑,在農業生產及市政養護中應用較廣。田間果園殺滅雜草時,每公頃用10%草甘膦水劑7.5~22.5 kg,兌水300~450 kg。河道清障(如清除水葫蘆及蘆葦)時,每公頃用10%草甘膦水劑15 kg兌水1 125 kg[1]或10%草甘膦水劑45 kg兌水600 kg[2]。經配制,施藥時藥液中草甘膦的濃度約為1.3~7.5 g·L-1。草甘膦等農藥可通過地表徑流、噴霧漂移等方式進入地表水。在我國云南哈尼梯田稻魚共作系統中,水體草甘膦殘留濃度為6.55~153.82 μg·L-1,檢出率為100%[3]。江蘇省太湖水域草甘膦最大殘留濃度為19.097 μg·L-1,檢出率為22.2%[4]。浙江省飲用水源中草甘膦最大殘留濃度為5.930 μg·L-1,檢出率為27.6%[5]。草甘膦在農業及非農業區域的廣泛使用對水生生態系統存在潛在風險。研究發現,草甘膦可影響浮游動物卵庫孵化[6]、改變大型溞的行為[7]、增加日本青鳉魚魚苗的發育異常率[8]。此外,草甘膦可降低浮萍(Lemnaminor)生長速率,抑制葉綠素a、葉綠素b和類胡蘿卜素的合成[9],減少槐葉蘋(Salviniacucullata)過氧化氫酶活性及根系活力[10],對藻類生長存在毒物興奮效應[11]等。
目前,草甘膦水生生物毒性的研究對象主要為魚類、溞類和藻類等,草甘膦沉水植物毒性方面的研究較少[12]。沉水植物是水生態系統的初級生產者,在維持湖泊清水穩態和改善養殖池塘水質中具有重要作用,已被越來越多地應用于水域生態修復、園林造景和水產養殖等方面。池塘、溝渠和湖泊沿岸等“淺水系統”是沉水植物的主要生境,也是較易受到農藥污染的區域。為了解草甘膦除草劑對沉水植物的毒性效應,以常見沉水植物苦草為受試對象,研究了草甘膦對苦草種子萌發及幼苗生長的影響。
1 材料與方法(Materials and methods)
1.1 試驗材料
供試苦草種子(純度≥98%)購自湖北鑫大葉牧草種業有限公司,試驗用草甘膦(純度≥95%)購自南京杜萊生物技術有限公司。主要儀器:上海尤尼柯4802 UV/VIS紫外可見分光光度計,廣東珠江牌LRH-300G光照培養箱,上海安亭飛鴿LXJ-IIB離心機,寧波新芝S10型手提式高速勻漿機等。
1.2 試驗設計
按幾何級差設置7個草甘膦處理組(0.05、0.20、0.80、3.20、12.80、51.20和204.80 mg·L-1)及1個對照組,每組設3個平行。篩選大小一致,顆粒飽滿的苦草種子,用蒸餾水蕩洗數次,在塑料組培瓶中加入500 mL由10%(V∶V)霍格蘭營養液配制的草甘膦溶液,每組放置種子100粒,于恒溫光照培養箱(光照周期L∶D=12 h∶12 h、溫度20 ℃)中培養21 d。以種子在組培瓶中培養24 h記為第1天,前14 d每日固定時間以胚根露白為準記錄發芽數,第21天記錄幼苗成活數及幼苗形態特征,對幼苗根長、葉長、鮮質量、可溶性蛋白質含量、總超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、過氧化物酶(POD)活性、丙二醛(MDA)含量和葉綠體色素含量進行測定。
1.3 測定方法
發芽率=發芽種子數/供試種子總數×100%;成活率=幼苗成活數/發芽種子數×100%;抑制率=(對照值-處理值)/對照值×100%。草甘膦對苦草幼苗根長、葉長、鮮質量的半數抑制濃度由線性刻度坐標,以抑制率為縱坐標,草甘膦濃度為橫坐標,采用直線內插法[13]計算。
苦草幼苗抗氧化酶(SOD、CAT、POD)活性和MDA含量的測定參考林靜雯等[14]的方法,采用95%乙醇浸提法[15]測定幼苗葉片葉綠體色素含量,考馬斯亮藍G-250染色法[16]測定幼苗可溶性蛋白質含量。
1.4 數據處理
試驗數據以平均值±標準差表示,采用Microsoft Excel 2016和Origin 2019b進行數據處理及繪圖,采用SPSS 26.0進行單因素方差分析和多重比較。
2 結果(Results)
2.1 草甘膦對苦草種子萌發及幼苗生長的影響
如圖1所示,草甘膦處理組苦草種子發芽率在第1天和第2天時略低于對照組,但第3天時51.20 mg·L-1和204.80 mg·L-1草甘膦處理組發芽率明顯升高,且高于對照組。第7天至第9天,草甘膦處理組與對照組間發芽率的差異開始顯現,除12.80 mg·L-1處理組外,其他處理組的發芽率均高于對照組。隨著培養時間的延長,苦草種子發芽率增長速率逐漸減緩并趨于穩定,第14天時各組發芽率大小依次為處理組51.20 mg·L-1>0.80 mg·L-1>3.20 mg·L-1>12.80 mg·L-1>0.20 mg·L-1>0.05 mg·L-1>204.80 mg·L-1>對照組,其中51.20 mg·L-1處理組發芽率顯著高于對照組(P<0.05)。
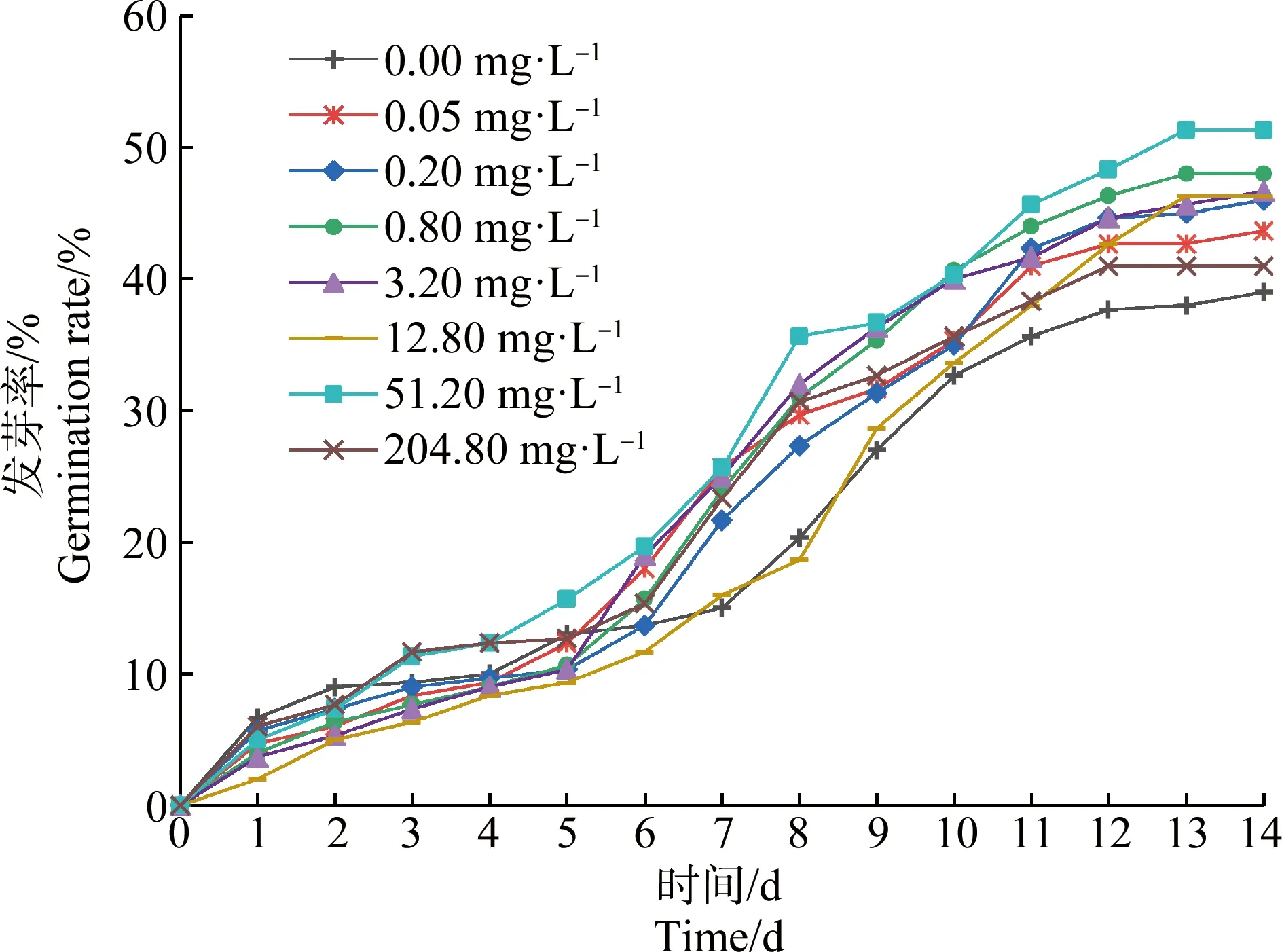
圖1 草甘膦對苦草種子發芽率的影響Fig. 1 Effects of glyphosate on germination rate of Vallisneria natans seed
如圖2所示,處理21 d后,0.05~12.8 mg·L-1草甘膦處理組幼苗平均成活率均>80.0%,與對照組相比差異不顯著(P>0.05),但51.20 mg·L-1和204.80 mg·L-1草甘膦處理組幼苗成活率分別為(2.1±1.8)%和0.0%,顯著低于對照組(P<0.05)。
由圖3和圖4可知,苦草幼苗葉長、根長和鮮質量隨草甘膦濃度的增加總體呈先升高后降低的趨勢。草甘膦對苦草幼苗生長存在低劑量促進和高劑量抑制的雙相劑量效應。0.05~12.80 mg·L-1草甘膦處理組苦草幼苗均有真葉形成,其中0.05~3.20 mg·L-1草甘膦處理組幼苗根長、葉長與對照組差異不顯著(P>0.05),0.8 mg·L-1處理組幼苗鮮質量顯著高于對照組(P<0.05),當草甘膦濃度為12.80 mg·L-1時幼苗生長受到抑制,出現主根變短癥狀,根長顯著低于對照組(P<0.05)。隨著草甘膦濃度的升高,幼苗生長受到嚴重抑制,51.20 mg·L-1草甘膦處理組苦草幼苗僅形成短小的子葉和根,204.80 mg·L-1草甘膦處理組種子僅露出胚根且種皮未脫落。采用直線內插法,由抑制率曲線求得草甘膦處理21 d后苦草幼苗根長、葉長和鮮質量的半數抑制濃度分別為13.28、25.57和35.53 mg·L-1,根長對草甘膦脅迫最為敏感。
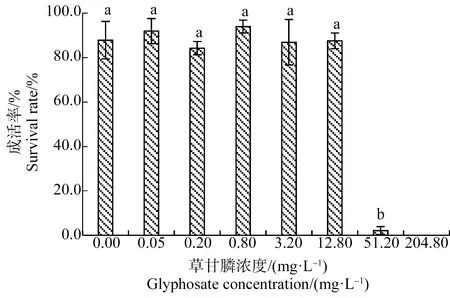
圖2 草甘膦對苦草幼苗成活率的影響注:采用Duncan法進行多重比較,標有相同字母者表示該指標組間差異不顯著(P>0.05),標有不同字母者表示組間差異顯著(P<0.05)。Fig. 2 Effects of glyphosate on survival rate ofVallisneria natans seedlingNote: Duncan method was used for multiple comparisons; the same letters indicated no significant difference between groups (P>0.05), while different letters indicated significant difference between groups (P<0.05).
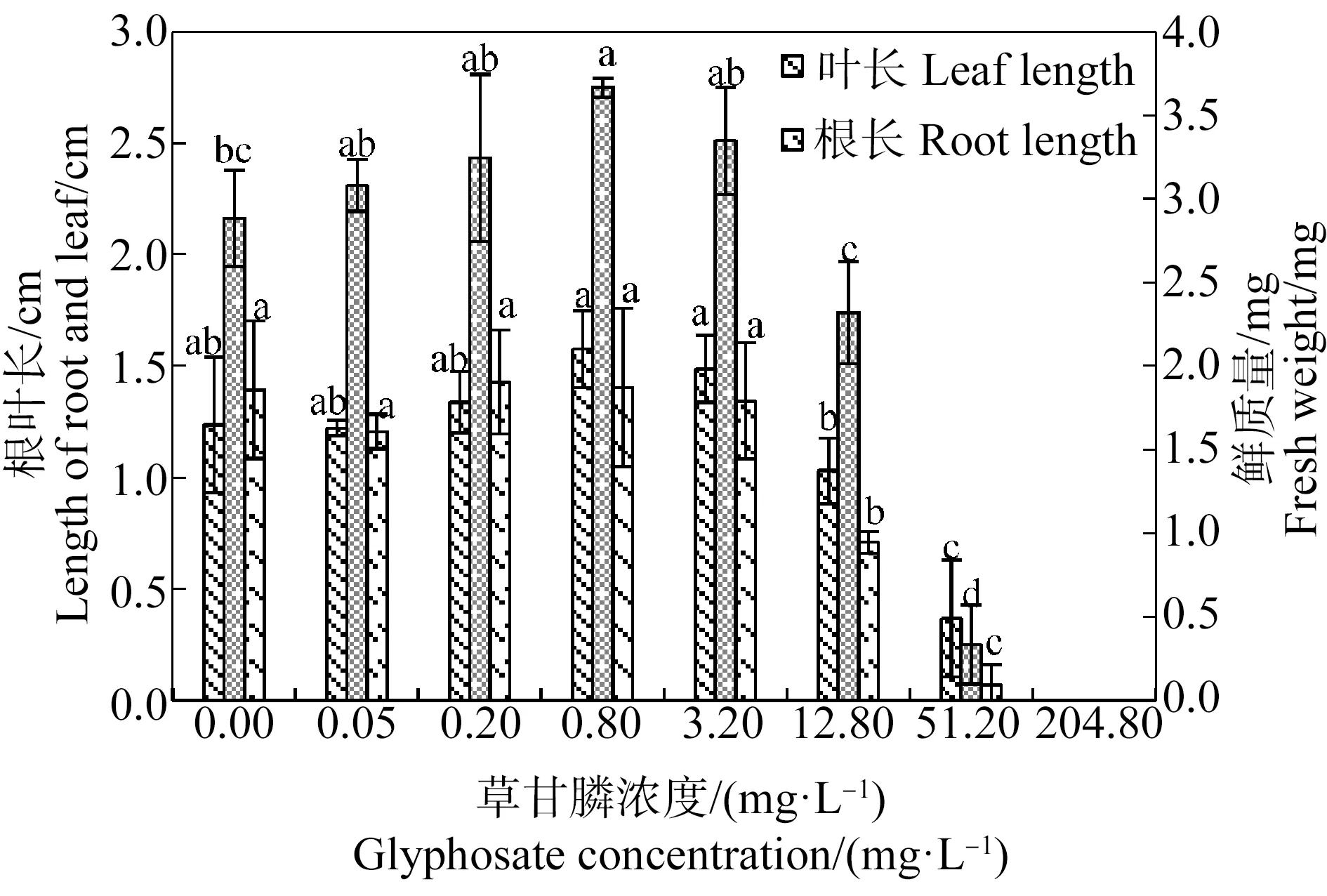
圖3 草甘膦對苦草幼苗根長、葉長和鮮質量的影響注:采用Duncan法進行多重比較,標有相同字母者表示該指標組間差異不顯著(P>0.05),標有不同字母者表示組間差異顯著(P<0.05)。Fig. 3 Effects of glyphosate on root length, leaf length and fresh weight of Vallisneria natans seedlingNote: Duncan method was used for multiple comparisons; the same letters indicated no significant difference between groups (P>0.05), while different letters indicated significant difference between groups (P<0.05).

圖4 第21天時對照組和草甘膦處理組苦草幼苗形態注:(a) 對照組;(b) 0.05 mg·L-1;(c) 0.20 mg·L-1;(d) 0.80 mg·L-1;(e) 0.32 mg·L-1;(f) 12.80 mg·L-1;(g) 51.20 mg·L-1;(h) 204.80 mg·L-1。Fig. 4 Seedling morphology of Vallisneria natans in control and treatment group on the 21st dayNote: (a) Control group; (b) 0.05 mg·L-1; (c) 0.20 mg·L-1; (d) 0.80 mg·L-1; (e) 0.32 mg·L-1; (f) 12.80 mg·L-1; (g) 51.20mg·L-1; (h) 204.80 mg·L-1.
2.2 草甘膦對苦草幼苗可溶性蛋白質的影響
可溶性蛋白質是植物體內重要的滲透調節物質,有助于維持細胞正常代謝,促進細胞滲透勢和功能蛋白數量的增加,提高植物的抗逆性[17]。如圖5所示,對照組和處理組間苦草幼苗可溶性蛋白質含量無顯著差異,但隨草甘膦濃度的增加其含量有升高趨勢。
2.3 草甘膦對苦草幼苗抗氧化酶活性及丙二醛含量的影響
SOD、CAT和POD是植物體內的保護酶,可清除植物細胞內的活性氧(ROS),減少細胞的氧化損傷[16]。如圖6所示,處理21 d后草甘膦處理組SOD總活性與對照組間差異不顯著,3.2 mg·L-1和12.8 mg·L-1處理組SOD總活性顯著高于0.8 mg·L-1草甘膦處理組(P<0.05)。CAT活性隨處理組草甘膦濃度的升高有上升趨勢,但處理組和對照組間無顯著差異。除0.20 mg·L-1草甘膦處理組POD活性顯著低于對照組(P<0.05)外,其他處理組POD活性與對照組差異不顯著。MDA是細胞膜脂質過氧化產物,其含量可反映植物遭受逆境傷害的程度[16]。由圖7可知,0.05、0.20和3.20 mg·L-1草甘膦處理組MDA含量顯著低于對照組,0.80 mg·L-1和12.80 mg·L-1草甘膦處理組MDA含量與對照組差異不顯著。總體上,處理21 d后苦草幼苗抗氧化酶(SOD、CAT、POD)活性及MDA含量在草甘膦脅迫下與對照組相比未見顯著升高,植物細胞膜未受到明顯的氧化損傷。

圖5 草甘膦對苦草幼苗可溶性蛋白質含量的影響注:采用Duncan法進行多重比較,標有相同字母者表示該指標組間差異不顯著(P>0.05),標有不同字母者表示組間差異顯著(P<0.05)。Fig. 5 Effect of glyphosate on soluble protein content ofVallisneria natans seedlingNote: Duncan method was used for multiple comparisons; the same letters indicated no significant difference between groups (P>0.05), while different letters indicated significant difference between groups (P<0.05).
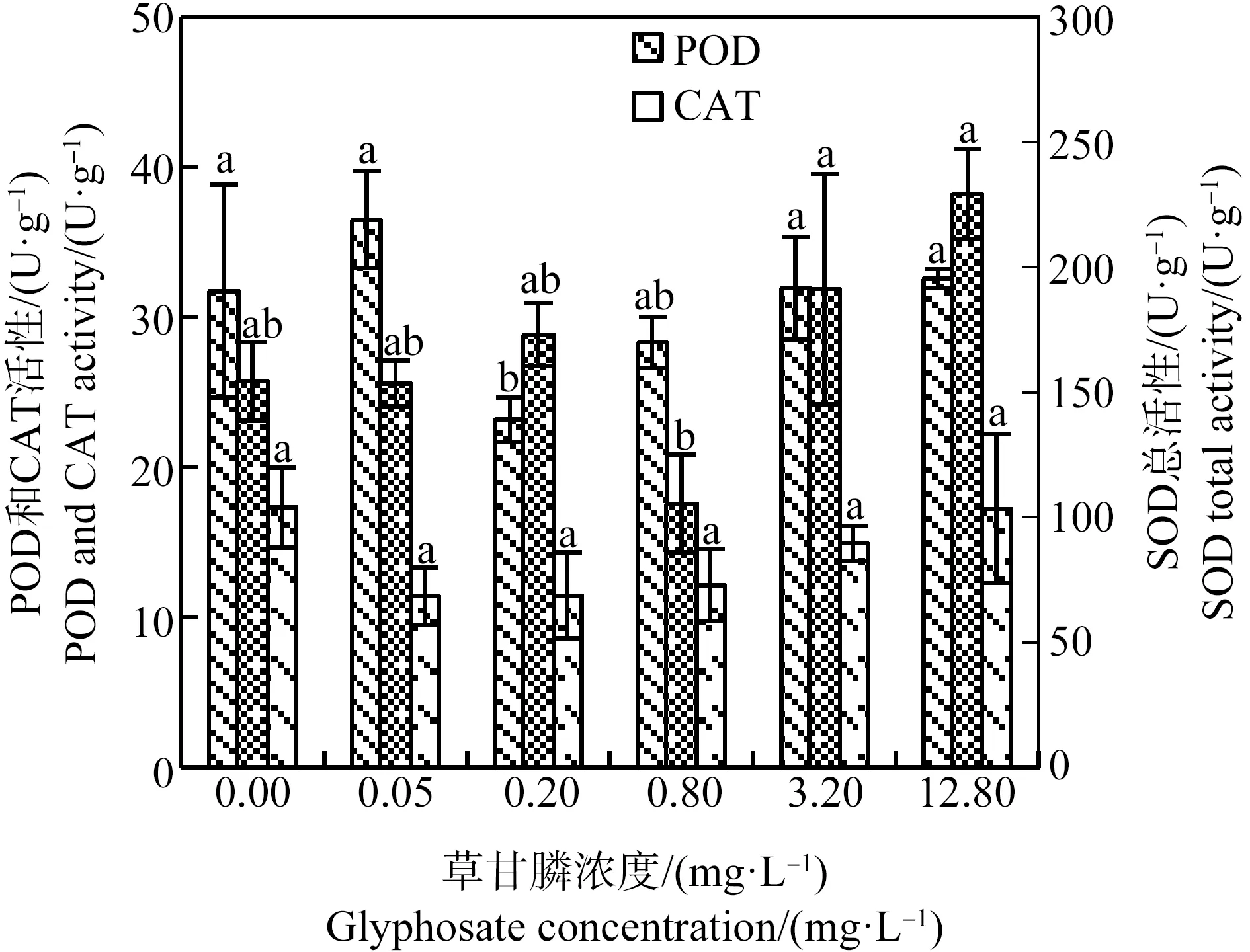
圖6 草甘膦對苦草幼苗抗氧化酶活性的影響注:SOD、CAT和POD分別表示超氧化物歧化酶、過氧化氫酶和過氧化物酶;采用Duncan法進行多重比較,標有相同字母者表示該指標組間差異不顯著(P>0.05),標有不同字母者表示組間差異顯著(P<0.05)。Fig. 6 Effects of glyphosate on antioxidant enzyme activities of Vallisneria natans seedlingNote: SOD, CAT and POD are abbreviations of superoxide dismutase, catalase and peroxidase respectively, and Duncan method was used for multiple comparisons; the same letters indicated no significant difference between groups (P>0.05), while different letters indicated significant difference between groups (P<0.05).

圖7 草甘膦對苦草幼苗MDA含量的影響注:MDA表示丙二醛;采用Duncan法進行多重比較,標有相同字母者表示該指標組間差異不顯著(P>0.05),標有不同字母者表示組間差異顯著(P<0.05)。Fig. 7 Effect of glyphosate on MDA content ofVallisneria natans seedlingNote: MDA is the abbreviation of malondialdehyde, and Duncan method was used for multiple comparisons; the same letters indicated no significant difference between groups (P>0.05), while different letters indicated significant difference between groups (P<0.05).
2.5 草甘膦對苦草幼苗葉綠體色素含量的影響
草甘膦對苦草幼苗葉綠體色素含量存在低劑量促進作用。如圖8所示,苦草幼苗葉綠體色素含量總體隨草甘膦濃度的增加呈先上升后下降的趨勢。0.20 mg·L-1草甘膦處理組葉綠素a和葉綠素b含量較高,顯著高于0.05、3.20和12.80 mg·L-1草甘膦處理組(P<0.05)。0.80 mg·L-1草甘膦處理組類胡蘿卜素含量較高,顯著高于對照組以及0.05 mg·L-1和12.80 mg·L-1草甘膦處理組(P<0.05)。除12.80 mg·L-1草甘膦處理組葉綠素a含量顯著低于對照組(P<0.05)外,其他處理組葉綠體色素含量與對照組差異不顯著(P>0.05)。
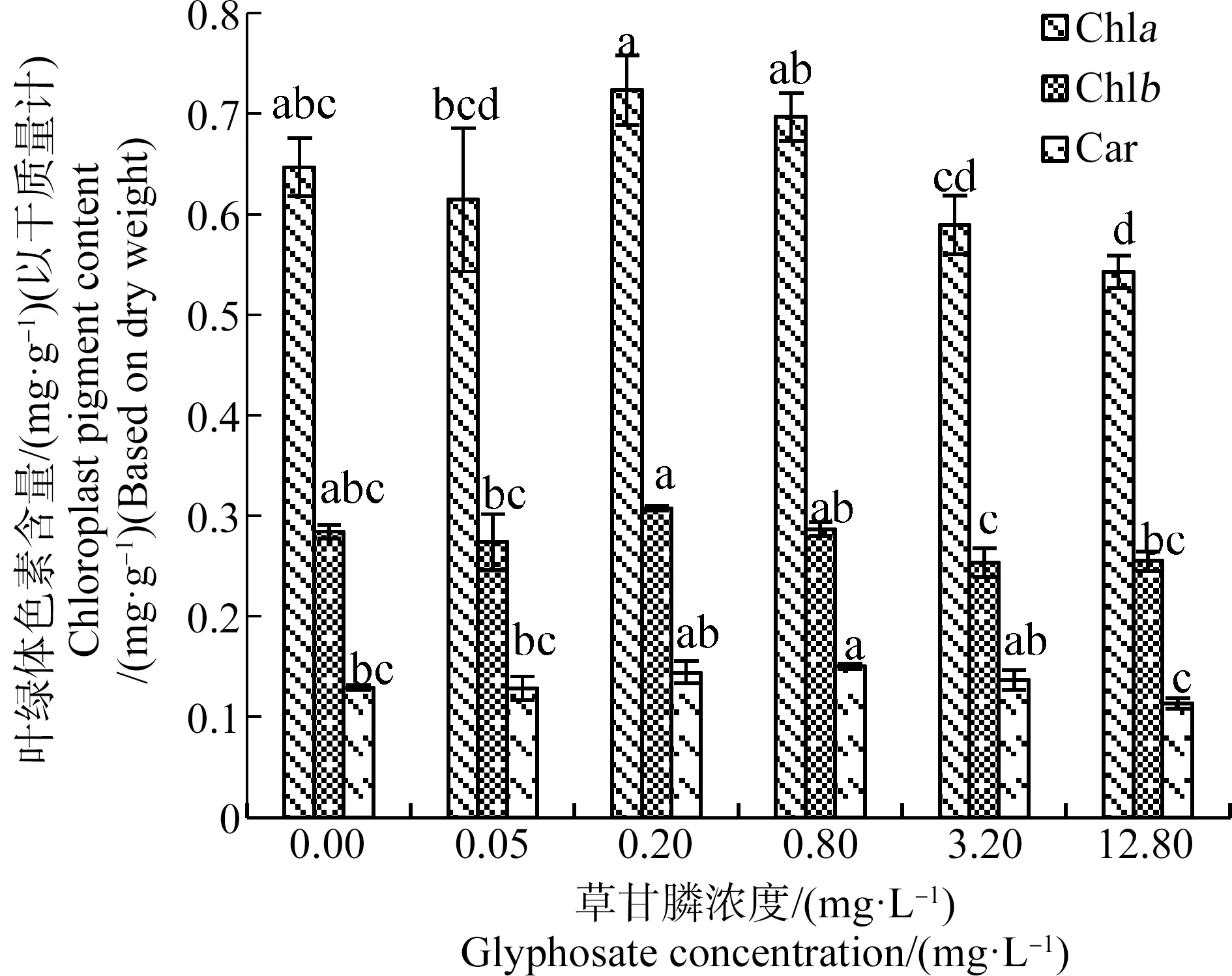
圖8 草甘膦對苦草幼苗葉片葉綠體色素含量的影響注:Chla、Chlb和Car分別表示葉綠素a、葉綠素b和類胡蘿卜素;采用Duncan法進行多重比較,標有相同字母者表示該指標組間差異不顯著(P>0.05),標有不同字母者表示組間差異顯著(P<0.05)。Fig. 8 Effects of glyphosate on chloroplast pigment content of Vallisneria natans seedlingNote: Chla, Chlb and Car are abbreviations of chlorophyll a, chlorophyll b and carotenoid respectively, and Duncan method was used for multiple comparisons; the same letters indicated no significant difference between groups (P>0.05), while different letters indicated significant difference between groups (P<0.05).
3 討論(Discussion)
生物體具有生理調節功能,暴露于低劑量毒物時,能保持機體的相對穩定。隨著暴露水平的提高,生物體處于代償狀態,機體結構和功能發生變化。當劑量超出生物體的代償能力,可導致代償失調,引起病理性損傷,劑量繼續升高則可導致生物體死亡[18]。研究發現,草甘膦可刺激苦草種子萌發,第14天時草甘膦處理組苦草種子發芽率均高于對照組,其中51.20 mg·L-1處理組發芽率顯著高于對照組(P<0.05)。草甘膦可能通過影響苦草線粒體電子傳遞鏈,誘導體內過氧化氫(H2O2)累積,間接刺激苦草種子的萌發。Gomes和Juneau[19]研究發現草甘膦可抑制線粒體電子傳遞鏈中電子在復合體Ⅲ上的傳遞,引起浮萍(LemnaminorL.)體內H2O2的積累。H2O2是ROS的一種,有很強的氧化能力,高濃度ROS對生物功能分子有破壞作用,低濃度ROS可作為信號分子,參與細胞增殖、分化、凋亡以及對逆境的適應[20]。文景锜等[21]研究發現,外源添加H2O2可促進燕麥種子萌發。ROS對種子萌發的促進作用與其參與種子胚乳弱化、休眠解除等生理過程有關[22]。
處理21 d后,0.05~12.40 mg·L-1草甘膦處理組幼苗成活率與對照組差異不顯著(P>0.05),但51.20 mg·L-1和204.80 mg·L-1草甘膦處理組幼苗成活率顯著低于對照組(P<0.05)。草甘膦對幼苗的生長抑制及其導致的植物自養失敗可能是51.20 mg·L-1和204.80 mg·L-1草甘膦處理組幼苗死亡的原因。種子萌發經歷從異養到自養的過程。萌發時,種子中貯藏的有機物在酶的作用下水解為糖、氨基酸等營養物質供幼胚(苗)生長。隨著幼苗葉片的形成,植物通過光合作用制造自身所需的物質進行自養[20]。草甘膦可抑制5-烯醇丙酮莽草酸-3-磷酸合酶(EPSPS)的活性,使莽草酸途徑中芳香族氨基酸合成受阻,干擾植物生長所需的蛋白質的合成[23]。如圖4所示,51.20 mg·L-1和204.80 mg·L-1草甘膦處理組苦草幼苗生長受到抑制,未能發育出可以進行光合作用的葉片,種子中貯藏的有機物耗盡后,無法通過光合作用進行自養,最終因缺乏營養物質而死亡。
草甘膦對苦草幼苗葉長、鮮質量和葉綠體色素含量存在低劑量促進、高劑量抑制的雙相劑量效應,即毒物興奮效應(hormesis)。草甘膦是一種廣譜滅生性除草劑,但其在低劑量下多表現出對植物的生長刺激[24]。Xu等[25]研究發現,銅綠微囊藻的生長速率和光合作用活性在草甘膦暴露下呈現出典型的毒物興奮效應,低劑量草甘膦脅迫下銅綠微囊藻光合作用相關蛋白上調,光合活性增加。Khan等[26]研究發現,低劑量草甘膦可誘導番茄幼苗葉片中葉綠體的伸長,提高幼苗光合作用速率,對幼苗苗高和干質量有促進作用。低劑量草甘膦脅迫下,苦草幼苗可能通過增加葉綠體色素含量,提高光合作用速率,促進植株生長。此外,Agathokleous等[27]研究認為,外源性壓力對植物產生的hormesis效應可能與植物內源性雙相壓力機制有關。植物體內的ROS具有雙相劑量效應,ROS水平的少量增加在維持生理功能時可起到信號分子的作用,并參與氧化還原生物學過程,但高水平的ROS會引起氧化應激造成脂質、蛋白質和DNA的損傷[28]。Choudhary等[29]研究發現,ROS可促進細胞的增殖和分化,調控植物的生長和發育過程。由于草甘膦會抑制線粒體電子傳遞導致H2O2的積累[18],低劑量草甘膦對苦草幼苗葉長、鮮質量和葉綠體色素含量的促進作用可能與植物體內ROS的調控有關。
0.05~12.80 mg·L-1草甘膦處理組苦草幼苗可溶性蛋白質含量與對照組無顯著差異,但隨草甘膦濃度的升高有上升趨勢。植物可通過積累可溶性蛋白質增強對草甘膦脅迫的適應能力和抗性[17]。逆境脅迫下抗氧化酶系統會產生適應性誘導反應以清除機體內過量的ROS。當ROS的產生超出抗氧化酶系統的清除能力,抗氧化酶活性會受到抑制,過量的ROS會導致膜脂質過氧化產物MDA的累積,并引起細胞的氧化損傷[20]。處理21 d后,0.05~12.80 mg·L-1草甘膦處理組苦草幼苗抗氧化酶(SOD、CAT、POD)活性和MDA含量與對照組相比未見顯著升高。有研究發現,隨著草甘膦處理時間的延長,馬唐抗氧化酶活性及MDA含量呈先升高后降低的趨勢,第12天時,450、900和1 800 g·hm-2草甘膦處理組馬唐MDA含量和POD活性均降至對照水平[30]。在抗草甘膦大豆幼苗中也觀察到類似現象,處理17 d后,在正常水分條件下,0.00~0.92 kg·hm-2草甘膦處理組和對照組間抗草甘膦大豆幼苗抗氧化酶活性差異不顯著(P>0.05)[31]。這表明,一定濃度下草甘膦對植物造成的氧化脅迫可隨處理時間的延長得到緩解。苦草幼苗可能通過生理調節如增加光合作用速率和積累可溶性蛋白等滲透調節物質緩解逆境脅迫,提高了幼苗對草甘膦的耐受性。
本研究中,苦草幼苗根長、葉長和鮮質量的21 d半數抑制濃度分別為13.28、25.57和35.53 mg·L-1,草甘膦濃度為51.2 mg·L-1和204.80 mg·L-1時可顯著降低幼苗成活率。由于草甘膦田間施藥時藥液中草甘膦的濃度約為1.3~7.5 g·L-1,在近岸或直接向水體施用草甘膦可能對苦草生長存在潛在風險。Geng等[32]對我國甘肅、廣西、河北、吉林、江蘇、遼寧、內蒙古和四川8個省(自治區)的76個地點共196個地表水樣品進行了檢測,草甘膦的檢出率為14.3%,最大殘留濃度32.49 μg·L-1。此外,草甘膦在云南哈尼梯田魚稻共作系統[3]、江蘇太湖[4]、浙江飲用水源地[5]的最大殘留濃度分別為153.82、19.10和5.93 μg·L-1。研究發現,0.05~3.20 mg·L-1草甘膦處理組苦草種子發芽率、幼苗成活率、幼苗根長、葉長與對照組差異不顯著,并觀察到低劑量草甘膦對苦草幼苗葉長、鮮質量和葉綠素含量存在促進作用。鑒于我國地表水中草甘膦殘留水平普遍低于0.20 mg·L-1,草甘膦對苦草的毒性效應以低劑量促進作用為主,其對沉水植物苦草的生態風險可以接受。一些研究發現,草甘膦對藻類也存在“低促高抑”現象。暴露于質量濃度為10~1 000 μg·L-1草甘膦制劑下的金藻在指數生長期具有較高的豐度[33]。草甘膦濃度為2.4~228.2 μg·L-1時對四尾柵藻細胞密度和最大光能轉化效率(Fv/Fm)表現出顯著的刺激作用[34]。水環境中低劑量草甘膦可能促使藻類大量繁殖形成水華,對水生態系統存在潛在風險。由于苦草在低劑量草甘膦暴露下生長狀況良好,或可通過種植苦草等沉水植物以營養競爭的方式抑制藻類生長。
綜上所述,本研究結果表明,草甘膦對苦草種子萌發有一定的促進作用,但高劑量草甘膦可抑制幼苗生長,影響葉片發育,降低幼苗存活率。草甘膦對幼苗根長、葉長和鮮質量的21 d半數抑制濃度分別為13.28、25.57和35.53 mg·L-1,根長對草甘膦脅迫較為敏感。草甘膦對苦草生長及葉綠體色素含量存在低劑量促進、高劑量抑制的雙相劑量效應。一定程度上,苦草幼苗可通過生理調節緩解草甘膦脅迫。

